铜及氧化铜纳米颗粒对浮萍、藻类的毒性效应及机理研究进展
2020-11-13何莹楚梦玮刘洋刘若晴段文焱仇浩
何莹,楚梦玮,刘洋,*,刘若晴,段文焱,仇浩
1. 昆明理工大学环境科学与工程学院,云南省土壤固碳与污染控制重点实验室,昆明 650500 2. 上海交通大学环境科学与工程学院,上海 200240
与微米级或块状的铜和氧化铜相比,铜纳米颗粒(Cu NPs)及氧化铜纳米颗粒(CuO NPs)具有更优的磁性[1]、导电性[2]和光化学特性[3],且其对太阳能及红外线具有较强的吸收能力[1],因此,常被添加到纳米磁性材料、导电胶、光伏电池、太阳能接收器和多功能传感器等产品中。这些产品的大量生产和使用,使得Cu NPs、CuO NPs的排放量也持续增多,最终可能通过大气沉降、地表径流和地下渗透等多种途径进入到天然水体中[4],对水生生物产生潜在危害,如图1所示。作为水生生态系统的主要初级生产者,水生植物(如藻类、浮萍、睡莲和芦苇等)对食物链结构及水生生态系统的稳定性有着重要作用[5-6],其受污染或死亡将对水生生态系统造成严重损害。

图1 铜纳米颗粒(Cu NPs)和氧化铜纳米颗粒(CuO NPs)在环境中的迁移、转化及归趋Fig. 1 Transport, transformation and fate of copper nanoparticles (Cu NPs), copper oxide nanoparticles (CuO NPs) in the environment
研究发现,水生植物对污染物具有较强的吸收和富集能力[7],Cu NPs、CuO NPs及其释放的Cu2+能够快速进入水生植物体内,产生毒性效应。李芳芳等[8]研究发现,水中Cu NPs释放的Cu2+能为中肋骨条藻所吸收,抑制藻光合作用的进行,进而促使藻密度和叶绿素含量降低。同时,进入水生植物体内的Cu2+、Cu NPs或CuO NPs会在其根部、叶片中不断积累[5],通过食物链的富集,逐渐向高营养级生物体内蓄积,从而对环境中其他生物乃至人类健康产生威胁。
目前,对于Cu NPs和CuO NPs致毒机理的解释仍存在争议。比如,金属基纳米颗粒毒性主要源于纳米颗粒本身还是其释放的金属离子?二者的毒性效应及致毒机理是否存在差异?金属基纳米颗粒与其释放的铜离子之间是否存在交互作用?这一系列的科学问题尚待解决。有研究表明Cu NPs和CuO NPs的毒性主要来源于铜离子[9],也有研究认为纳米颗粒本身才是毒性作用的主导因子[10]。而无论是离子还是纳米颗粒,均能诱导生成活性氧(ROS),产生氧化胁迫,造成细胞膜、细胞器和DNA的损伤。因此,仅从脂质过氧化这一表象无法判断纳米颗粒的毒性来源。此外,金属基纳米颗粒会向水相中持续释放金属离子,即使是被内吞后位于细胞质中[11];释放的金属离子也能被还原为金属单质[12]。环境的pH值、溶解性有机质(DOM)、离子强度、温度及紫外线等因素均能影响二者间的这种转化过程,从而改变Cu NPs和CuO NPs对水生植物的毒性效应。故量化纳米颗粒及其释放的金属离子对水生植物毒性效应的贡献是当下相关研究中的重点及难点。
因此,本文选取浮萍和藻类为毒性指示生物,综述Cu NPs、CuO NPs对这2种水生植物的毒性效应及致毒机理的研究进展,重点剖析Cu NPs和CuO NPs的粒径、表面涂层以及pH值、DOM、温度、紫外线等环境因子对水生植物毒性效应的贡献。提出当前区分细胞内外Cu2+、Cu NPs及CuO NPs毒性效应方法存在的弊端,并对今后的研究方向进行了展望,以期为含铜纳米材料的风险评估提供理论依据。
1 Cu NPs、CuO NPs对不同水生植物毒性效应(Toxic effects of Cu NPs and CuO NPs on different aquatic plants)
现有研究常采用毒性指标(如半数致死剂量(LC50)、半数效应浓度(EC50)、最大无作用浓度(NOEC)),结合生理生化指标(如植物的叶绿素含量、酶含量)的方法来定量描述金属基纳米颗粒对水生植物的毒性效应。其中,脂质过氧化产物——丙二醛(malonaldehyde, MDA)的含量高低常被用来反映脂质过氧化程度及毒性强弱[13]。而超氧化物歧化酶(SOD)、过氧化氢酶(CAT)及过氧化物酶(POD)等愈伤组织分泌的抗氧化酶能够降低胞内ROS的浓度,在一定范围内保证细胞的正常代谢及生长,如SOD能够歧化O2-·、O2和H2O2,而CAT和POD能够催化H2O2还原成H2O[13]。
1.1 浮萍
浮萍(duckweed),又称青萍、田萍和水浮萍,因其生长迅速、繁殖能力强,常被用于水体修复和生态毒理学研究[14]。CuO NPs能够抑制浮萍生长,包括减少叶片数量、缩短根长、降低光化学效率、减少叶绿素含量及干重等[15]。吕琨淼[5]发现CuO NPs(<50 nm)能够使浮萍(LemnaminorL.)叶片数、总面积和干重分别减少70%、50%和56%,7 d-EC50为150 μg·L-1;利用透射电子显微镜(TEM)和X射线能谱分析仪(EDS),还可观测到CuO NPs在浮萍叶细胞的细胞壁、细胞质、液泡和叶绿体上均有分布,且叶绿体发生皱缩,类囊体分层不明显。Shi等[16]将浮萍(Landoltiapunctata)暴露于CuO NPs(10~15 nm)中仅4 d,其EC50为0.8 mg·L-1;而Lalau等[17]将同种浮萍暴露于70 nm的CuO NPs中7 d,发现即使在最高暴露浓度(10 g·L-1)时都未达到50%的抑制率。造成二者研究结果存在差异的原因可能是选用的CuO NPs粒径不同,详见2.1的讨论。此外,Song等[18]研究了Cu NPs对不同种类浮萍的总叶面积相对生长率的影响,发现Cu NPs(25 nm)暴露对紫萍(S.polyrhiza)的168 h-EC50为(1.15 ± 0.09) mg·L-1、对L.minor的168 h-EC50为(0.84 ± 0.12) mg·L-1、对芜萍(W.arrhiza)的168 h-EC50为(0.64 ± 0.05) mg·L-1,可见不同类型的浮萍对Cu NPs、CuO NPs毒性效应的敏感度也存在差异。
1.2 藻类
藻类结构简单,没有真正的根、茎、叶和维管束,因而具有敏感、生长周期短、易于分离培养及观测等优点,常被作为模式生物[19]用于水环境污染状况监测[20]中。Cu NPs、CuO NPs对藻类植物的毒性主要体现在降低其光合色素含量,破坏细胞膜通透性和抑制生长等方面。同种纳米颗粒对不同的藻类毒性效应也存在差异。齐金秋[21]发现暴露在CuO NPs下96 h的莱茵衣藻(Chlamydomonasreinhardtii, FACHB-265)的单个藻细胞光合色素含量减少了7%~20%,EC50为306.54 mg·L-1。Wan等[22]将热带小球藻(Chlorellasp., CHSS26-2)暴露于CuO NPs下96 h,也发现藻细胞叶绿素a的含量下降了50%,EC50为104 mg·L-1。可见,相同暴露时间内,CuO NPs对热带小球藻的毒性更强,是莱茵衣藻的2倍~3倍,不同藻类品种的耐受性差异及CuO NPs的粒径差异均可能导致以上现象的产生。
1.3 Cu NPs、CuO NPs的致毒机理
Cu NPs、CuO NPs在水中会溶解释放Cu2+,纳米颗粒本身与释放的Cu2+均会对水生植物产生毒性[23-24]。如图2所示,二者进入细胞的方式不同,故产生毒性的过程也有所差异。由于植物细胞壁的孔径<5 nm[25],小粒径的纳米颗粒(<5 nm)易穿过植物细胞壁到达细胞膜表面,再通过内吞、膜表面载体蛋白的运输等方式进入细胞内部,与高尔基体、内质网等不同细胞器结合[5]。这不仅干扰了亚细胞结构的新陈代谢,还能诱导产生ROS,导致脂质、蛋白质等过氧化,引起细胞膜、细胞器和DNA的损伤;还会增加细胞膜的通透性,使细胞丧失正常功能甚至死亡。当过多小粒径(<5 nm)的纳米颗粒附着于细胞膜表面时,还会阻塞离子通道,阻碍细胞内外的离子交换,破坏细胞的胞吐过程而导致细胞死亡[26]。大粒径的纳米颗粒则直接被阻挡在植物细胞壁外,通过静电作用附着于细胞壁表面[27],对细胞产生遮蔽效应,阻碍光合作用的进行,从而抑制植物光合色素的合成[21]。对于Cu2+而言,其离子半径较小(0.073 nm),小于水生植物细胞壁孔径,更易通过细胞壁微孔及离子通道进入植物细胞体内。Cu2+可能的致毒机理主要包括以下2个方面:(1)进入水生植物体内破坏了原本的离子平衡,干扰了细胞质膜的转运、酶的代谢及细胞内部的电子传递等过程,阻碍了正常离子的吸收、运输、渗透和调节等功能[28];(2)在细胞内的累积,诱导产生ROS,导致氧化还原失衡,从而抑制植物生长[29]。对比以上致毒机理发现,Cu NPs、CuO NPs和Cu2+均能诱导产生ROS,引起氧化胁迫,造成细胞膜、核膜、细胞器和DNA等的氧化损伤。而纳米颗粒与Cu2+诱导ROS产生的机制是否一致?二者作用的细胞器是否存在差异?未溶解完全的纳米颗粒是否可以通过代谢排出体外?这一系列问题还有待深入研究。
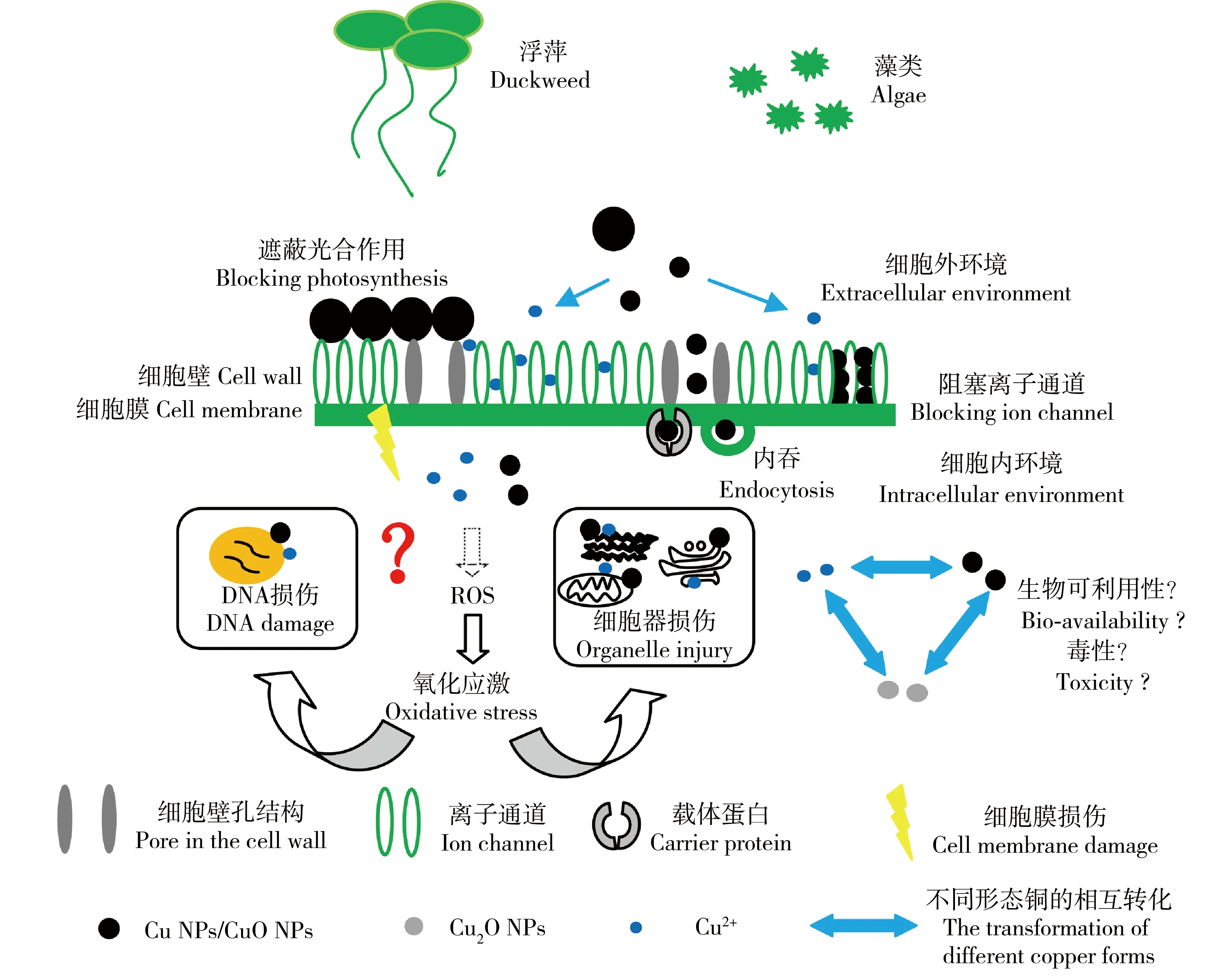
图2 Cu NPs、CuO NPs对水生植物(浮萍、藻类)细胞的制毒机理图[30]注:ROS表示活性氧。Fig. 2 Toxicity mechanisms of Cu NPs and CuO NPs to aquatic plants (duckweed and algae) cells[30]Note: ROS stands for reactive oxygen species.
目前,关于如何区分Cu2+和纳米颗粒本身的毒性贡献仍存在较大争议。有学者认为,Cu NPs、CuO NPs对水生植物的毒性主要来源于Cu2+。Lalau等[17]发现在CuO NPs的胁迫下,浮萍的线粒体及叶绿体膜均有损伤,但在电镜下并没有观测到细胞内存在纳米颗粒,因此,推测是CuO NPs释放的Cu2+所致。但也有人认为纳米颗粒才是毒性的主要来源。高嫄[10]通过对比试验发现,CuO NPs对青萍叶状体相对生长率、根伸长、鲜重和叶绿素含量的抑制程度都大于Cu2+(Cu2+浓度相当于CuO NPs离子释放量的2倍)。但上述方法在区分水生植物的毒性效应来源上仍不够严谨。Cu NPs、CuO NPs与Cu2+间的转化是一个动态的过程,由于细胞内存在液相环境,进入细胞内的纳米颗粒也可能继续释放Cu2+,进入细胞的金属离子在DOM存在的情况下也可能会被重新还原为金属单质[31],如图2所示。因此,Cu NPs、CuO NPs在水环境及水生植物体内的迁移转化过程非常复杂,如何量化铜离子和纳米颗粒对水生植物的毒性贡献仍是目前区分毒性效应来源的关键。Song等[32]运用响应加成模型(response addition model)[33]对释放的铜离子及纳米颗粒对水蚤的毒性进行了区分,在今后水生植物毒性的相关研究中可进一步验证该模型的适用性。
2 Cu NPs、CuO NPs的浓度及特性对水生植物毒性效应的影响(Effects of concentration and properties of Cu NPs and CuO NP on their toxicity to aquatic plants)
2.1 颗粒粒径
通常认为Cu NPs、CuO NPs的粒径越小,毒性越大。一方面,纳米颗粒的粒径越小,比表面积越大,与溶液接触越多,越易溶解释放Cu2+,增加Cu的生物可利用度。Rippner等[34]就发现22 nm的CuO NPs的溶解率(约45%)>50 nm的CuO NPs(约30%)。另一方面,纳米颗粒粒径越小,越易通过细胞壁渗透到细胞内部,促使Cu的积累。崔静等[35]研究发现,CuO NPs对金鱼藻叶绿素合成的抑制作用显著大于微米氧化铜,且CuO NPs在金鱼藻内的积累量是微米氧化铜的6倍~12倍。小粒径的纳米颗粒能够直接通过细胞膜、核膜孔径以及离子通道等直接进入细胞内[36];而大粒径纳米颗粒则可能通过主动运输、吞噬作用或直接破坏细胞膜完整性进入植物体内[37]。Wang等[30]发现,粒径<5 nm的CuO NPs可直接穿过细胞壁和细胞膜被原核藻类铜绿微囊藻(Microcystisaeruginosa)所吸收。因此,粒径越小的Cu NPs、CuO NPs对水生生物的潜在风险越大。
2.2 Cu NPs、CuO NPs的浓度对毒性强弱的影响
Cu NPs、CuO NPs对水生植物的毒性也存在剂量效应关系[23]。有研究表示,低浓度的CuO NPs反而会促进藻类的生长,即毒物兴奋效应[35]。这可能是由于低剂量的Cu NPs能够促使浮萍细胞分泌SOD、CAT和POD,该类抗氧化酶能够清除植物体内过量的ROS,从而调动植物的生理生化代谢和繁殖的积极性[38],对细胞起保护作用,使其免受ROS的危害[10]。而当Cu NPs、CuO NPs浓度不断升高,颗粒易发生团聚,遮光效应加剧,水生植物光合作用速率下降[21];植物细胞内的ROS浓度也随之升高,细胞膜通透性改变,造成细胞膜结构和功能的损伤。高嫄[10]研究发现,增加CuO NPs浓度,其释放的Cu2+含量也会增加,对青萍的生长抑制作用也随之增加。当CuO NPs浓度为200 mg·L-1时,青萍的相对生长率、根长和鲜重增加量只有空白对照的40%、23.3%和49.1%。同时,SOD、CAT、POD酶及MDA的含量也随CuO NPs浓度的增加而逐渐升高,这说明,CuO NPs浓度的升高也可能会诱导青萍细胞产生更多的ROS,造成青萍过氧化程度加剧。Zhang等[39]也观测到当CuO NPs的浓度从10 mg·L-1增大至30 mg·L-1时,蛋白核小球藻(Chlorellapyrenoidosa)的数量下降了28%。但以上研究中并未对不同CuO NPs浓度下Cu2+的吸收量及细胞内的积累量进行定量分析。为更好地反映Cu NPs、CuO NPs与水生植物毒性间的剂量关系,在今后相关研究中应该重点关注植物细胞对纳米颗粒及Cu2+的吸收量和累积量。
2.3 纳米颗粒的表面覆盖层
为了增强纳米颗粒的分散性或防止纳米颗粒被腐蚀,人们常在纳米颗粒表面覆盖涂层(如丙烯酸和苯乙烯单体的聚合物[40]),但这些涂层可能也会对水生生物的生长和发育产生影响。王朝晖等[41]发现,丙烯酸对棕囊藻具有致死作用(96 h-LC50为50.73~72.41 mg·L-1)。Perreault等[40]发现将莱茵衣藻(C.reinhardtii)暴露在4 mg·L-1聚合物涂层包裹的CuO NPs(CS-CuO NPs)下6 h,其所产生的ROS是暴露在40 mg·L-1裸露CuO NPs下的3倍~4倍。且CS-CuO NPs处理下藻的光合系统活性(13%)要显著小于裸露CuO NPs(78%)处理组,藻细胞内Cu的累积量也是裸露CuO NPs的6.5倍。这可能是由于CS-CuO NPs比CuO NPs具有更好的分散性,颗粒尺寸小,更易被细胞吸收进入细胞内部产生ROS;也有可能是聚合物涂层和细胞表面之间的一些相互作用促进了CS-CuO NPs在藻类细胞内的渗透,导致其毒性更强。纳米涂层材料与纳米颗粒间是否存在相互作用,相互作用是否会影响其与细胞的作用,还需深入研究,这将有助于准确评估涂层纳米颗粒的潜在毒性风险。
3 不同环境因子对Cu NPs、CuO NPs毒性效应的影响(Effects of different environmental factors on the toxicity of Cu NPs and CuO NPs)
Cu NPs、CuO NPs在水相中的环境行为和生物效应不仅取决于纳米颗粒的浓度、粒径及其表面涂层材料等特性,还受各种环境因子的影响,如pH值、DOM、温度及紫外线等。在评价Cu NPs、CuO NPs对水生植物的毒性效应时,这些环境因子的改变会影响纳米颗粒的表面电荷、离子释放和沉降速率等,从而影响Cu NPs、CuO NPs的水生植物的毒性。
3.1 水体pH值

(1)
(2)
(3)
式中:s为固体,l为液体,aq为溶液。
另外,溶液pH值与Cu NPs、CuO NPs的等电点(pHzpc)之间的关系决定了纳米颗粒的表面电荷性质,影响纳米颗粒与水生植物的静电作用,从而影响Cu NPs、CuO NPs的生物可利用度及毒性。Miao等[46]发现,当pH值由5升至10时,CuO NPs(pHzpc= 8.6)在水生生物膜上的吸附量由62.1 mg·g-1减少至16.3 mg·g-1。这是因为当水相的pH>pHzpc时,CuO NPs表面带负电,其与带负电荷的水生植物之间会静电排斥,因此纳米颗粒的吸附量减少[46],CuO NPs的生物可利用度降低,其对水生植物的毒性被削弱。因此,水体的pH值不但控制着纳米颗粒金属离子的析出,也影响着Cu NPs、CuO NPs与水生植物的结合。量化不同pH值条件下不同形态铜(如固态铜、游离铜、有机结合态铜和无机结合态铜)的浓度,将有助于分析Cu NPs、CuO NPs的生物可利用度大小及毒性强弱。
3.2 暴露时间
Cu NPs、CuO NPs的水生植物毒性效应还与暴露时间有关。如Melegari等[47]发现,在0.1 mg·L-1CuO NPs的作用下,暴露24 h和48 h的莱茵衣藻(暴露72 h,EC50= (150.45 ± 1.17) mg·L-1,NOEC<100 mg·L-1)的细胞数量和类胡萝卜素含量无明显变化,而72 h后莱茵衣藻的细胞密度显著降低,叶绿素和类胡萝卜素含量均有降低。通过测定MDA含量发现,暴露(CuO NPs = 1 mg·L-1)72 h后,藻细胞的脂质过氧化水平比24 h的高约40%,比48 h的高约20%。这说明,试验初期藻细胞的脂质过氧化水平较低,随暴露时间的延长,脂质过氧化水平逐渐升高,从而抑制了藻细胞的生长和光合色素的合成。齐金秋[21]还发现在CuO NPs胁迫初期(0~24 h),莱茵衣藻细胞内核苷酸的释放量较少,细胞膜通透性较低;随暴露时间的延长(24~96 h),藻细胞膜的结构遭到破坏,细胞膜通透性增加促使更多的核苷酸释放。此外,Cu2+的释放量与时间成正比[16],短时间内CuO NPs只析出少量的Cu2+,不足以对藻类生长产生明显抑制;但随着暴露时间的延长,Cu2+的析出量不断增加,抑制作用明显增强。
3.3 溶解性有机质
水体中富含大量DOM,其与Cu NPs、CuO NPs间的相互作用是影响纳米颗粒水生植物毒性的又一重要因素[43]。DOM的存在可能增强纳米颗粒的水生生物毒性。一方面,高浓度的DOM可能对水生植物产生一定的负面作用。张琛琛[48]发现>20 mg·L-1的富里酸(FA)会抑制蛋白核小球藻细胞的生长。另一方面,由于DOM表面含有酚羟基和羧基等官能团,DOM可与纳米颗粒释放的金属离子发生络合反应[49],促进颗粒溶解[50],提高纳米颗粒的迁移性与生物可利用度。李静[51]发现,无FA环境下CuO NPs的EC50为1.42 mg·L-1,而加入20 mg·L-1的FA能够显著降低CuO NPs的EC50(0.48 mg·L-1),导致CuO NPs对铜绿微囊藻(Microcystisaeruginos)的生长抑制率增加。FA也可提高CuO NPs在水中的分散性,增加CuO NPs与藻细胞的接触机会及吸收利用率,最终导致细胞内ROS的累积及DNA损伤[52]。此外,由于DOM具有较强的电子得失能力(即氧化还原性质)[53],DOM也可能将CuO还原为Cu2O。而Cu2O比CuO具有更强的溶解性,更易被氧化生成Cu2+,从而增强其对水生生物的毒性效应[30]。
另一些研究则报道DOM可以削弱Cu NPs、CuO NPs的毒性。如Zhao等[54]发现,5 mg·L-1和40mg·L-1的FA会通过表面吸附的包裹作用和静电排斥阻碍CuO NPs与细胞膜间的接触,从而降低CuO NPs对细菌生长量的抑制作用。而对于水生生物而言也可能存在同样的机理。Rippner等[34]也发现加入FA、胡敏酸(HA)后CuO NPs对浮萍的相对叶面积抑制率大大降低,且运用Visual Minteq 3.1软件分析发现FA、HA能够降低Cu2+的含量、增加溶液中铜的有机络合量。但目前对水相中Cu NPs、CuO NPs不同存在形态(如游离铜、络合铜及固态铜)的生物可利用度判定仍存在争议,尤其是络合态铜的生物可利用性仍是研究中的难点。探究金属不同形态的生物可利用度对评估DOM存在下金属基纳米颗粒的生物毒性有着重要意义。
3.4 温度及紫外线
除以上因素,Cu NPs、CuO NPs对水生植物的毒性还受温度和紫外线等因素的影响。
温度主要从2个方面影响Cu NPs、CuO NPs对水生植物的毒性。(1)温度影响着水生植物的生长代谢及其对环境的抵抗力,不同藻类在温度波动下表现出较大的适应性差异。覃宝利等[55]发现短期温度波动会显著增加铜绿微囊藻的游离多糖含量,降低固着多糖和总多糖含量,但对蛋白核小球藻的多糖含量并无显著影响。(2)温度会影响Cu NPs、CuO NPs在水体中的动态溶解过程,影响纳米颗粒的生物可利用度。由于溶解是一个吸热过程,当水体温度上升时,溶解平衡向促进溶解方向进行。金属的溶解度增大,析出离子增多,对水生植物生长的抑制效果增强[56];反之,金属溶解度降低,析出离子减少。
紫外线的增强也会加剧Cu NPs、CuO NPs对水生植物的毒性作用。研究表明,紫外线本身会阻碍水生植物的光合作用[57],严重时还会造成植物的细胞损伤[58]。李宏文和张纬[59]发现,在148.8 lx的紫外线条件下照射8 h,浮萍的CAT活性(活性峰值=1.52)与对照组相比有所升高(活性峰值=1.00),且植物体叶片出现褪绿变黄的现象。而在Cu NPs、CuO NPs存在下,紫外线可能会加剧脂质过氧化,导致细胞膜通透性增加,促进Cu在细胞内的累积。Regier等[60]发现,经过CuO NPs处理的伊乐藻在增加紫外照射时其体内的SOD、POD等酶的活性均有增加,ROS的生成增多,细胞膜通透性增加,使得藻细胞内Cu的累积量增加了3.6倍。
4 问题与展望(Problems and prospects)
综上所述,在Cu NPs、CuO NPs对水生植物毒性研究中存在的主要问题包括以下3点:
(1)致毒机理仍存争议,其主要原因有:由于液相介质中Cu NPs、CuO NPs会缓慢释放Cu2+,这一动态过程导致难以对细胞内外纳米颗粒及释放的Cu2+进行准确定量,因此,难以区分纳米颗粒本身和Cu2+的毒性贡献及毒性强弱。此外,铜形态在植物细胞内外的转化过程复杂(Cu NPs、CuO NPs、Cu2O NPs和Cu2+),如何对不同形态铜进行定量分析是今后研究中应该关注的重点。
(2)在对于涂层纳米颗粒的毒性研究中,还不能确认毒性的主导因子是纳米颗粒本身还是涂层材料。现有的大多数研究只考虑到纳米颗粒与涂层的联合作用,并没有单独对涂层的毒性进行定量评估,涂层厚度或含量是否会影响纳米颗粒的毒性也是需要攻克的难点。
(3)另外,Cu NPs、CuO NPs的环境行为及对水生植物的毒性效应还受pH值、DOM、温度及紫外线等环境因子的影响。以上因子不仅影响着铜的形态转化,还会改变水生植物的生长代谢。考虑多重环境因子的综合作用将有利于准确评估Cu NPs、CuO NPs对水生植物的毒性效应。
致谢:非常感谢刘佳齐同学在文献搜集上给予的帮助。
◆
