专利视角下丙肝相关研究发展态势剖析*
2020-11-13齐燕张冉*严舒
齐 燕 张 冉* 严 舒
(中国医学科学院医学信息研究所/图书馆,北京100020)
丙型肝炎是一种全球性流行病,根据世界卫生组织2018年统计,约1.8亿人感染了丙型肝炎病毒(Hepatitis C Virus,HCV),全球 HCV的感染率约为3%,每年新发丙型肝炎病例约3.5万例[1,2]。丙型肝炎可导致肝脏慢性炎症坏死和纤维化,部分患者可发展为肝硬化甚至肝细胞癌(Hepato Cellular Carcinoma,HCC),在日本、韩国、新加坡、美国等高收入国家,HCV是导致肝癌的主要病因[3],对患者的健康和生命危害极大[4]。对此,全球多家制药公司包括艾伯维 (AbbVie)、百时美施贵宝 (Bristol-Myers Squibb)、吉利德(Gilead)、美国强生 (Johnson&Johnson)、默克集团(Merck&Co)和罗氏 (Roche)以及我国的歌礼制药、正大天晴等,纷纷致力于丙肝药物的研发与制造,为这一公共卫生问题带来了突破性的进展。近几年,丙肝治疗领域经历了由传统抗病毒疗法(干扰素+利巴韦林的联合方案)到口服直接抗病毒药物(Direct-acting Antiviral Agents,DAA),再到基因疗法的演进,丙型病毒性肝炎逐步进入治愈时代。从市场角度,随着欧美丙肝患者被大规模治愈,药物需求呈现萎缩趋势;而根据中国疾病预防控制中心统计数据[5],2004年我国丙肝发病数近4万例,2012年至2017年期间,每年都超过20万例,市场需求越来越大。在全球丙肝市场都趋于饱和的情况下,中国市场已成为制药巨头谋求业绩增长的新大陆,受益于中国政府相关政策的利好推动,从2017年起跨国药企、我国本土药企纷纷将目光锁定中国丙肝治疗市场,我国的丙肝药物竞争已进入白热化状态[6]。本研究旨在通过对丙肝研究领域相关专利的分析,揭示该技术领域专利活动的特点、展现全球研究的技术研发态势,并结合市场和产品信息分析竞合态势,以期为我国在该领域的研发和产业发展提供情报支撑。
1 数据来源与分析工具
数据来源于德温特(Derwent Innovation,DI)分析平台,为追求较高的查准度,选择德温特手工代码字段进行分析和检索,根据人工判读制定检索式为:“MAN=(B14-A02A7 OR B14-A02B9 OR C14-A02A7 OR C14-A02B9)AND TS=hepatitis”,专利公开时间跨度为1981—2018年,检索时间为2019年2月22日,经进一步的人工筛选之后共得到4402项专利家族的检索结果。以4402项专利家族的基础专利所构成的数据集为研究对象,运用专利计量方法从申请年、受理国家、技术趋势、专利权人及其合作态势等方面进行统计分析,有助于了解领域整体发展态势。
科学知识图谱与信息可视化理论的研究在国际科学学研究领域的兴起,为专利计量与合作网络的研究提供了新的方法。随着相关学者利用合作网络图谱开展大量研究,社会网络分析法已经成为研究技术创新合作的成熟方法。本文开展机构间的协同合作分析时,首先利用德温特数据分析(Derwent Data Analyzer,DDA)软件进行数据清洗,剔除专利权人为个人的记录,建立机构型专利权人的合作矩阵,进而利用UCINET软件对专利权人合作网络进行可视化呈现。
2 领域整体发展态势
2.1 全球专利申请时间趋势
全球专利年度申请数量趋势如图1所示,HCV研究领域专利申请数量总体呈现持续增长及持稳态势,可大致划为三个阶段:第一阶段(1999—2002年)是HCV研究领域专利的快速增长期,由1999年的十几项发展到2002年的200多项,增长速度较快;第二阶段(2003—2011年)是HCV研究领域专利的稳步发展期,这个阶段专利申请数量总体呈现平稳持续增长,增长幅度不大,在2008和2011年分别超过300项;第三阶段是2012—2016年,该阶段HCV研究领域专利处于平缓发展期,专利申请总量连续增加,但是年申请量有增有减,处于200~300项之间。由于2017—2018年申请专利尚未完全公开,所以数据比实际偏小,按照变化规律推测应该依然处于平缓发展期或衰退初期。

图1 HCV研究专利申请趋势Fig.1 Patent Application Trend of HCV Research
2.2 全球专利申请地域分布
对HCV研究领域专利的受理国家/地区情况进行分析,可以在一定程度上反映HCV相关诊断治疗技术和药物等可能的市场区域布局。统计TOP10受理国家/地区及其受理专利数量,如表1所示。其中,美国第一,数量为826项;中国第二,数量为504项;位居第三的日本仅有123项,其余均在100项以下。向世界知识产权组织(WO)、美国(US)和中国(CN)提交申请的专利合计数量占所有记录总数的89%,其中WO专利数量为2578项;这种重视国际申请的行业战略显示出该领域的市场增长潜力,同时美国和中国已经形成并将继续呈现较强的HCV诊治技术和药物的研发及销售的竞争格局。

表1 TOP10国家/地区受理专利数量分布Tab.1 Distribution of Patents Accepted by TOP10 Countries/Regions
2.3 技术类别及趋势
HCV研究领域专利涉及123个4位IPC分类号,从数量上看主要隶属A和C类。其中,出现频次前10的主要IPC技术类别如图2所示,“A61K”“A61P”两个类别所占比重最高,均超过专利总量的70%,可见,HCV相关药物的特定治疗活性研究、药物配制等是专利技术研发和申请的重点。这10个类别是HCV研究领域的主要研究方向,对HCV药物研发产业的发展尤为重要。
由DI平台统计基于本文数据集的HCV研究领域关键技术主题类别年度专利数量及发展趋势如图3所示。

图2 HCV研究领域专利主要IPC类别及数量分布Fig.2 Types and Number Distribution of Patented IPCs in the Field of HCV Research

图3 不同技术主题类别专利数量年度变化趋势Fig.3 Annual Trends in the Number of Patents of Different Technical Subject Categories
可以看出,HCV研究领域的重点技术类别为“治疗,癌症,疾病,制药,管理,紊乱”“治疗,疾病,紊乱,控制释放,感染,癌症”和“化合物”,它们出现在86%的检索结果中,一定程度上说明“治疗”“癌症”“制药”“控制释放”是HCV研究领域专利解决的主要问题。如图3所示,这三类技术的发展路径和趋势更为相似,2000—2002年呈现一种突飞猛进的趋势,在2003—2005年间有所回落后又在2008年和2010年达到峰值;其中,前两者又分别在2013和2012年又再次达到峰值;近几年都有所减少,但依然是HCV研究领域的关键主题。其余7个技术类别中,“癌症,感染,治疗,核苷,衍生物,疾病”在近几年增长较快,在2016年数量位居第四;“细胞”和“治疗,癌症,抗体,蛋白质,疾病”两个类别在2002年达到峰值后呈现逐渐缩减的趋势;其余类别专利总量及年度数量都相对较小,变化较为平缓。
3 重要专利权人机构及其优势领域
3.1 重要专利权人机构分析
全球HCV研究领域相关专利申请数量较多的前10位专利权人为:百时美施贵宝、先灵葆雅、勃林格殷格翰、艾伯维、吉利德、Vertex制药、诺华、默沙东、罗氏制药、Angeletti。这些机构中6家为美国企业,2家为瑞士企业,其余2家分别是德国和意大利企业,再次印证美国的技术研发实力走在世界前列。通过分析申请机构在特定IPC类别上的专利数量占其全部专利数量的比例可以看出该机构的技术侧重点,将其与其他机构对比则可以评估机构在技术类别上的竞争力,统计TOP10专利权人机构各自的重点技术布局类别及关键细类的专利数量比例如图4所示。
总体看,如上所述,十家机构在A61K、A61P、C07D上的专利数量占比较多;具体到细类,在A61K0031、A61P0031、A61K0038等类别上的专利数量占比最多,说明TOP10机构在这几种技术上竞争力较强。具体来看:
1)药物,癌症,疾病(A61K)领域:艾伯维所拥有的专利数量占比最高,达到了44%;其次是默沙东(41%)、诺华(40%)、吉利德(38%)等;其余几家企业都在30%~35%之间。
2)化合物(C07D)技术领域:百时美施贵宝的专利占比最高,为32%;其次是吉利德(29%);最少的是先灵葆雅,仅15%。
3)治疗,紊乱,控制释放(A61P)技术领域:诺华的专利占比最高,为30%;其次是百时美施贵宝(27%)、Angeletti(26%)等;最少的是艾伯维,仅16%。
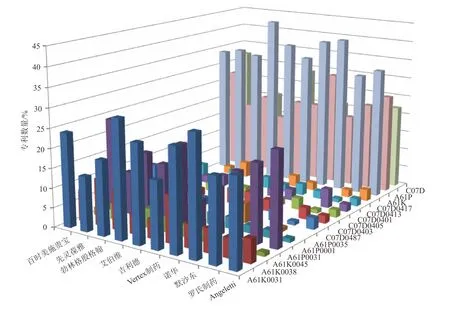
图4 TOP10机构重点技术类别专利比例分布Fig.4 Proportion Distribution of Primary Technology Categories of TOP10 Institutions
4)含有有机活性成分的药物制剂(A61K0031)技术领域:默沙东和艾伯维的专利占比都是最高,达到30%;诺华、吉利德、百时美施贵宝分别为26%、25%、24%。
5)持续释放治疗剂(A61P0031)技术领域:百时美施贵宝和Angeletti的专利占比都是最高,达到24%;吉利德和罗氏制药分别为21%、20%;其余机构的占比均在20%以下。
6)含肽类药物制剂(A61K0038)技术领域:先灵葆雅和Vertex制药的专利占比都是最高,均为12%;勃林格殷格翰为10%;其余机构的占比均低于10%。
3.2 重要专利权人的优势技术领域和重要药品
按照国家统计TOP10专利权人机构各自的TOP3技术类别(称为优势技术领域)及其细类的分布比例和重要药品信息梳理如下。
3.2.1 百时美施贵宝(美国)
研发新药百立泽(Daklinza),并提出与其他药物联合使用的鸡尾酒疗法,比如百立泽(盐酸达拉他韦片)与速维普(阿舒瑞韦软胶囊)联合、百立泽与其它药物如索磷布韦联合等;2017年4月百立泽®(盐酸达拉他韦片)和速维普®(阿舒瑞韦软胶囊)获批在中国上市,用于成人慢性丙型肝炎的联合治疗,是中国市场的首个口服丙肝DAA药物[7],由于疗程长达24周,目前临床已经弃用。
其在HCV专利方面,属于“药物制备类”(A61K)领域的专利占34%,其中“含有有机活性成分的药物制剂”(A61K0031)占24%,“含肽类药物制剂”(A61K0038)占8%,“含有非成组提供活性成分的药物制剂”(A61K0045)占2%。
属于“化合物”(C07D)领域的专利占32%,其中“戊二酰亚胺类抗菌素”类(C07D0487)占8%,“杂环化合物,激酶抑制剂,紊乱,调节剂,喹唑啉,治疗,癌症”类(C07D0403)占6%,其余类型的杂环化合物类(C07D0405、C07D0498、C07D0401、C07D0413)均占 3%。
属于“化合物或药物制剂的特定治疗活性研究”(A61P)领域的专利占27%,其中“持续释放治疗剂”(A61P0031)占24%,“致病性减毒,嗜碱性细胞,嘧啶二胺衍生物,慢性疾患”(A61P0001)占1%。
3.2.2 先灵葆雅(美国)
在被默沙东收购之前,研发了佩乐能(Pegintron)、SCH503034等,SCH503034是一种口服的丝氨酸蛋白酶抑制剂,可以直接抑制丙肝病毒的复制,是当时丙肝治疗的新方向[8]。
其在HCV专利方面,属于“药物制备类”(A61K)领域的专利占35%,其中“含有有机活性成分的药物制剂”(A61K0031)占14%,“含肽类药物制剂”(A61K0038)占12%,“含有非成组提供活性成分的药物制剂”(A61K0045)占4%。
属于“化合物或药物制剂的特定治疗活性研究”(A61P)领域的专利占18%,其中“持续释放治疗剂”(A61P0031)占11%,“致病性减毒,嗜碱性细胞,嘧啶二胺衍生物,慢性疾患”(A61P0001)占2%,“阿片类激动剂,酪氨酸激酶抑制剂”(A61P0043)占2%。
属于“治疗,癌症,抗体,蛋白质,结合,疾病”(C07K)和“化合物”(C07D)两个类别的专利各占15%,其中,“芳香阳离子,肽,抗体药物”(C07K0005)占8%,“多肽组合,特异性氨基酸序列,免疫治疗,癌症,拟肽,大环”(C07K0007)占4%,其他类型的化合物(C07D0209,C07D0401,C07D0403,C07D0491,C07D0417)各占2%~3%左右。
3.2.3 艾伯维(美国)
拥有艾诺全®(格卡瑞韦哌仑他韦片,Mavy-ret,glecaprevir/pibrentasvir)、维建乐®Viekirax®(奥比帕利片)、易奇瑞®Exviera®(达塞布韦钠片)三个丙肝治疗药品[9]。艾诺全®(格卡瑞韦哌仑他韦片)是一款泛基因型丙肝治疗方案,对于初治、无肝硬化的所有主要基因型(基因1-6型)的丙肝患者,疗程短至8周,2019年3月凭借“较上市产品有治疗优势”被列入中国国家药品监督管理局药品审评中心(CDE)发布的第二批《临床急需境外新药名单》[10],于5月15日获得中国国家药品监督管理局(NMPA)批准,用于治疗基因1~6型慢性丙型肝炎病毒感染的无肝硬化或代偿期肝硬化成人患者[11]。
其在HCV专利方面,属于“药物制备类”(A61K)领域的专利占44%,其中“含有有机活性成分的药物制剂”(A61K0031)占30%,“含肽类药物制剂”(A61K0038)占5%,“含有非成组提供活性成分的药物制剂”(A61K0045)占5%。
属于“化合物”(C07D)领域的专利占18%,其中“嘧啶,抑制剂,喹唑啉酮,调节剂”类(C07D0239)占5%,“杂环化合物,激酶抑制剂,紊乱,调节剂,喹唑啉,治疗,癌症”类(C07D0403)占5%,“戊二酰亚胺类抗菌素”类(C07D0487)占2%。
观察两组治疗效果情况。治疗效果判定标准[4]:①显效:咳嗽、哮喘、发热等症状完全消失或明显好转;②有效:咳嗽、哮喘、发热等症状有所好转;③无效:咳嗽、哮喘、发热等症状无变化或恶化;总有效率为显效率与有效率之和。
属于“化合物或药物制剂的特定治疗活性研究”(A61P)领域的专利占16%,其中“持续释放治疗剂”(A61P0031)占15%,“肿瘤,新分离物,酪氨酸激酶抑制剂”(A61P0035)占1%。
3.2.4 吉利德(美国)
先后研发了索华迪(索磷布韦,Sovaldi®,sofosbuvir)、夏帆宁(来迪派韦索磷布韦,Harvoni®,ledipasvir 90 mg/sofosbuvir 400 mg)、丙通沙(索磷布韦维帕他韦,Epclusa,sofosbuvir 400 mg/velpatasvir 100 mg)、沃士韦(Vosevi®,索磷布韦 sofosbuvir 400mg/维帕他韦 velpatasvir 100 mg/伏西瑞韦 voxilaprevir 100 mg)等 4代丙肝药品[12];其中,2013年底吉利德公司的索磷布韦(sofosbuvir)获得FDA批准并上市标志着慢性丙肝的抗病毒治疗真正进入了全口服无 IFN(Interferon,干扰素)的新时代[13],并引发全球丙肝药物市场从2013的50亿美元飙升至2014年的180亿美元,2015年达到顶峰240亿美元,开启了丙肝治愈的全盛时代[14]。夏帆宁 (来迪派韦索磷布韦片,来迪派韦90 mg/索磷布韦400 mg)于2018年12月获得中国国家药品监督管理局批准用于治疗1-6型慢性丙型肝炎[15];丙通沙(索磷布韦/维帕他韦)是中国首个通过审批的泛基因型丙肝单一片剂方案,可用于治疗基因1-6型、混合型及未知型慢性HCV的成人感染患者[16];Vosevi®的疗效更优[17],2019年 6月在中国提交免临床上市申请[6]。
其在HCV专利方面,属于“药物制备类”(A61K)领域的专利占38%,其中“含有有机活性成分的药物制剂”(A61K0031)占25%,“含肽类药物制剂”(A61K0038)占5%,“含有非成组提供活性成分的药物制剂”(A61K0045)占4%。
属于“化合物”(C07D)领域的专利占29%,其中“冷凝环状化合物”类(C07D0491)占5%,“含有两个或两个以上杂环的杂环化合物,其中氮原子是唯一的杂环原子,至少一个环是只有一个氮原子的六元环”(C07D0401)、“杂环化合物,激酶抑制剂,紊乱,调节剂,喹唑啉,治疗,癌症”类(C07D0403)和“杂环化合物,抑制剂,吡啶,衍生物,紊乱,调节剂,激酶抑制剂”(C07D0471)等三个类别各占4%,其余一些化合物类别比如C07D0405、C07D0409、C07D0413和 C07D0417各占3%。
属于“化合物或药物制剂的特定治疗活性研究”(A61P)领域的专利占21%,其中“持续释放治疗剂”(A61P0031)占近21%,“致病性减毒,嗜碱性细胞,嘧啶二胺衍生物,慢性疾患”(A61P0001)占近1%。
3.2.5 Vertex制药(美国)
其在HCV专利方面,属于“药物制备类”(A61K)领域的专利占35%,其中“含有有机活性成分的药物制剂”(A61K0031)占17%,“含肽类药物制剂”(A61K0038)占12%,“含有非成组提供活性成分的药物制剂”(A61K0045)占3%,“以特殊的物理形式为特征的药物制剂”(A61K0009)占2%。
属于“化合物或药物制剂的特定治疗活性研究”(A61P)领域的专利占21%,其中“持续释放治疗剂”(A61P0031)占8%,“致病性减毒,嗜碱性细胞,嘧啶二胺衍生物,慢性疾患”(A61P0001)占3%,“阿片类激动剂,酪氨酸激酶抑制剂”(A61P0043)和“多变量剂量,病理综合征,嗜碱性细胞,嘧啶二胺衍生物”(A61P0037)各占2%。
属于“化合物”(C07D)类别的专利占20%,其中,“杂环化合物,激酶抑制剂,紊乱,调节剂,喹唑啉,治疗,癌症”类(C07D0403)占4%,“含有两个或两个以上杂环的杂环化合物,至少有一个环上只有氮原子和硫原子作为杂环原子,不由基团提供”(C07D0417)和“含氮原子的杂环化合物,是凝聚体系中唯一的环状杂原子,至少有一个环是六元环,有一个氮原子,不由基团提供”(C07D0471)等两个类别各占3%,其他类型的化合 物 (C07D0209, C07D0333, C07D0413,C07D0401)各占2%左右。
3.2.6 默沙东(美国)
研制成功了择必达(ZEPATIER),由NS5a抑制剂艾尔巴韦(elbasvir)和NS3/4a蛋白酶抑制剂格拉瑞韦(grazoprevir)这两种新化学实体(NCEs)组成[19],临床主要用于基因1b型丙肝治疗,2016年在美国获批,2018年在中国获批[20];同时,2009年并购的先灵葆雅(Schering-Plough)公司研发过Boceprevir(SCH503034),2011年 5月 13日美国食品药品管理局(FDA)批准该药上市用于某些成人患者慢性丙型肝炎的治疗,商品名为波普瑞伟(Victrelis);Victrelis是当时慢性丙型肝炎治疗的一个重大进展,可显著提高患者丙肝病毒零检测的机会,从而获得持续病毒应答,成为治疗慢性丙型肝炎的蛋白酶抑制剂中的首个有效药物[21]。
其在HCV专利方面,属于“药物制备类”(A61K)领域的专利占41%,其中“含有有机活性成分的药物制剂”(A61K0031)占30%,“含肽类药物制剂”(A61K0038)占6%。
属于“化合物”(C07D)领域的专利占21%,其中“戊二酰亚胺类抗菌素”类(C07D0487)、“含氮原子的杂环化合物,是凝聚体系中唯一的环状杂原子,不由基团提供”(C07D0405)、“杂环化合物,既包括氧原子是唯一的杂环原子的一个或多个杂环,也包括氮原子是唯一的杂环原子的一个或多个环”(C07D0493)等三个类别各占3%,其他类型的化合物类别,如 C07D0413、C07D0498、C07D0407、C07D0307等各占2%。
属于“化合物或药物制剂的特定治疗活性研究”(A61P)领域的专利占19%,其中“持续释放治疗剂”(A61P0031)占近17%,“致病性减毒,嗜碱性细胞,嘧啶二胺衍生物,慢性疾患”(A61P0001)占近2%。
3.2.7 诺华(瑞士)
曾研制了亲环蛋白抑制剂Alisporivir(DEB-025;Debio-025)[22]。
其在HCV专利方面,属于“药物制备类”(A61K)领域的专利占40%,其中“含有有机活性成分的药物制剂”(A61K0031)占26%,“含肽类药物制剂”(A61K0038)占6%,“含有非成组提供活性成分的药物制剂”(A61K0045)占3%,“含抗原或抗体的药物制剂”(A61K0039)占2%。
属于“化合物或药物制剂的特定治疗活性研究”(A61P)领域的专利占30%,其中“持续释放治疗剂”(A61P0031)占 12%,“抗肿瘤药”(A61P0035)占5%,“致病性减毒,嗜碱性细胞,嘧啶二胺衍生物,慢性疾患”(A61P0001)占3%,其余一些类别比如 A61P0011、A61P0019、A61P0003各占2%。
属于“化合物”(C07D)类别的专利占21%,其中,“含氮原子的杂环化合物,是凝聚体系中唯一的环状杂原子,至少有一个环是六元环,有一个氮原子,不由基团提供”(C07D0471)、“含有两个或两个以上杂环的杂环化合物,其中氮原子是唯一的杂环原子,至少一个环是只有一个氮原子的六元环”(C07D0401)、“杂环化合物,激酶抑制剂,紊乱,调节剂,喹唑啉,治疗,癌症”类(C07D0403)等三个类别各占3%,其他一些类型的化合物比如 C07D0417,C07D0487,C07D0405等各占2%左右。
3.2.8 罗氏制药(瑞士)
在疾病治疗方面,研发了聚乙二醇干扰素α-2a注射液派罗欣®Pegasys®[23]和基因重组α-2a干扰素 Roferon-A(Interferon alfa-2a)[24];在诊断方面,提供血清学与分子诊断在内的HCV感染诊断整体解决方案,包括18分钟即可得到检测结果的Elecsys® anti-HCV II检测,高灵敏度的cobas®HCV RNA检测,帮助临床精确判断患者感染情况[25]。
其在HCV专利方面,属于“药物制备类”(A61K)领域的专利占32%,其中“含有有机活性成分的药物制剂”(A61K0031)占21%,“含肽类药物制剂”(A61K0038)占5%,“含有非成组提供活性成分的药物制剂”(A61K0045)、“以特殊的物理形式为特征的药物制剂”(A61K0009)、“以所使用的非活性成分为特征的药物制剂,例如载体或惰性添加剂;与活性成分化学结合的靶向修饰剂”(A61K0047)等三个类别各占2%。
属于“化合物或药物制剂的特定治疗活性研究”(A61P)领域的专利占23%,其中“持续释放治疗剂”(A61P0031)占20%,“致病性减毒,嗜碱性细胞,嘧啶二胺衍生物,慢性疾患”(A61P0001)占2%,其余一些药物类别比如 A61P0035、A61P0029占1%。
属于“化合物”(C07D)类别的专利占20%,其中,“含有两个或两个以上杂环的杂环化合物,其中氮原子是唯一的杂环原子,至少一个环是只有一个氮原子的六元环”(C07D0401)的专利占5%,“杂环化合物,激酶抑制剂,紊乱,调节剂,喹唑啉,治疗,癌症”类(C07D0403)的专利占3%,“含有两个或两个以上杂环的杂环化合物,至少有一个环上只有氮原子和硫原子作为杂环原子,不由基团提供”(C07D0417)和“含有五元环的化合物且只有三个氮原子作为杂环原子的杂环化合物”(C07D0249)各占2%;其余一些化合物类别,比如 C07D0213、C07D0405、C07D0413、C07D0487、C07D0513、C07D0409各占1%。
3.2.9 勃林格殷格翰(德国)
提出faldaprevir+联合聚乙二醇干扰素和利巴韦林(PegIFN/RBV)方案应用于基因型-1丙型肝炎病毒感染的亚洲初治患者[26]。
其在HCV专利方面,属于“药物制备类”(A61K)领域的专利占34%,其中“含有有机活性成分的药物制剂”(A61K0031)占19%,“含肽类药物制剂”(A61K0038)占10%。
属于“化合物或药物制剂的特定治疗活性研究”(A61P)领域的专利占21%,其中“持续释放治疗剂”(A61P0031)占17%,“致病性减毒,嗜碱性细胞,嘧啶二胺衍生物,慢性疾患”(A61P0001)占2%。
属于“化合物”(C07D)类别的专利占21%,其中,“含有两个或两个以上杂环的杂环化合物,至少有一个环上只有氮原子和硫原子作为杂环原子,不由基团提供”(C07D0417)占4%,“含有两个或两个以上杂环的杂环化合物,至少一个环中只有氮原子和氧原子为杂环原子”(C07D0413)、“含有两个或两个以上杂环的杂环化合物,其中氮原子是唯一的杂环原子,至少一个环是只有一个氮原子的六元环”(C07D0401)各占 3%。其余一些类别,如 C07D0403、C07D0405、C07D0409各占2%。
属于“治疗,癌症,抗体,蛋白质,结合,疾病”(C07K)类别的专利占14%,其中“在完全确定的序列中含有最多四个氨基酸的肽;其衍生物”(C07K0005)占11%,“制备多肽的一般方法,比如色谱法”(C07K0001)占2%,“含有20多种氨基酸的多肽;胃泌激素;生长激素抑制素”(C07K0014)占1%。
3.2.10 Angeletti
其在HCV专利方面,属于“药物制备类”(A61K)领域的专利占34%,其中“含有有机活性成分的药物制剂”(A61K0031)占22%,“含肽类药物制剂”(A61K0038)占6%,“含抗原或抗体的药物制剂”(A61K0039)占2%,其余一些类别,比如 A61K0045、A61K0035、A61K0048各占1%。
属于“化合物或药物制剂的特定治疗活性研究”(A61P)领域的专利占26%,其中“持续释放治疗剂”(A61P0031)占24%,“致病性减毒,嗜碱性细胞,嘧啶二胺衍生物,慢性疾患”(A61P0001)和“阿片类激动剂,酪氨酸激酶抑制剂”(A61P0043)各占1%。
属于“化合物”(C07D)类别的专利占22%,其中,“含有两个或两个以上的杂环且至少一个环有硫原子作为唯一的杂环原子的杂环化合物”(C07D0409)、“含有两个或两个以上杂环的杂环化合物,至少有一个环上只有氮原子和硫原子作为杂环原子,不由基团提供”(C07D0417)、“戊二酰亚胺类抗菌素”类(C07D0487)等三个类别各占 3%,其余一些类别,比如 C07D0413、C07D0401、 C07D0405、C07D0209、 C07D0403、C07D0498、C07D0513等各占2%左右。
4 专利权人合作态势
4.1 总体合作情况
该专利集合共涉及全球1620家机构,在这1620个专利权人(机构)中,曾与其它机构有过合作的机构共905个,占55.86%。其中,仅与一家机构合作过的有432个,占26.68%;与两家机构合作过的有201个,占12.41%;与三个或三个以上机构合作过的有272个,占16.79%。具体合作网络如图5所示,节点代表专利权人机构,节点的大小表征合作机构的数量。右下方形成了几个较为密集的类团,所涉及机构合作频繁,形成了一定的竞争优势及领域核心势力;左边分散的大量机构间也有些零星的合作,相对较为边缘化。
4.2 不同时期合作情况比较
将专利公开年份分为1998—2008年和2009—2018年两个阶段,并截取专利公开数大于5的专利权人构建合作网络如图6(a)和6(b)所示,其中,节点代表专利权人机构,节点的大小取决于与该机构开展过合作的机构的数量,边的粗细代表两个节点机构间合作次数的多少。

图5 1998—2018年全球丙型肝炎专利权人合作网络Fig.5 Global Cooperation Network of Hepatitis C Patentee 1998-2018
如图6(a)所示,1998—2008年,专利公开数大于5的机构共89个,其中罗氏公司合作机构最多为7家,但合作次数都不多,仅为1~3项。合作专利数量最多的是默沙东与先灵葆雅,共16项,主题涉及用于丙肝预防和治疗的几类化合物或衍生物、新型人源化重组抗体分子、液体制剂的研究及其制备方法。图中有两个合作关系相对较为紧密的类团,标为社团1、社团2。其中,社团1包含瑞典麦德维制药(MedivirAB)公司、美国强生、比利时生物技术公司Tibotec等,他们两两或者联合申请了数项专利,而且实际上强生是通过在2002年收购了Tibotec制药才切入到艾滋病以及其他传染病治疗领域。社团2包括意大利公司Angeletti、默沙东、先灵葆雅,以及圣基茨和尼维斯国家的ISISPharm公司、美国罕见病药物制造商ViroPharma、惠氏等,前三者相对更为紧密,同样致力于特定化合物药品的研究。
如图6(b)所示,2009—2018年,专利公开数大于5的机构共135个,其中强生公司合作机构最多为10家,合作次数最多的是雅培和艾伯维公司。社团1是我国和日本的大学、科研院所、医院和企业的合作聚类,包括中国科学院、日本国家传染病研究所、东京大学、京都大学、东京Metropolitan医疗研究所、Toray等,构成了一定的产学研联盟,但是相对而言,日本国内的合作比我国与日本的国际合作更为紧密。社团2是延续第一个时段的强生、麦德维等的合作并有了一些新的合作伙伴,比如Centocor Ortho生物技术有限公司。社团3是政产学研合作的典范之一,包括Idenix公司、蒙彼利埃第二大学、法国国家科研中心、法国国家医学与健康研究院、法国斯特拉斯堡大学、巴黎公共援助医院、美国卫生及公共服务部,以及我国的武汉大学等之间的合作。除了标注出来的社团,在其余机构合作中也有高校与企业间的合作,比如我国的四川大学与常州寅盛药业有限公司等。

图6 1998—2018年全球丙型肝炎专利权人合作网络Fig.6 Global Cooperation Network of Hepatitis C Patentee 1998—2018
由两图对比可发现,相对于1998—2008年,2009—2018年各个节点(代表机构)间连线更加交错复杂,聚类产生的不同节点类团之间也建立了连线关系,说明该领域内机构间的协同合作越来越多,机构间的关系也越来越紧密,并且产生了很多的产学研合作,预计将逐渐形成一个良好的创新生态系统。
5 结论与建议
基于专利视角分析HCV研究领域的发展态势,可以得出四个方面的结论:
1)从专利数量上看,HCV研究经历了成长期的规模式增长后近几年的发展速度相对较为平缓;随着全球抗丙肝创新药物研发趋于成熟,以及具有较好的临床效果药物的出现,该领域专利申请的热情似乎在冷却,但是仍然有一些新的治疗方法的探索,比如丙肝的免疫疗法等。
2)近60%的国际申请(WO)专利体现了全球申请战略是HCV研究的一大特色;具体到国家或地区上,近二十年来美国是最重要的专利布局地,其次是我国;预计未来几年中国市场将是主战场。
3)拥有专利数量前10位的专利权人中,美国占6席,瑞士占2席,德国和意大利各占1席。10家机构全为企业,且各机构的技术类别比较相近,竞争较大。前十大企业具有一定的市场垄断能力,在中国市场也不例外。
4)丙肝研发机构以企业为主,除少数实力较强企业外,大多数企业在丙肝专利研发方面合作专利较多。同时,不仅企业间开展并购、重组,或者联合申请专利等,企业与高校、科研院所间合作创新的积极性越来越大,产学研协同创新趋势愈发明显。
我国发明人每年申请的专利数量在2010年之前均低于30项,2015年达到峰值80项,近几年逐渐减少,与国际变化趋势相同;主要以国内申请为主,国内申请(CN)与国际和其他国家/地区申请(WO、US等)的数量比例约为4.5∶1;拥有专利数量较多的行业重要研发机构既有企业又有高校和科研院所,如中国科学院、第二军医大学、北京大学、武汉大学、南京圣和药业有限公司、广东东阳光药业有限公司、广东一禾药业有限公司等,这点与国外情况略有不同;技术类别主要是C07和A61,以杂环化合物、肽类、药物制剂等为主要研发方向;药物产品相关专利上实力相对薄弱。自2017年以来,共有十一款丙肝DAA药物在我国上市,有六个参与了2019年底的医保准入谈判,其中,默沙东的择必达、吉利德的夏帆宁和丙通沙进入医保(择必达和夏帆宁支付范围为基因1b型丙肝患者,丙通沙则限基因1b型以外的丙肝患者),价格平均降幅在85%以上,艾伯维和歌礼制药被竞争出局[27]。我国已是世界第一丙肝人口大国,但同时国内丙肝药物竞争也已进入白热化状态;本土创新药企业曾经的策略都是“快速跟进”,比如歌礼制药研发了我国首个本土原研丙肝DAA药物——戈诺卫®(达诺瑞韦,ASC08)于2018年6月正式上市[28];同时有其他多家药企如正大天晴、东阳光药、广生堂、石药集团等正在开发相关仿制药;然而医保谈判“战”中跨国药企为维护市场占有率采取非常激进的降价策略却让本土企业承受了“当头一棒”,竞争已经越来越残酷[27]。
基于国内外丙肝相关研究发展态势和市场信息,本文针对本土药企及科研机构提出如下几点建议:
第一,可以考虑细化研究焦点或主题,开展疾病诊断与治疗过程中的精细化研究。如通过检测HCV非结构蛋白5B蛋白中是否存在突变来识别对索磷布韦具有抗药性的HCV感染者、改进病毒载量检测方法等,来关注特殊病患、辅助患者治疗期间及后续恢复期的疾病管理。
第二,尝试根据市场需求和状况调整研究方向,比如改良药物晶型的制备方法、制备新型重组丙型肝炎抗原、以及研发可以治疗自身免疫性疾病、心血管疾病和代谢性疾病等多种疾病的广谱抗病毒化合物或蛋白质等。
第三,尝试扩展研究领域,关注其他疾病,特别是相近的尚未被治愈的疾病领域,如乙肝、艾滋病、癌症等。
第四,进一步深化基础性研究,如探究特定病毒的作用机理及变异规律等方面的信息,以达到能够在一定程度上预测一些新病毒的发生发展的可能性,更为重要的是能够预先研究出可能的应对措施,以帮助人们更好地应对像新冠病毒突发这样的公共安全事件。
第五,企业应加强竞争情报工作建设,及时评估和预测市场状况及前景,依据自身实力及时调整研发和市场战略策略;特别重要地,所有的改变都应具有前瞻性,提早布局抢占先机,才能更好地应对未来我国丙肝市场逐渐萎缩过程中的各种风险。
致谢:特别感谢山东省立医院感染性疾病科马铭泽医师对本文领域专业知识的审核与修正。
