杏鲍菇黄酮的提取及其抗氧化活性研究
2020-11-13王丹阳朱振元代姝函王萱萱谢贝昱
王丹阳,朱振元,代姝函,王萱萱,谢贝昱
(天津科技大学食品科学与工程学院,天津 300457)
杏鲍菇是一种食用大型真菌,因其具有杏仁的香味和菌肉肥厚如鲍鱼的口感而得名,且集食用、药用、食疗于一体[1]。黄酮类化合物具有抗氧化、降血糖、降血脂、抗肿瘤等作用[2-3]。近些年对杏鲍菇黄酮的研究主要集中在提取方面,杏鲍菇黄酮类化合物的分离纯化及活性方面的研究较少[4]。李士慧和王广慧等人[5-6]对杏鲍菇黄酮提取工艺的优化研究较深但在抗氧化活性方面却涉及甚少。试验对杏鲍菇黄酮进行提取的优化、精制及精制前后抗氧化活性的研究,意在杏鲍菇黄酮能够更为广泛地被应用和开发,尤其在活性研究方面。
1 材料与方法
1.1 材料与试剂
新鲜杏鲍菇,市售;无水乙醇、氢氧化钠、盐酸、亚硝酸钠、硝酸铝、邻二氮菲、邻苯三酚、磷酸氢二钾、磷酸二氢钾、硫酸亚铁、过硫酸钾、抗坏血酸,均为分析纯,天津市江天化工技术有限公司提供;芦丁标准品,上海时代生物科技有限公司提供;AB-8 型大孔吸附树脂300-400 目,天津市光复精细化工研究所提供;2,2-联氮基-双-(3-乙基苯并噻唑啉-6-磺酸) 二铵盐(ABTS),北京索莱宝科技有限公司提供;Tris 、1,1- 二苯基-2- 三硝基苯肼(DPPH),美国Sigma 公司提供。
1.2 仪器与设备
WN-500 型粉碎机,天津市康达电器有限公司产品;ESJ205-4 型电子天平,沈阳龙腾电子称量仪器有限公司产品;HS3120 型超声仪,天津市兰博实验仪器设备有限公司产品;HW·SY 型电热恒温水浴锅,北京市长风仪器仪表公司产品;TGL-16B 型台式离心机,上海安亭科学仪器厂产品;SP-2102UV型紫外分光光度计,上海光谱仪器有限公司产品;RE-52AA 型旋转蒸发器,上海亚荣生化仪器厂产品;DHP-2000 型真空干燥箱,上海益恒科技有限公司产品。
1.3 试验方法
1.3.1 黄酮的提取
取50 g 杏鲍菇粉末,按照一定的料液比,加入乙醇溶液后,在一定的超声时间和提取时间下进行提取,得到杏鲍菇黄酮[8-9]。经旋转蒸发仪旋蒸后得到固体杏鲍菇黄酮粗品。
1.3.2 总黄酮含量的测定
(1) 芦丁标准曲线绘制[10]。精确称取芦丁标品10.00 mg,用70%乙醇定容至100 mL,使其质量浓度为100 μg/mL。用70%乙醇梯度稀释成0,20,40,60,80,100 μg/mL。各取1.00 mL 于15 mL 带塞试管中,分别加入70%乙醇1.00 mL,5%亚硝酸钠溶液0.30 mL,摇匀,静置6 min;再加10%硝酸铝溶液0.30 mL,摇匀,静置6 min;再加4%氢氧化钠溶液2.00 mL,加蒸馏水至5 mL,摇匀,静置15 min,以芦丁0 μg/mL 作空白参比液,于波长510 nm 处测定吸光度,重复3 次,取平均值。
(2) 样品总黄酮含量的测定。杏鲍菇黄酮类化合物含量的测定采用硝酸铝显色法[11],精准吸取1 mL待测样品,按标准曲线的制备方法测定样品的吸光度,带入标准曲线方程中,按下式计算杏鲍菇黄酮类化合物的含量(P)。
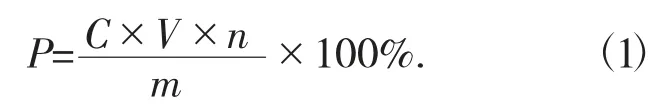
式中:P——杏鲍菇黄酮类化合物的含量,%;
C——黄酮类化合物的质量浓度,μg/mL;
V——样品溶液总体积,mL;
n——样品溶液的稀释倍数;
m——杏鲍菇粉末质量,mg。
1.3.3 提取单因素试验[12-13]
(1) 提取温度对杏鲍菇黄酮提取率的影响。分别设置提取温度为60,70,80,90 ℃共4 个平行试验,在乙醇体积分数为70%,料液比1∶30,提取时间1 h,超声时间15 min 的条件下提取杏鲍菇黄酮,并根据公式(1) 测得提取率。
(2) 乙醇体积分数对杏鲍菇黄酮提取率的影响。分别设置乙醇体积分数为60%,70%,80%,90%共4 个平行试验,在提取温度80 ℃,料液比1∶30,提取时间1 h,超声15 min 的条件下提取杏鲍菇黄酮,并根据公式(1) 测得提取率。
(3) 料液比对杏鲍菇黄酮提取率的影响。分别设置料液比为1∶20,1∶30,1∶40,1∶50(g∶mL) 共4 个平行试验,在提取温度为80 ℃,乙醇体积分数为70%,提取时间1 h,超声时间15 min的条件下提取杏鲍菇黄酮,并根据公式(1) 测得提取率。
(4) 提取时间对杏鲍菇黄酮提取率的影响。分别设置提取时间为1.0,2.0,3.0,4.0 h 共4 个平行试验,在提取温度为80 ℃,乙醇体积分数为70%,料液比1∶30,超声时间15 min 的条件下提取杏鲍菇黄酮,并根据公式(1) 测得提取率。
(5) 超声时间对杏鲍菇黄酮提取率的影响[14]。分别设置超声时间为10,15,20,25 min 共4 个平行试验,在提取温度为80 ℃,乙醇体积分数为70%,料液比1∶30,提取时间1 h 的条件下提取杏鲍菇黄酮,并根据公式(1) 测得提取率。
1.3.4 正交试验设计[15-16]
以提取温度、料液比、乙醇体积分数、提取时间为4 个因素,进行四因素三水平的正交试验,进一步优化杏鲍菇黄酮的提取工艺。
正交试验因素与水平设计见表1。

表1 正交试验因素与水平设计
1.3.5 紫外分光光度计全波长扫描
利用紫外分光光度计全波长扫描法[17]对杏鲍菇提取物进行全波长扫描,测定波长范围为190~800 nm,扫描高度为-0.1~0.5 A,扫描速度为1 800 nm/min。
1.3.6 黄酮的颜色反应
黄酮类化合物分子可与铝盐、镁盐等反应生成络合物[18]。在试管中加入现配的1%三氯化铝溶液2 mL 和杏鲍菇提取液2 mL,静置数分钟观察颜色变化。
1.3.7 AB-8 型大孔吸附树脂静态吸附及静态解析[19]
(1) 静态吸附。称取预处理的AB-8 型大孔吸附树脂3 g,加入90 mL 样液,封口。于温度25 ℃,转速150 r/min 的恒温振荡器上振荡24 h,充分吸附后过滤,取滤液测定黄酮的质量浓度,测定其吸附率。
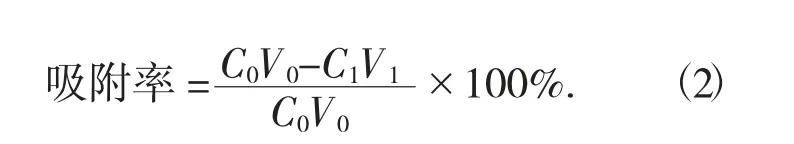
式中:C0——样液的质量浓度,mg/mL;
V0——样液体积,mL;
C1——吸附后液体的质量浓度,mg/mL;
V1——吸附后液体体积,mL。
(2) 静态解析。取上述的AB-8 型大孔吸附树脂3 g,加入90 mL 样液,封口。于温度25 ℃,转速150 r/min 的恒温振荡器上振荡24 h,吸附达到完全饱和的状态,过滤,用蒸馏水冲洗,直至滤液无色,加入70%乙醇90 mL,封口后,置于温度25 ℃,转速150 r/min 的恒温振荡器上振荡24 h,使其完全解析后过滤,测得滤液的黄酮浓度,计算树脂的解析率。
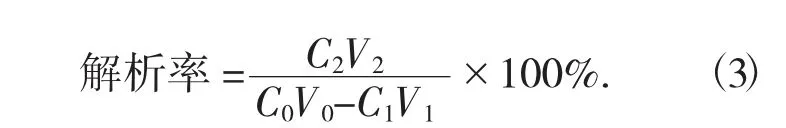
式中:C0——样液的质量浓度,mg/mL;
V0——样液体积,mL;
C1——吸附后液体的质量浓度,mg/mL;
V1——吸附后液体的体积,mL;
C2——解析后液体的质量浓度,mg/mL;
V2——解析后液体的质量浓度。
1.3.8 杏鲍菇黄酮精制单因素试验[20-22]
(1) 上样浓度对杏鲍菇黄酮吸附率的影响。分别设置上样质量浓度为10,15,20,25 mg/mL 4 个平行试验,在上样量为0.7 BV 的条件下进行吸附,待其完全吸附后,用蒸馏水洗柱直至流出的液体无色,测得流出液的黄酮含量,根据公式(2) 计算出杏鲍菇黄酮的吸附率。
(2) 上样量对杏鲍菇黄酮吸附率的影响。分别设置上样量为0.4,0.6,0.8,1.0 BV 4 个平行试验,在上样质量浓度为10 mg/mL 的条件下进行吸附,待其完全吸附后,用蒸馏水洗柱直至流出的液体无色,测得流出液的黄酮含量,根据公式(2) 计算出杏鲍菇黄酮的吸附率。
(3) 洗脱质量浓度对杏鲍菇黄酮解析率的影响。在上样质量浓度为10 mg/mL,上样体积为0.7 BV 的吸附条件下,待其完全吸附后,用蒸馏水洗柱直至流出的液体无色并测得流出液的黄酮含量。分别设置乙醇体积分数为60%,70%,80%,90%,洗脱量为3 BV 的条件下进行洗脱,测的洗脱液的黄酮含量,根据公式(3) 计算出杏鲍菇黄酮的解析率。
(4) 洗脱量对杏鲍菇黄酮解析率的影响。在上样质量浓度为10 mg/mL,上样体积为0.7 BV 的吸附条件下,待其完全吸附后,用蒸馏水洗柱直至流出的液体无色并测得流出液的黄酮含量。分别设置洗脱量为2.0,3.0,4.0,5.0 BV,乙醇体积分数为80%的条件下进行洗脱,测得洗脱液的黄酮含量,根据公式(3) 计算出杏鲍菇黄酮的解析率。
1.3.9 精制后黄酮含量测定
收集上述的乙醇洗脱液,经旋蒸仪旋蒸,真空干燥后得到固体黄酮,用无水乙醇溶解后,制成样品液,根据公式(1) 测定杏鲍菇粗黄酮纯化后总黄酮含量。
1.3.10 体外抗氧化试验[23-26]
(1) 对ABTS 自由基清除能力。取0.5,1.0,1.5,2.0,2.5,3.0 mg/mL 的样品液0.4 mL 与ABTS+溶液振荡均匀,于室温下反应6 min,于波长734 nm 处测得吸光度Ax;相同条件下,用蒸馏水替代待测样品作为对照管测得吸光度为Ao。每个样品测定3 组平行,以抗坏血酸作阳性对照,按照下式计算清除率。

式中:Ao——空白组吸光度;
Ax——样品组吸光度。
(2) 对DPPH 自由基的清除能力。取0.5,1.0,1.5,2.0,2.5,3.0 mg/mL 的样品液2 mL,加入0.2 mmol/L 的DPPH 溶液2 mL,在暗处反应30 min,于波长517 nm 处测得吸光度A1;相同条件下,用无水乙醇代替DPPH 溶液测得吸光度为A2,用无水乙醇代替样品液测得吸光度为A3。每个样品测定3 组平行,以抗坏血酸作阳性对照,按照下式计算清除率。

式中:A1——2 mL 样品液+ 2 mL DPPH 溶液;
A2——2 mL 样品液+ 2 mL 无水乙醇;
A3——2 mL 无水乙醇+ 2 mL DPPH 溶液。
(3) 对超氧阴离子自由基的清除能力。将Tris-HCl 缓冲液放入25 ℃水浴锅中保温20 min,在样品管中分别加入0.5,1.0,1.5,2.0,2.5,3.0 mg/mL的样品液0.4 mL,加入4.5 mL Tris-HCl 缓冲液和0.1 mL 的7 mmol/L 的邻苯三酚溶液,混匀,25 ℃下反应4 min,立即加入2 滴10 mol/L 盐酸终止反应,于波长325 nm 处测OD 值Ax。相同条件下,用蒸馏水替代样品和邻苯三酚溶液作为空白管,用蒸馏水替代待测样品作为对照管测得吸光度为Ao。每个样品测定3 组平行,以抗坏血酸作阳性对照,按照下式计算清除率。
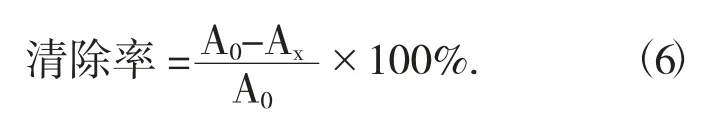
式中:A0——对照组吸光度;
Ax——样本组吸光度。
2 结果与分析
2.1 芦丁标准曲线的绘制
芦丁标准曲线见图1。
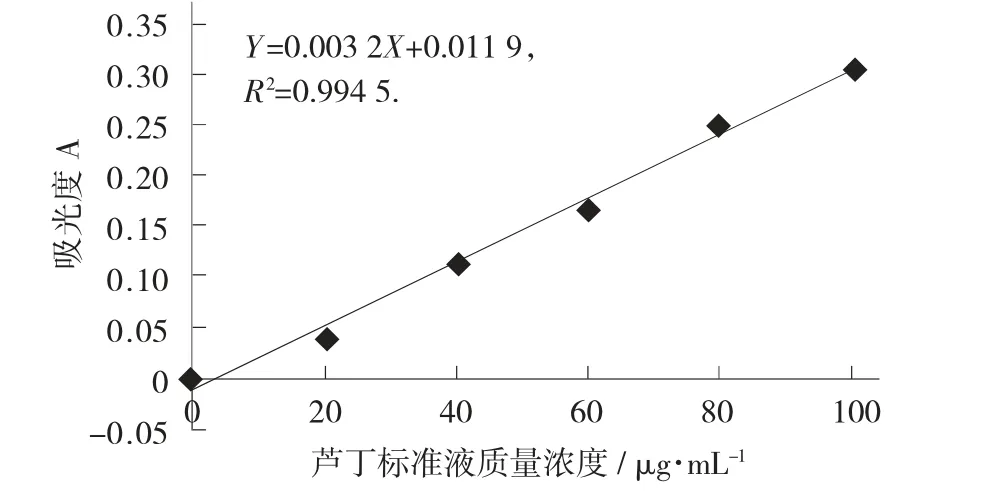
图1 芦丁标准曲线
根据试验数据得到如图2 所示的芦丁标准曲线,其回归方程为Y=0.003 2X-0.011 9,R2=0.994 5。
2.2 紫外分光光度计全波长扫描结果
紫外分光光度计全波长扫描结果见图2。
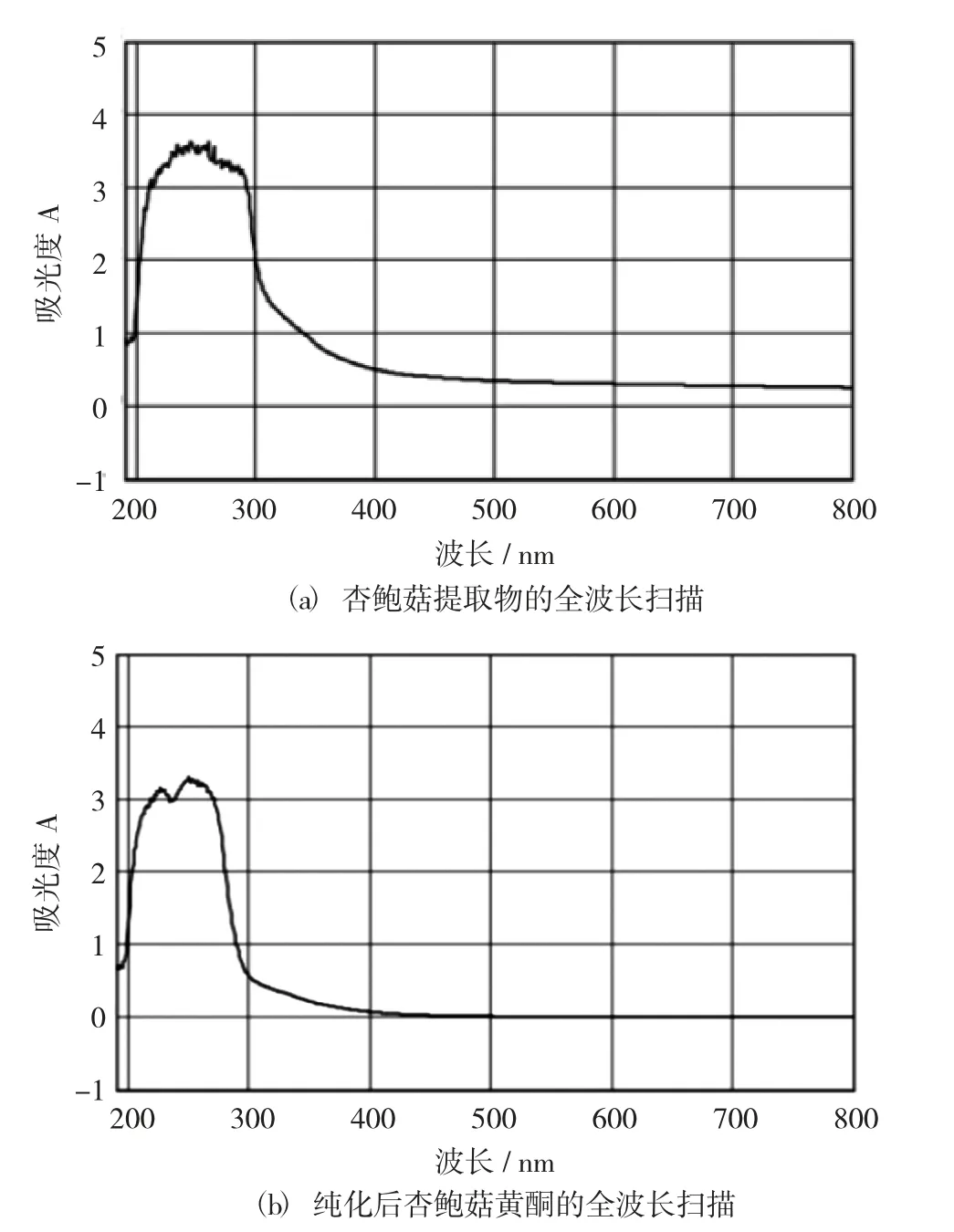
图2 紫外分光光度计全波长扫描结果
图2 (a) 为杏鲍菇提取物的全波长扫描,图2(b) 为纯化后杏鲍菇黄酮的全波长扫描。两张图都在200~300 nm 处出现吸收峰,在300~800 nm 处无明显吸收峰。大部分黄酮类化合物在200~300 nm 处有明显的吸收峰,可以初步确定杏鲍菇提取物中含有黄酮。
2.3 黄酮颜色反应结果
样品溶液与1%三氯化铝溶液反应后,溶液颜色变为黄色,并生成黄色络合物,符合黄酮类化合物呈色反应结果,表明杏鲍菇提取物中含有黄酮类化合物。
2.4 提取单因素试验分析结果
单因素试验结果见图3。
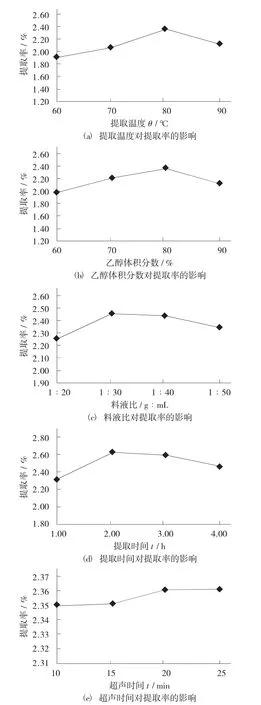
图3 单因素试验结果
由图3(a) 可知,随着提取温度的增加,杏鲍菇黄酮的提取率呈现先增大后下降的趋势,当提取温度为80 ℃时黄酮的提取率最高,为2.35%。因此,提取杏鲍菇黄酮时提取温度选用80℃为宜。由图3(b) 可知,黄酮的提取率随乙醇体积分数的增大先增大再下降,在乙醇体积分数为80%时达到最高,为2.36%。因此,提取黄酮时选用80%乙醇溶液为宜。由图3(c) 可知,黄酮的提取率随料液比的增大先上升后下降,在料液比为1∶30 时的提取率最高,为2.46%,因此提取黄酮时料液比选用1∶30为宜。由图3(d) 可知,黄酮提取率随提取时间的加长先上升再下降,在提取时间为2 h 时达到最高,为2.62%。因此,提取黄酮时提取时间选用2 h 为宜。由图3(e) 可知,超声时间对黄酮的提取率影响程度较小,故正交试验不包含此因素。
2.5 提取正交试验结果
根据单因素试验可知,乙醇体积分数、提取时间、料液比、提取温度对黄酮提取率的影响较大,因此以乙醇体积分数、提取时间、料液比、提取温度为4 个因素,进行四因素三水平的正交试验进一步优化杏鲍菇黄酮提取的工艺条件。
正交试验结果见表2。

表2 正交试验结果
由表2 可知,4 个因素对杏鲍菇黄酮提取率的影响顺序为A>C>B>D,乙醇体积分数对黄酮提取率的影响最大,提取温度次之,提取时间和料液比对黄酮提取率的影响较小且影响力相当。杏鲍菇提取的最佳条件为A2B2C3D3,对此条件进行验证试验,提取率为2.83%,高于正交试验中的组合,因此确定杏鲍菇醇提的最优工艺为乙醇体积分数80%,提取温度85 ℃,提取时间2 h,料液比1∶40。
2.6 AB-8 型大孔吸附树脂静态吸附及静态解析结果
根据试验数据及1.3.7(1) 中的公式,计算出AB-8 型对杏鲍菇黄酮的静态吸附率为70.42%。
根据试验数据及1.3.7(2) 中的公式,计算出AB-8 型对杏鲍菇黄酮的静态解析率为50.26%。
2.7 杏鲍菇黄酮精制单因素试验分析结果
杏鲍菇黄酮精制单因素试验结果见图4。
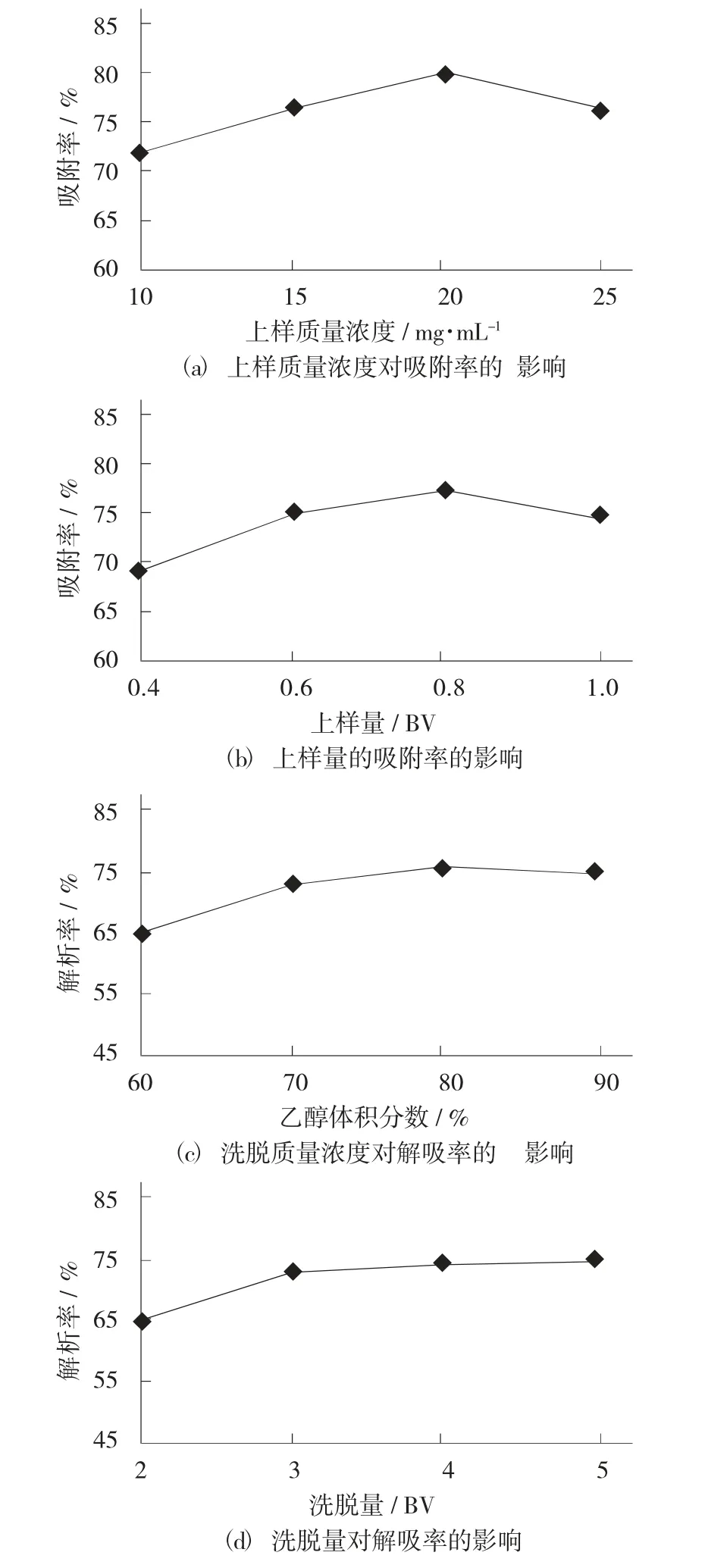
图4 杏鲍菇黄酮精制单因素试验结果
由图4(a) 可知,随着上样质量浓度的增加,AB-8 型大孔吸附树脂对杏鲍菇黄酮的吸附率先增加后减少。在上样质量浓度为20 mg/mL 时,吸附率达到最大,为79.87%。由图4(b) 可知,AB-8 型大孔吸附树脂对杏鲍菇黄酮的吸附率随上样量的加大先上升后下降,在上样量为0.8 BV 时吸附率达到最大,为77.16%。由图4(c) 可知,随着洗脱浓度的增大,解析率不断上升且在乙醇体积分数为80%时解析率达到最大,最大为75.71%,在乙醇体积分数超过80%时,解析率缓慢下降。由图4(d) 可知,随着洗脱量的加大,解析率不断增加且增加的速度逐渐减缓,洗脱量为5 BV 时解析率最大,为74.48%。故初步认定在采用AB-8 型大孔吸附树脂精制黄酮时在上样量为20 mg/mL,上样量为0.8 BV,乙醇体积分数为80%,洗脱量为5 BV 的条件下效果较好。对此条件进行验证试验,根据试验数据及1.3.2(2) 中的公式,计算出粗黄酮精制后黄酮含量为36.07%。高于单因素试验的任意一组,故在精制工艺条件采用上样质量浓度20 mg/mL,上样量0.8 BV,洗脱体积分数80%,洗脱量5 BV 为宜。
2.8 杏鲍菇黄酮精制前后体外抗氧化结果分析
ABTS 自由基清除率见表3。
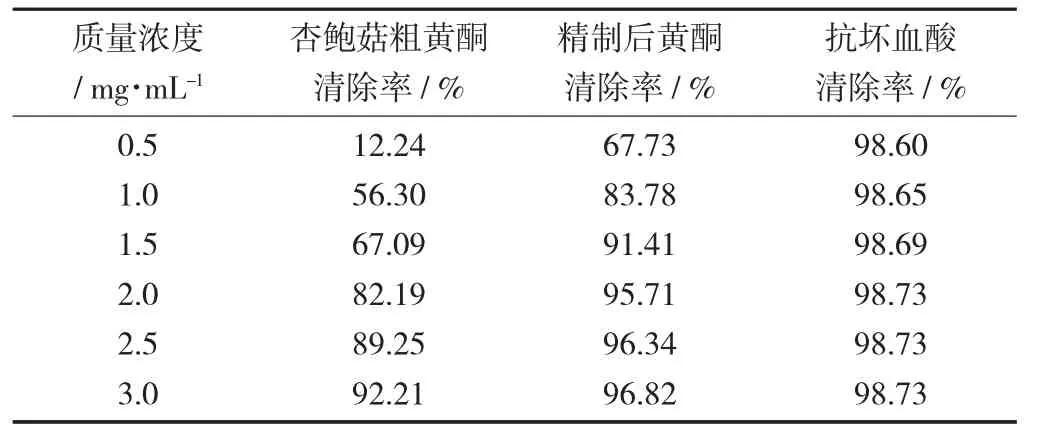
表3 ABTS 自由基清除率
由表3 可知,随着杏鲍菇黄酮质量浓度的升高,精制前后的杏鲍菇黄酮对ABTS 自由基的清除率升高。当杏鲍菇黄酮质量浓度为3 mg/mL 时,杏鲍菇粗黄酮对ABTS 自由基的清除率达到92.21%,精制后的杏鲍菇黄酮对ABTS 自由基的清除率达到96.82%。结果表明,精制前后的杏鲍菇黄酮对ABTS自由基均具有强清除能力。
DPPH 自由基清除率见表4。
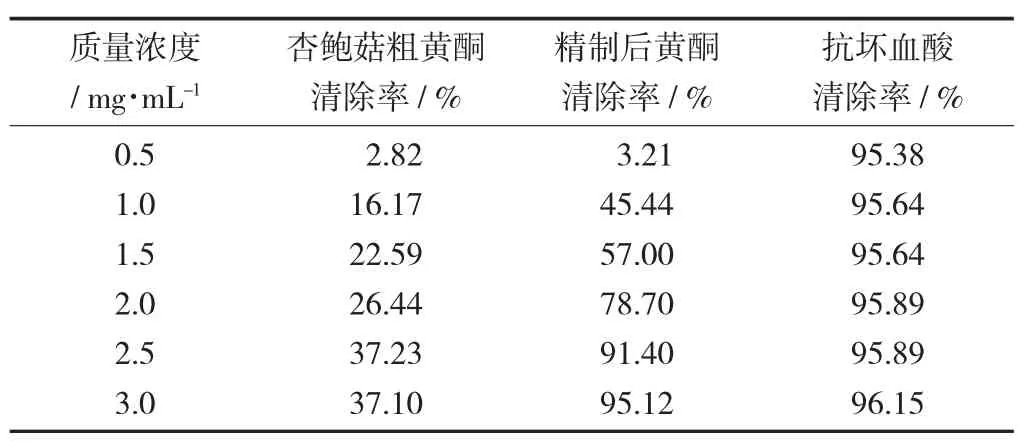
表4 DPPH 自由基清除率
由表4 可知,随着杏鲍菇黄酮质量浓度的升高,精制前后的杏鲍菇黄酮对DPPH 自由基的清除率不断提高,当杏鲍菇黄酮质量浓度为3 mg/mL 时,杏鲍菇粗黄酮对DPPH 自由基的清除率达到37.23%,精制后的杏鲍菇黄酮对DPPH 自由基的清除率达到95.12%。结果表明,精制后的杏鲍菇黄酮对DPPH自由基具有强清除能力。
超氧阴离子自由基清除率见表5。
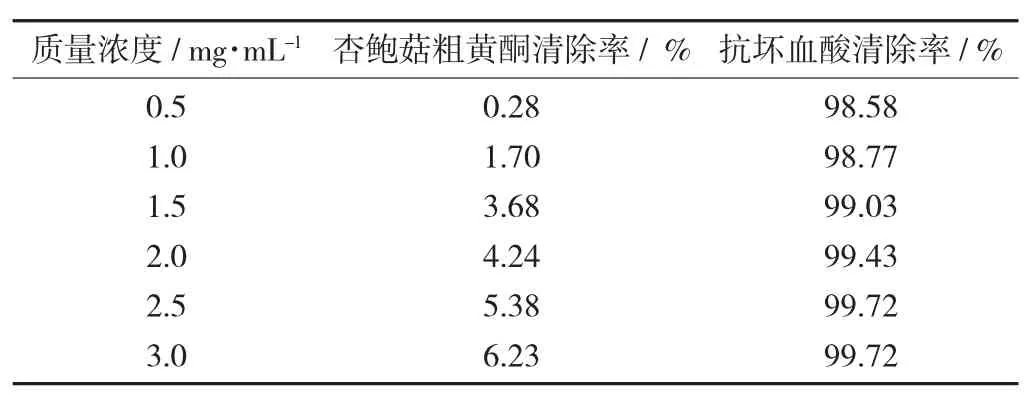
表5 超氧阴离子自由基清除率
由表5 可知,杏鲍菇粗黄酮对超氧阴离子自由基的清除率为6.23%,表明杏鲍菇粗黄酮对超氧阴离子自由基的清除能力较弱。且试验数据A0=0.353,Ax1=0.349, Ax2=0.351, Ax3=0.467, Ax4=0.399, Ax5=0.493,Ax6=0.424(X1~X6代表精制后杏鲍菇黄酮的质量浓度0.5~3.0 mg/mL)。Ax值始终比A0的值大,也就说明杏鲍菇黄酮对超氧阴离子自由基无清除作用。孟鹏举等人[27]在滑子菇黄酮醇提工艺及抗氧化活性研究的试验中发现,滑子菇黄酮对超氧阴离子自由基并无清除作用。
3 结论
对杏鲍菇黄酮的提取条件进行单因素试验和正交试验分析,得到最优的提取条件为乙醇体积分数为80%,提取温度为85 ℃,提取时间为2 h,料液比为1∶40(g∶mL),此条件下杏鲍菇黄酮的提取率最大,为2.83%。并通过紫外分光光度法对杏鲍菇提取物进行全波长扫描,初步确定杏鲍菇提取物中含有黄酮,再经颜色反应鉴定,验证了黄酮的存在。其次,试验用AB-8 型大孔吸附树脂对杏鲍菇黄酮进行精制单因素试验,当上样质量浓度20 mg/mL,上样量0.8 BV,洗脱体积分数80%,洗脱量5 BV 时,效果最好,精制后黄酮含量为36.07%。在抗氧化活性试验中,当精制后杏鲍菇黄酮的质量浓度为3 mg/mL 时,对ABTS 自由基的清除率达到96.82%,对DPPH 自由基的清除率达到95.12%,对超氧阴离子自由基无清除作用。综上所述,杏鲍菇黄酮有一定的抗氧化能力,但均弱于抗坏血酸。
