酸性蚀刻液电解回收铜工艺条件的研究
2020-11-12汪前程黄文涛李再强张伟奇
汪前程 黄文涛 李再强 张伟奇
(深圳市祺鑫天正环保科技有限公司,广东 深圳 518000)
印制电路板企业产生大量的高含铜量蚀刻废液,通过电解可以高效分离蚀刻废液中的铜离子,得到可直接回收的高纯度电解铜,同时蚀刻废液经电解后具有蚀刻能力的组分大部分未被破坏,经简单调配后可返回至蚀刻线再利用。该工艺实现了经济效益的最大化和清洁生产,已经在线路板生产企业中大规模应用。
产出单位重量电解铜的电耗,是影响生产成本的决定性因素。本文将对酸性蚀刻液回收铜的最佳电解条件进行分析确认,并对电解设备的优化做简要的说明,从而尽可能的提高电解铜的电流效率、降低电损耗。
1 实验内容
1.1 实验器材及药品
整流器:15A 5V;电解槽:长40 cm,宽12 cm,深12 cm;
循环泵:流量12 L/min;阳极板:10 cm×10 cm钛板,表面覆盖二氧化铱涂层;
阴极板:10 cm×10 cm钛板,无涂层;分析天平:佑科 精确度0.001 g;
计时器:秒表;覆铜板:生益科技板材;氯化铜;氯化铵;盐酸;蚀刻添加剂。
1.2 实验设计
1.2.1 蚀刻速率的测定
蚀刻废液对铜有较强的蚀刻能力,不能直接电解回收铜,需对蚀刻废液进行稀释以得到蚀刻能力较弱的电解液,电解液中铜离子浓度是影响蚀刻能力的主要因素,因此有必要先初步测定含不同浓度铜离子的电解液的蚀刻速率[1]。
测定方法:常温下,以低铜子液([Cu2+]=12 g/L,[Cl-]120 g/L,酸度2 mol/L)按一定比例稀释蚀刻废液([Cu2+]=143 g/L,[Cl-]=261 g/L,酸度2 mol/L)得到铜离子浓度为20 g/L、40 g/L、60 g/L、80 g/L、100 g/L的电解液。以50 mm×50 mm的双面覆铜板在烧杯中进行蚀刻速率的测试。
m1——蚀刻前覆铜板的质量(g);
m2——蚀刻后覆铜板的质量(g);
ρ——铜的密度8.92 g/cm3
S——覆铜板的单面面积(cm2)
t——蚀刻时间(min)
1.2.2 电流密度上限的确定
阴极电流密度小,铜层沉积速度慢,甚至不能沉积,但电流密度过大时,会形成粗糙、疏松、颜色发暗的不合格沉积层。
稳定电流,以固定面积S的钛板作为阴极板进行电沉积,通过不断调整电流,可以确定获得合格沉积层的最大电流Imax,则
1.2.3 电流效率的测定
铜离子在阴极放电析出的同时,已经析出的金属铜层部分会被电解液反蚀。另外,阴极极化作用强时还会发生一定的析氢副反应,所以铜实际沉积的重量小于析出的重量。正常电解时,析氢反应可忽略不计。
将阴极板背向阳极的一面粘贴胶布进行绝缘,在不同铜离子浓度的电解液中,分别以最大电流密度进行电解,测量阴极板面积以及电解前后的重量,并记录电流和时间。电解前后阴极板的重量差 △m即为铜实际沉积的重量,通过电流I和时间t可以计算出铜的析出的理论重量m,则
M——铜的相对原子量
e——电子的电荷量,常数
N——阿伏伽德罗常数
1.2.4 沉积速率的测定
利用测定电流效率的实验数据,可计算出沉积速率,即单位时间内铜层沉积的厚度。
ρ——金属铜的密度
S——阴极板的面积
1.2.5 电解液流速、温度对电沉积的影响
将蚀刻废液铜离子浓度调整为40 g/L,其它条件相同的情况下,通过改变电解液循环流动的速度或者温度,分别对比阴极电流效率。
2 结果及分析
2.1 铜离子浓度对蚀刻速率的影响
随着铜离子浓度的升高,蚀刻液蚀刻速率如图1中所示。
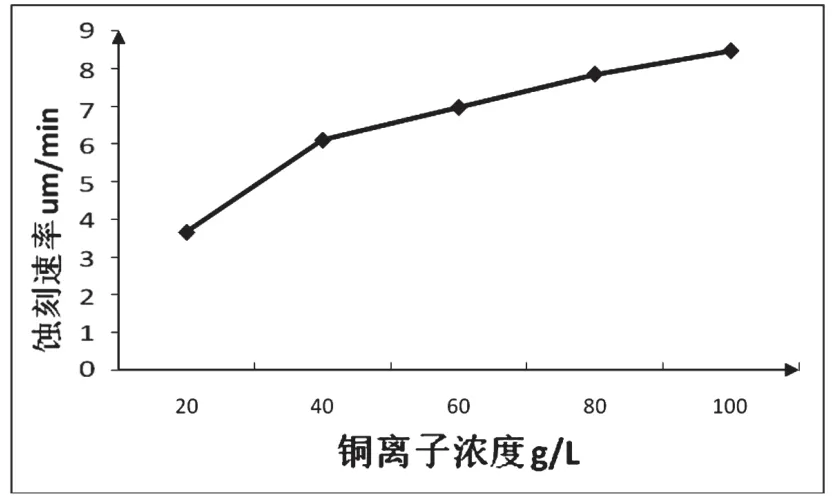
图1 铜离子浓度对蚀刻速率的影响
从图1中可以随着铜离子浓度的上升,蚀刻液的蚀刻速率呈上升趋势,而通过理论计算可知,阴极电流密度为10 A/dm2,假设电流效率100%,铜层的析出速度也仅为2.2 μm/min,远小于电解液的蚀刻速度,因此铜离子浓度越低越有利于阴极铜的析出。从实际的电解实验来看,当蚀刻液铜离子浓度为20 g/L,电流密度为3 A/dm2时,阴极可以得到合格的铜层,说明电解过程中蚀刻速率会受到抑制。如果铜离子浓度过高,电解时阴极板可能没有铜层沉积,或者沉积速率慢,严重降低电流效率,因此需要严格控制电解液中铜离子浓度。
2.2 铜离子浓度对电流密度上限的影响
从表1可以看到,其它条件不变时,电解液铜离子浓度越高,电流密度上限越高。正常电解过程中,阴极的析氢副反应可以忽略不计,当铜离子浓度一定时,电流密度越大,电流效率越高。所以后面对于不同铜离子浓度的电解液,都是在相应的最大电流密度下进行电流效率和沉积速率的测试。
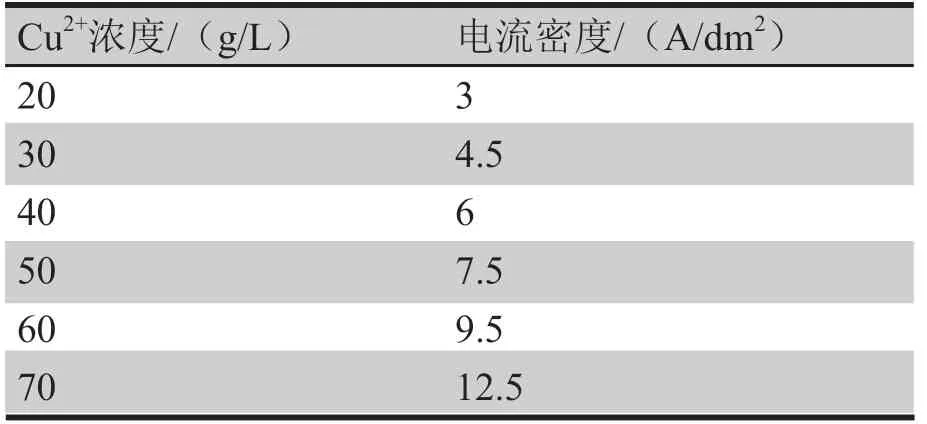
表1 不同铜离子浓度下最大电流密度
2.3 电流密度对电流效率、沉积速度的影响
从表2及图2中可以看到,以相应的最大电流密度进行电解,铜离子浓度越高,则电流效率越低,铜沉积速率越快。也就是说,对于实际生产中,其它电解条件不变,只通过调整铜离子浓度及电流密度,吨铜电耗更低和出铜速度更快,不能同时满足。
阴极铜的析出速率和电量成正比,假设比例系数为常数a,则吨铜电耗可表示如下:
U——槽电压
I——电流
η——电流效率
由于电解系统不是一个纯电阻电路,电流大小和槽电压大小并不是成线性关系。槽电压可以表示为:
U=E理+E液+E接+△E超;
阳极析氯阴极析铜,理论电压E理=φ阳-φ阴,为定值;
E液表示槽液的电压降,与电流密度成正比;
E接表示导线接触电位、极板电阻等,与电流密度成正比;

表2 电流密度对电流效率、沉积速度的影响
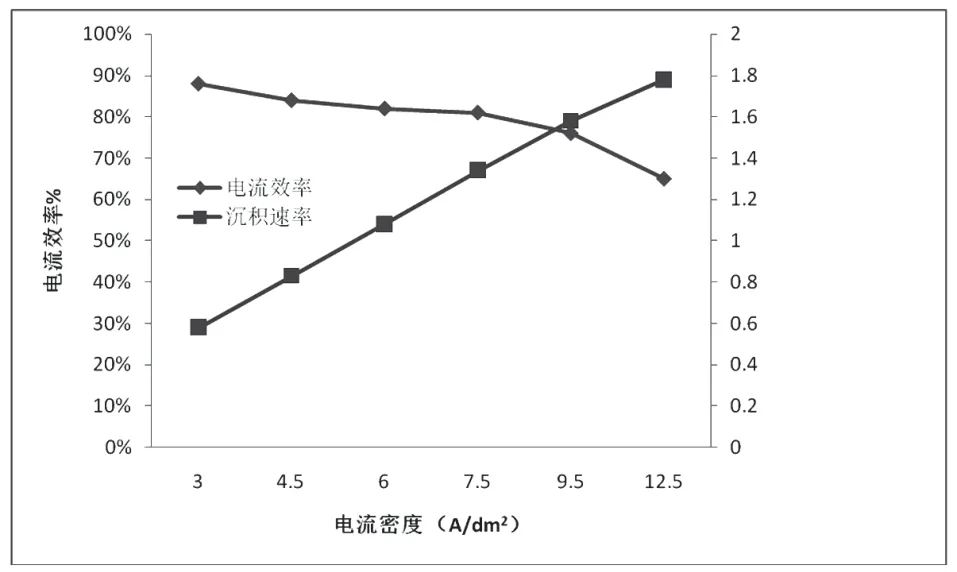
图2 电流密度上限对电流效率和沉积速率的影响
△E超表示极化超电压。
根据Tafel公式表示如式(1)。

可知,超电压与电流密度的对数呈线性关系,也就是说,当电流密度变化时,超电压的变化幅度很小。
酸性蚀刻电解液含有高浓度的Cl-、H+、NH4+、Cu2+等,导电性很好,保证导线、极板导电良好的情况下,提高电流密度,会明显提高阴极铜沉积电流效率η,但槽电压U只会小幅度上升。所以,以电流密度上限进行电解,会使吨铜的电耗降到最低。
另一方面,铜离子浓度决定电流密度上限和电流效率。铜离子浓度低,电流效率高但沉积速度慢;铜离子浓度高,电流效率低但沉积速度快,所以需要把铜离子控制在一个合理范围,实现电流效率和沉积速度的平衡。
2.4 电解液流速、温度对电沉积影响
阴极铜的析出速率仅取决于电流密度,不受电解液流速和温度的影响。
反蚀过程可简单描述为两个步骤:①Cu→Cu+;②Cu+→Cu2+,温度升高,两个步骤的反应都会加快。
步骤①Cu→Cu+在溶液和阴极界面进行,当流速加快时,减弱了Cu+在界面的富集,减弱了浓差极化作用,促进反应右移,从而使反蚀速率加快。所以,当温度升高或者电解液流速加快,都会加速已析出的铜层反蚀,最终降低了电解铜的沉积速度(见表3所示)。
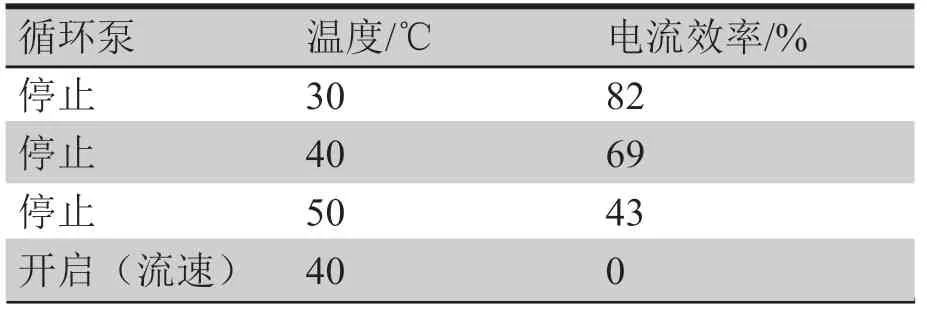
表3 电解液流速、温度对电流效率影响
3 结论
(1)当铜离子浓度一定时,用最大电流密度进行电解,电流效率最高,吨铜电耗最低;
(2)实际生产中,铜离子浓度过高,会使电流效率降低导致吨铜电耗偏高;铜离子浓度过低,则电流密度上限低,出铜速率慢。铜离子浓度控制在40~50 g/L,并用6~7.5 A/dm2的电流密度电解,出铜速度快且吨铜电耗较低;
(3)在控制好铜离子浓度和电流密度的同时,尽量降低电解液温度、减缓电解液循环流速,可以抑制电解液对金属铜的反蚀,从而提高阴极电流效率和的铜的沉积速率。
