PD-1在Graves病CD4+、CD8+T细胞中表达水平及作用机制
2020-11-12傅晓丹俞健益张险峰
韩 辉 傅晓丹 俞健益 黄 佼 张险峰
Graves病(Graves′ disease,GD)是一种发病机制尚不完全清楚的自身免疫性疾病,主要发生在甲状腺,但其临床表现不局限于甲状腺一个器官,还伴有多系统综合征,包括高代谢综合征、弥漫性甲状腺肿、眼部症状和皮肤病变等[1]。目前对GD病因的认识主要分为3个方面。遗传影响已被认为与GD的发病密切相关,多有家族史,且多发生于女性,约15%的患者发病与遗传因素有关[2]。精神创伤也被认为是GD的发病因素,由于各种原因引起的过度兴奋或过度抑郁可导致甲状腺激素的过度分泌,这可能是由于在高应激状态下肾上腺皮质激素的分泌急剧增加,从而改变了抑制性T淋巴细胞(Ts)或辅助性T细胞(Th)的活性有关[3]。免疫系统的异常也被认为是其中一个因素[4],由于缺乏特异性的自身抗原耐受,甲状腺刺激素受体(TSHR)在GD的发生、发展过程中起着重要的中介作用。
作为最常用的肿瘤免疫治疗方法,程序化死亡受体1(PD-1)抑制剂的应用能够激活T淋巴细胞,从而进一步促进人体免疫系统对恶性肿瘤细胞的杀伤作用[5,6]。PD-1是重要的免疫抑制分子,属于CD28超家族成员,最初来源于凋亡的小鼠T细胞杂交瘤[7]。以PD-1为靶点的免疫调节在抗肿瘤、抗感染、抗炎、抗自身免疫性疾病、提高器官移植成活率等方面具有重要意义[8~10]。
本研究通过检测GD患者外周血中PD-1的表达水平,探讨其对淋巴细胞共培养体系中甲状腺滤泡上皮细胞增殖及炎性因子的影响。
对象与方法
1.实验对象:取2017年5月~2018年6月在杭州市第一人民医院就诊的12例Graves病患者外周血,12例健康体检者采集等量外周血。样本采集前,患者和健康体检者彻夜禁食。将标本分成3部分,一部分保存在含有乙二胺四乙酸抗凝剂的试管中,用于采集外周血单个核细胞,另一部分用2500×g离心15min获得血清,最后一部分直接作为外周血保存,全部保存在4℃冰箱中。所有受试者均签署了知情同意书。该临床试验计划已通过杭州市第一人民医院医学伦理学委员会的审查和批准。正常人甲状腺细胞系Nthy-Ori3-1(BNCC340487)购自北京北纳生物有限公司,在37℃含10%胎牛血清(10099141,美国Gibco公司)的90%RPMI1640(670089,美国Gibco公司)培养基中培养。Graves病诊断标准:①临床甲亢症状和体征;②甲状腺弥漫性肿大(触诊和B超证实),少数病例可以无甲状腺肿大;③血清TSH浓度降低,甲状腺激素浓度升高;④眼球突出和其他浸润性眼征;⑤胫前黏液性水肿;⑥甲状腺TSH受体抗体(TRAb或TSAb)阳性;以上标准中①~③项为诊断必备条件,④~⑥项为诊断辅助条件。
2.ELISA法:ELISA法检测血清和细胞培养液中细胞因子水平。干扰素-γ(PI511)、IL-4(PI618)、IL-17(PI550)和转化生长因子-β(PT880)ELISA试剂盒均购自中国碧蓝天生物公司。所有操作均按照制造商的说明书进行。
3.PBMC的分离:外周血用0.9%钙(Ca+)和镁(Mg+)离子PBS缓冲液(德国BioChrome AG公司)均匀稀释,然后覆盖在3ml Gradisol L制剂(波兰Aqua Medica公司)上,然后在700×g下用密度梯度离心20min。用无菌移液管采集PBMCs,用无钙、无镁的PBS缓冲液冲洗。然后将细胞悬浮在1ml如上所述的相同的PBS缓冲液中,4℃保存。
4.流式细胞仪检测:将获得的外周血单个核细胞悬液以1×106的体积分布于试管中,在单克隆抗体(20μl)和荧光素的共同作用下室温培养20min。检测T淋巴细胞CD4+、CD8+细胞PD-1状态的抗体清单及其同型对照购自美国BD Biosciences公司,如表1所示。然后,细胞在700×g下冲洗离心5min,用美国Becton Dickinson公司的FACS Calibur流式细胞仪(每次30000个细胞)分析,FACS Diva软件6.13(BD)进行数据采集,CellQuest Pro软件(美国Becton Dickinson公司)进行数据分析。流式细胞仪分析的最终数据为一系列单克隆抗体染色的细胞,结合荧光染色,以平均荧光强度(MFI)表示细胞膜上抗原表达的增强。

表1 检测CD4+、CD8+T淋巴细胞PD-1的抗体
5.CCK-8法:CCK-8法检测Nthy-Ori3-1细胞与淋巴细胞共培养后的存活率。将体积为5×103个细胞的Nthy-Ori3-1细胞培养在96孔培养板中。在12、24和48h后,应用细胞计数试剂盒(中国Beyotime公司)按照制造商的建议检测细胞活力,并使用El×800读取器(美国Bio-Tek Instruments Inc公司)在450nm下进行测量。

结 果
1.GD患者炎性细胞因子水平:酶联免疫吸附试验(ELISA)显示,与健康对照组比较,GD患者血清中所有炎性相关细胞因子(干扰素-γ、IL-4、IL-17和转化生长因子-β)水平均显著升高(P<0.05,图1)。

图1 GD患者血清IFN-γ(A)、IL-4(B)、IL-17(C)、TGF-β(D)水平与对照组比较,*P<0.05
2.GD患者外周血CD4+、CD8+T细胞水平及PD-1的表达水平:检测GD患者和健康人PBMC中CD4+、CD8+T细胞的百分率,与健康人比较,GD患者CD4+T细胞数量增加,CD8+T细胞数量减少,CD4+/CD8+比值升高(图2A~C)。同时,流式细胞仪还检测到GD患者CD4+和CD8+T细胞中PD-1水平,两种细胞中PD-1水平均显著升高(图2D~G)。
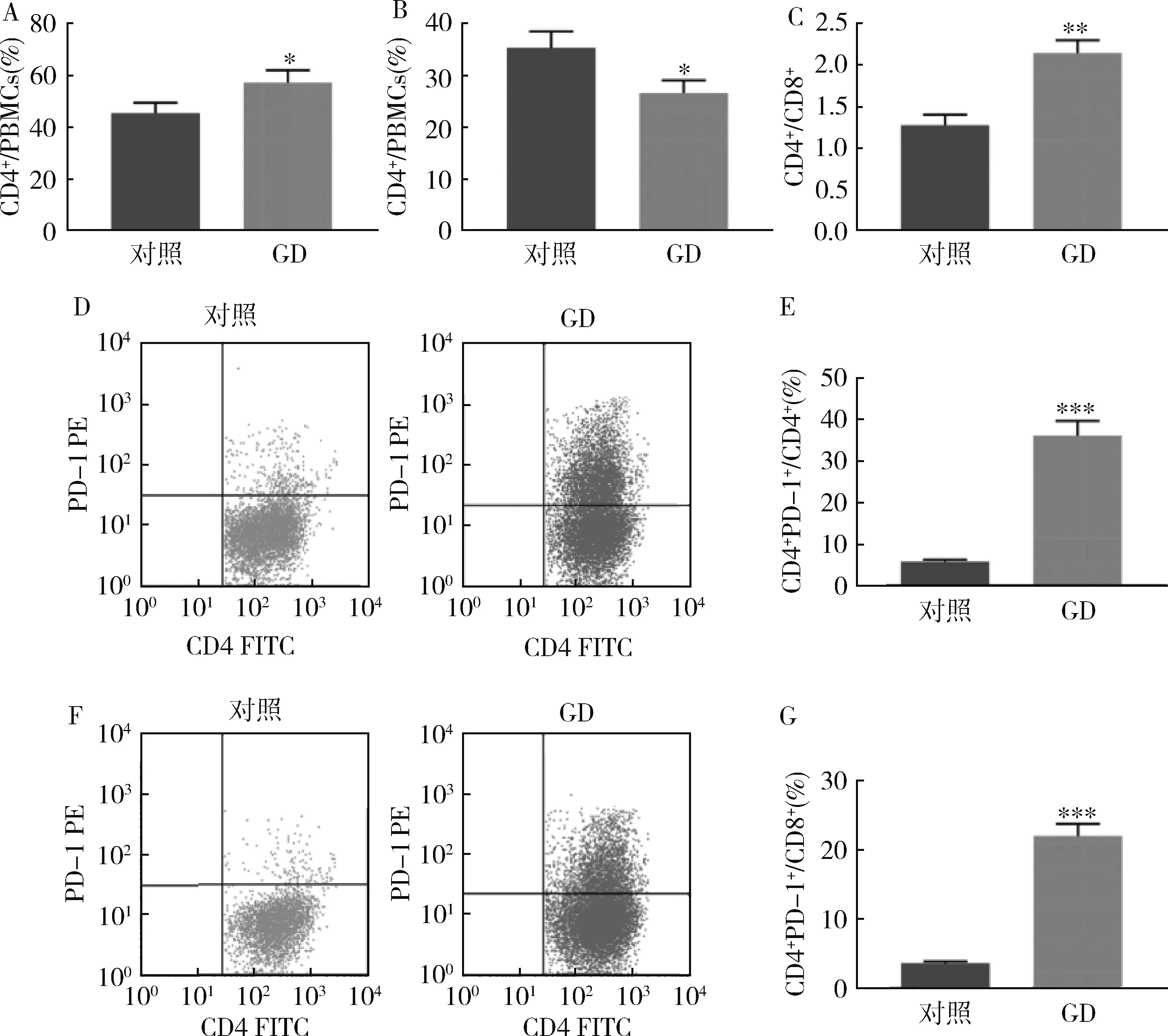
图2 GD患者外周血CD4+、CD8+T细胞水平及PD-1的表达水平A、B.PBMCs中CD4+、CD8+T细胞百分率;C.CD4+/CD8+比值;D~G.外周血CD4+PD-1+、CD8+PD-1+细胞膜上PD-1的水平;与对照组比较,*P<0.05,**P<0.01,***P=0.000
3.PD-1+T淋巴细胞促进共培养的甲状腺滤泡上皮细胞增殖:选择CD4+PD-1+/-、CD8+PD-1+T淋巴细胞与甲状腺滤泡上皮细胞共培养,检测其细胞活力及炎性相关细胞因子的表达,观察其对甲状腺滤泡上皮细胞增殖的促进作用。与CD4+PD-1+/-、CD8+PD-1+T淋巴细胞共培养的甲状腺滤泡上皮细胞具有促进增殖作用。在CD4+和CD8+淋巴细胞上均存在PD-1可显著提高细胞活性,当CD4+或CD8+细胞上存在PD-1时,甲状腺滤泡上皮细胞的活性仍显著高于不存在PD-1的情况(图3)。

图3 PD-1+T淋巴细胞促进甲状腺滤泡上皮细胞增殖A.CCK-8法检测细胞活性;B.凋亡率;与CD4+PD-1++CD8+PD-1+组比较,*P<0.05,**P<0.01,***P=0.000;与CD4+PD-1-+CD8+PD-1-组比较,#P<0.05,##P<0.01
4.PD-1+T淋巴细胞对共培养甲状腺滤泡上皮细胞炎性因子表达的影响:与CD4+PD-1+/-+CD8+PD-1+T淋巴细胞共培养,采用电化学发光免疫法检测甲状腺滤泡上皮细胞与CD4+PD-1+/-、CD8+PD-1+T淋巴细胞共培养后的IFN-γ、IL-4、IL-17和TGF-β的表达水平最高。当两者都不存在PD-1时,共培养的甲状腺滤泡上皮细胞中IFN-γ、IL-4、IL-17和TGF-β的表达水平最低(图4)。
讨 论
GD是一种自身免疫性甲状腺疾病,造成GD的因素较多,目前公认的包括遗传、饮食、精神、感染与炎症等[11]。但无论这些因素如何,其直接机制均在于体内具有不同功能的免疫细胞之间比例失衡进而导致的免疫功能异常。本研究检测到的GD患者干扰素-γ、IL-4、IL-17和转化生长因子-β水平的升高,也再次验证了GD与炎性反应之间的对应关系[12,13]。据相关报道,在非肥胖小鼠中,活化的T细胞可能会分泌更多的促炎细胞因子,从而导致糖尿病的快速进展[14]。
程序性死亡分子1(programmed death-1,PD-1)是一种负性共刺激分子,在很多疾病的发展过程中都发挥着重大作用。PD-1可以在人类的T细胞、B细胞、树突状细胞、活化的单核细胞和自然杀伤T细胞上表达。在胸腺、骨髓、脾等淋巴组织可低水平表达,通常PD-1只在活化的T细胞中表达。PD-1抑制剂是近年来在抗肿瘤领域最大的突破,PD-1抑制剂在具有抗肿瘤作用的同时,也介导T细胞产生了抗甲状腺作用,与免疫性不良事件存在相关性[15]。进一步表明了PD-1/PD-L1相关的免疫机制在甲状腺功能中的重要性。PD-1作为调控淋巴细胞功能以及多种淋巴细胞间稳态平衡的分子机制,本研究在细胞分选的基础上,对甲状腺滤泡上皮细胞进行共培养,对照观察不同比例的CD4+PD-1+细胞和CD8+PD-1+细胞对甲状腺细胞增殖、凋亡水平的影响,进一步挖掘PD-1对甲状腺细胞的作用与影响机制。
本研究发现,GD患者CD4+T细胞百分率升高,CD8+T细胞水平降低,两种T细胞上PD-1表达均呈上调趋势。由于PD-1属于CD28家族中起重要的抑制作用并维持淋巴细胞稳态的一类分子,因此如若PD-1表达发生变化,则可能影响各类淋巴细胞间的平衡,甚至整个免疫系统的功能。研究表明,正常情况下,当T细胞受体结合率较高时,PD-1才发挥削弱T细胞应答的作用[16]。若PD-1/PD-L1通路被过度激活,淋巴细胞正常的免疫杀伤功能受到抑制,这就是肿瘤细胞通过“免疫逃逸”进而恶性增殖的关键机制。PD-1的表达与肿瘤的发生和预后密切相关,与B细胞淋巴瘤一样,高水平的PD-1被认为通过影响肿瘤的微环境与淋巴瘤的复发有关,PD-1/PD-L1通路的阻断在某些方面加重了内源性抗肿瘤反应[17,18]。
在随后的研究中,CD4+PD-1+和CD8+PD-1+T细胞与甲状腺滤泡上皮细胞共培养,揭示了PD-1表达与甲状腺滤泡上皮细胞之间的潜在关系。与PD-1+CD4+/CD8+T细胞共培养的甲状腺滤泡上皮细胞,细胞存活率高,炎性因子表达水平高,提示淋巴细胞中PD-1的存在可能促进甲状腺滤泡上皮细胞的生长、分化和炎性细胞因子的分泌水平,可能造成GD的发生和发展。PD-1和PD-1/PD-L1通路在自身免疫性疾病中的作用已被广泛认识[7]。
目前认为GD在免疫功能失调方面的直接机制在于体内不同功能免疫细胞的失衡。在GD中,PD-1的高表达不仅在本研究中被观察到,也被其他研究所证实,研究认为PD-1/PD-L1通路在AITD腺体中被激活,但可能没有达到抑制疾病进展的程度[19]。此外,外周血中T淋巴细胞、B淋巴细胞的异常分布在GD患者自身免疫的发生、发展中起着重要作用。
综上所述,本研究证实了淋巴细胞膜上PD-1在影响甲状腺滤泡上皮细胞增殖及炎性细胞因子的变化中的作用。GD患者PD-1高表达,CD4+T细胞水平升高,CD8+T细胞水平降低。此外,淋巴细胞中PD-1的存在可能通过促进甲状腺滤泡上皮细胞活性,炎性细胞因子水平升高,可能进一步加速GD的发生和发展。
