HMGB1 对乳腺癌细胞增殖、迁移和侵袭的调控作用
2020-11-12余良飞
余良飞
高迁移率族蛋白(high-mobility group box,HMGB)属于高迁移率族蛋白超家族成员,是一种广泛存在于真核细胞中的非组蛋白的核DNA 结合蛋白,其家族成员均具有典型的HMG 核[1]。目前,在哺乳动物中已发现了HMGB1、HMGB2、HMGB3 等成员,它们多分布于细胞核中[2]。HMGB1 作为一种高度保守的核结合蛋白,其参与了基因的重组、调节基因的转录,并在细胞增殖分化、肿瘤细胞的迁移及炎症损伤等过程中起着重要作用[3]。研究表明,HMGB1 表达受抑制后,端粒的稳态被破坏,进而抑制了DNA 损伤的修复,从而提高了乳腺癌细胞的敏感性[4]。因此,HMGB1 可能是乳腺癌化疗敏感性的关键基因之一。为了探究HMGB1 在乳腺癌细胞增殖、迁移及侵袭过程中的作用,本文采取了外源HMGB1刺激乳腺癌细胞株MDA-MB-453,现报道如下研究结果。
1 材料与方法
1.1 一般资料
细胞株和主要试剂:人乳腺癌细胞株MDA-MB-453 购自中科院上海细胞库,L15 基础培养基购自江苏凯基生物技术股份有限公司,胎牛血清(Fetal Bovine Serum,FBS)、胰蛋白酶购自美国Gibco 公司,青霉素-链霉素混合液购自美国Hyclone公司,Matrigel 和24 孔板小室购自美国康宁公司,CCK-8 试剂盒和二甲基亚砜(Dimethyl Sulfoxide,DMSO)购自美国Sigma公司,重组HMGB1 购自美国R&D 公司。细胞培养:将冻存的MDA-MB-453 细胞常规复苏重悬后,采用L15 完全培养基(含10% FBS,100 U/mL 青霉素、100 μg/mL 链霉素),置于37 ℃、含5% CO2及饱和湿度的培养箱中培养,第二日更换1 次培养基,之后每3 天更换1 次。当细胞融合度达到80%~90%时取最好状态的细胞用于后续实验。细胞传代时,加入1 mL 0.25%胰蛋白酶消化1 min,后加入2 mL 的完全培养基终止消化后,1 000 r/min离心3 min,弃上清收集沉淀细胞,用完全培养液重悬制成新细胞悬液后按所需比例传代或接种。
1.2 研究方法
细胞增殖活性检测:试验设置空白组和药物组,药物组分别用100 ng/mL、200 ng/mL、400 ng/mL、800 ng/mL 的重组HMGB1刺激MDA-MB-453 细胞株。待细胞密度达80%~90%时,将细胞消化计数,按照密度为0.8×105个/mL 的密度接于96 孔板中,放入培养箱中培养12 h,按照上述分组将药物加入96 孔板中,每组设置8 个复孔,加入药物后接着培养48 h。培养48 h 向每孔中加入10 μL CCK,37 ℃培养4 h,然后在450 nm 处测定其吸光度,每组8 个复孔,测定重复3 次。
细胞划痕试验:试验设置空白组和药物组,药物组为400 ng/mL 的重组HMGB1 刺激MDA-MB-453 细胞株。细胞消化、计数后,按5×105的密度接种到6 孔板中培养。当细胞密度达到80%~90%时,用200 μL 的枪头,在板盖进行划痕(划痕时动作要轻,既要保证划痕的质量,又不能破坏细胞);划痕后拍照,记录划痕0 h 细胞状态(每个孔都要记录);拍照后吸掉原有培养基,加1 mL PBS 清洗细胞两遍;然后向板中加入配好的含有药物的培养基(注意要标记好每孔的药物浓度);最后放入37 ℃,含5%CO2的培养箱中培养,在12 h、24 h 和48 h 采用倒置显微镜观察、拍照。采用Image-Pro plus 6.0 软件对迁移距离进行分析。
细胞迁移率=(0 h 划痕宽度-培养后划痕宽度)/0 h 划痕宽度×100%
Transwell 检测细胞侵袭水平:试验设置空白组和药物组,药物组为400 ng/mL 的重组HMGB1 刺激MDA-MB-453 细胞株。在小室中提前铺设Matrigel 胶,将1×104个细胞加入血清培养基的上室,下室为含10%胎牛血清的培养基。24 h 后取出小室,依次经甲醛固定和结晶紫染色,采用倒置显微镜计算侵袭细胞数。
1.3 观察指标
100 ng/mL、200 ng/mL、400 ng/mL 和800 ng/mL 的外源HMGB1对MDA-MB-453 乳腺癌细胞增殖影响;400 ng/mL 的外源HMGB1对MDA-MB-453 乳腺癌细胞迁移和侵袭的影响。
1.4 统计学方法
采用SPSS 22.0 进行数据分析,数据以(±s)表示,不同剂量的HMGB1 处理组采用单因素方差分析,均数两两比较采用配对t检验。以P<0.05 为差异有统计学意义。
2 结果
2.1 外源HMGB1 刺激对乳腺癌细胞增殖的影响
与空白组相比,不同剂量组的外源HMGB1 刺激MDAMB-453 乳腺癌细胞48 h 后,MDA-MB-453 细胞增殖均明显升高(P<0.05);100 ng/mL 和200 ng/mL 外源HMGB1 刺激的细胞增殖存在差异(P<0.05),但200 ng/mL、400 ng/mL 与800 ng/mL 组间细胞增殖则无明显差异(P>0.05)(图1)。
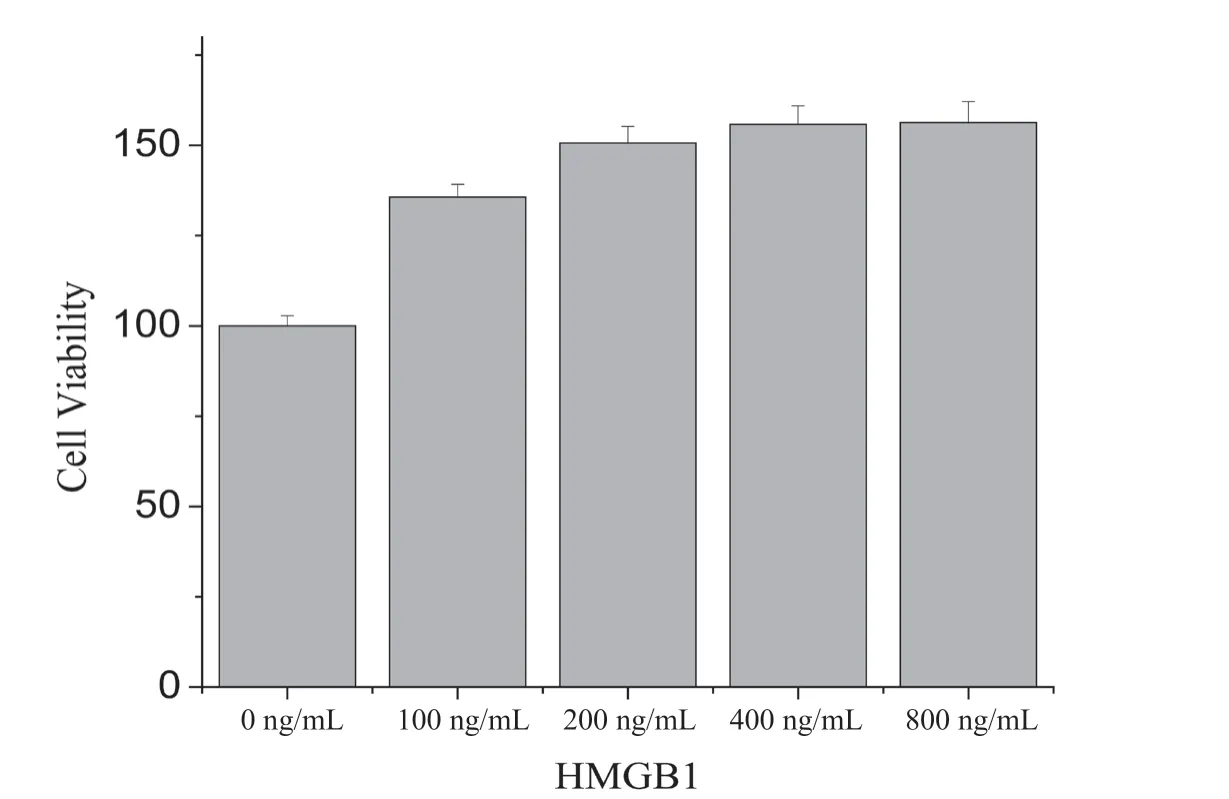
图1 不同剂量HMGB1 对乳腺癌MDA-MB-453 细胞增殖的影响
2.2 外源HMGB1 刺激对各组乳腺癌细胞迁移的影响
采用细胞划痕试验检测外源HMGB1 刺激后乳腺癌细胞的迁移,结果显示,经400 ng/mL 的HMGB1 处理48 h 后,细胞的迁移明显增强(P<0.01),且呈时间依赖性(图2)。
2.3 外源HMGB1 刺激对各组乳腺癌细胞侵袭的影响
采用Transwell 法检测400 ng/mL 外源HMGB1 处理24 h 后MDA-MB-453 细胞的穿膜数量,发现HMGB1 处理的加药组细胞穿膜数量高于空白组,差异有统计学意义(P<0.01)(图3)。
3 讨论
HMGB1 作为比较保守的高迁移率族蛋白家族成员,其含有2个与DNA 结合的结构域和1 个可以调控基因转录的C 端,参与多种炎症因子的释放[5]。研究表明HMGB1 在细胞的分化增殖和迁移侵袭中也发挥着重要作用[6],此外HMGB1 作为一种凋亡和自噬调节因子,其在肿瘤的发生发展中也发挥重要功能[7]。已有研究表明HMGB1 参与了结直肠癌[8]、肝癌[9]、胃癌[10]、肺癌[11]等肿瘤细胞的凋亡、迁移和侵袭过程,影响肿瘤细胞释放免疫因子。Huang BF 等[12]研究发现HMGB1 在乳腺癌组织表达明显升高,这表明HMGB1 在乳腺癌的发生、发展中可能起重要作用。
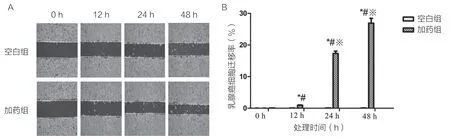
图2 外源HMGB1 刺激对各组乳腺癌细胞迁移的影响

图3 外源HMGB1 刺激对各组乳腺癌细胞侵袭的影响
本研究中,不同剂量的外源HMGB 刺激乳腺癌MDA-MB-453细胞后,采用CCK-8 检测细胞增殖情况,与空白组相比,不同剂量组的外源HMGB1 刺激MDA-MB-453 乳腺癌细胞48 h 后,MDA-MB-453 细胞增殖均明显升高(P<0.05);100 ng/mL 和200 ng/mL 外源HMGB1 刺激的细胞增殖存在差异(P<0.05),但200 ng/mL、400 ng/mL 与800 ng/mL 组间细胞增殖则无明显差异(P>0.05);由此可见在较低剂量(<200 ng/mL)情况下,细胞增殖随HMGB1 剂量的增加而增强,当剂量>400 ng/mL 时,细胞增殖增加不明显,说明HMGB1 对乳腺癌细胞增殖的促进作用不具有剂量依赖性。采用细胞划痕试验检测外源HMGB1 刺激后乳腺癌细胞的迁移,结果显示,经400 ng/mL 的HMGB1 处理48 h 后,细胞的迁移明显增强(P<0.01),且呈时间依赖性。采用Transwell 法检测400 ng/mL 外源HMGB1 处理24 h 后MDAMB-453 细胞的穿膜数量,发现HMGB1 处理的加药组细胞穿膜数量高于空白组,差异有统计学意义(P<0.01)。
综上所述,研究结果表明HMGB1 在乳腺癌细胞的增殖、迁移和侵袭方面起着促进作用,这一结果对乳腺癌的治疗提供了新的思路。
