食用农产品中单核细胞增生李斯特菌的污染状况与血清组分型
2020-11-12索玉娟白亚龙沈源源周昌艳
索玉娟 林 婷 瞿 洋 白亚龙 沈源源 邵 毅 周昌艳*
(1 上海农业科学院农产品质量标准与检测技术研究所 上海201403 2 农业农村部农产品质量安全风险评估实验室(上海) 上海201403 3 上海农产品质量安全工程技术研究中心 上海201403)
单核细胞增生李斯特菌 (Listeria monocytogenes)是一种常见的食源性致病菌,可引起人和动物的李氏杆菌病(Listeriosis)。该病发病率虽不高,但致死率可达20%~40%,在世界范围内引起高度关注,并被世界卫生组织列为五大食源性病原菌之一[1-2]。
单核细胞增生李斯特菌是革兰氏阳性兼性厌氧菌,在自然界分布广泛,水、土壤、植物腐烂部分、动物粪便及废水中均有该菌存在[3]。自1926年首次分离到单核细胞增生李斯特菌后,由该菌引起的李氏杆菌病已引起多例食源性疫情[4]。例如,2011年,美国28 个州暴发香瓜遭该菌污染疫情,147 人患病,33 人死亡[5]。2014年9月,丹麦38 人因为食用被该菌污染的香肠、肉卷等患病,至少造成15 人死亡[6]。在我国,由于饮食习惯的差异,加之流行病学统计数据的不完善,尚未大规模李氏杆菌病爆发的报道。个别研究者统计了2002—2012年全国27 个省市李氏杆菌病数据,11年间共有84 人患病,表明该菌在我国的致病风险仍不容忽视[7]。
单核细胞增生李斯特菌的致病性与不同类型的菌株有关,不同亚型菌株的致病力存在较大差异[8]。目前普遍认为该菌的致病性与菌株的血清型关系密切,其中对人致病的血清型主要为4b,1/2a,1/2b 和1/2c(约占由该菌引起病例的95%),血清型4b 多见于李氏杆菌病的流行暴发中,1/2a 和1/2b 血清型多见于零星感染的病例中[4,8]。探讨不同来源单核细胞增生李斯特菌的污染特征并进一步对其流行病学加以描述,是致病菌溯源、防控中重要的监测内容。本研究采集了上海市9 大区的四大类(肉、蛋、奶和果蔬)食用农产品,对其中的单核细胞增生李斯特菌进行分离、鉴定,并对收集的分离株进行血清组分型,为识别该菌的流行菌株在农产品中的分布及风险提供依据。
1 材料与方法
1.1 样品来源
2016年4月~2017年5月共采集样品437份。除51 份生鲜牛奶由上海市农产品质量安全检测中心提供外,其余386 份样品分别采自上海市9 个区(金山区、奉贤区、闵行区、徐汇区、宝山区、嘉定区、松江区、青浦区和浦东新区)的各大超市、农贸市场及部分区域的生产基地。
1.2 培养基与试剂
李斯特氏菌增菌液(LB)、吖啶黄素(C1,C2)、萘啶酮酸(C1,C2)、科玛嘉李斯特氏菌显色培养基、单增李斯特菌生化鉴定试剂盒,北京陆桥技术有限责任公司;脑心浸出液肉汤(BHI,Oxoid),上海博蕴生物科技有限公司;2×Taq PCR Master-Mix、2K DNA Marker、细菌DNA 提取试剂盒、琼脂糖,北京全式金生物技术有限公司;PCR 引物由上海生工生物工程有限公司合成。
1.3 主要仪器和设备
PCR 仪(Mastercycler nexus GSX1)、台 式 高速冷冻离心机(Centrifuge 5424R),德国Eppendorf公司;凝胶成像分析系统(FR-980A)、核酸电泳仪(Sub-cell GT),美国Bio-rad 公司;高压灭菌锅(SX-500),日本TOMY 公司;生物安全柜(1300 series A2),美国Thermo scientific 公司;恒温培养箱(DNP-9272 型),上海精宏设备有限公司;恒温振荡培养箱(TQZ-312 型),上海精宏实验设备有限公司;Nano Drop(2000C),美国Thermo scientific 公司;电子天平(AL104),Mettler Toledo。
1.4 试验方法
1.4.1 分离鉴定方法 根据国标GB 4789.30-2010 《食品安全国家标准食品微生物学检验单核细胞增生李斯特氏菌检验》[9]规定方法进行检测;疑似菌株用菌落PCR 扩增hly 基因再验证,具体如下:
20 μL PCR 体系:2×Taq PCR Master Mix 10 μL、上下引物(hly)各0.8 μL,加ddH2O 补足,无菌操作挑入单增李斯特菌疑似菌落为模板进行菌落PCR。反应条件:95 ℃预变性10 min,接着35 个循环,每循环包括95 ℃30 s,55 ℃30 s 退火,72 ℃30 s 延伸,循环结束后,72 ℃8 min;PCR 产物用1%琼脂糖凝胶电泳检测。用于菌株鉴定的引物序列见表1。
1.4.2 DNA 提取 菌株DNA 模板的制备参照细菌DNA 提取试剂盒说明书的方法操作。
1.4.3 多重PCR 血清分型 参考Doumith 等[10]PCR 血清方法略做修改,50 μL PCR 体系含有:2×Taq PCR Master Mix 25 μL,10 μmol/L 的引物(lmo0737,lmo1118,ORF2819,ORF2110,prs 分别为3.5,3.5,3.5,5,0.7 μL),100 ng/μL 的模板2 μL,补水至50 μL;反应程序:94 ℃预变性5 min,接着35 个循环,每个循环包括94 ℃24 s,55 ℃69 s,72 ℃69 s,循环结束后,72 ℃7 min;PCR 产物经1.5%琼脂糖凝胶电泳检测。用于血清分型的引物lmo0737,lmo1118,ORF2819,ORF2110,prs序列见表1。
1.4.4 统计分析 本研究使用SPSS 统计分析软件对数据进行卡方检验分析,当P<0.05 时表示数据之间具有显著性差异。
2 结果与分析
2.1 单核细胞增生李斯特菌在农产品的污染状况
对采集的4 大类9 种食用农产品样品进行单核细胞增生李斯特菌的分离鉴定,结果见表2。437 份样品中共有59 份样品检出单核细胞增生李斯特菌,筛选得到79 株分离株。4 大类样品中均有目的菌检出,其中生鲜肉的检出率最高,平均为26.8%(56/209);生牛奶与生鸡蛋较低分别为2.0%(1/50)和1.9%(1/54);鲜食果蔬最低为1.0%(1/104)。
生鲜肉中,生鸡肉的污染最为严重(45.6%),其次为生牛肉、生猪肉和生羊肉,这3 类样品污染状况比较接近,均在20%~23%之间;生鸡蛋中2份样品阳性;生菜和生牛奶中各有一份样品为阳性。
2.2 不同来源样品中单核细胞增生李斯特菌的分布
将样品按照不同来源进行分类,单核细胞增生李斯特菌在不同来源、不同类别中的检出率如表3所示,流通环节的超市和农贸市场检出率明显偏高;除基地来源的生牛奶有少量检出外,其它基地来源的生猪肉和果蔬均无该菌检出。

表2 不同农产品样品中单核细胞增生李斯特菌的污染情况Table 2 Distribution of L.monocytogenes in different agri-food samples

表3 单核细胞增生李斯特菌在不同来源样品中的污染状况Table 3 Prevalence of L.monocytogenes in samples from different sampling site
2.3 不同季节单核细胞增生李斯特菌的分布
本研究中单核细胞增生李斯特菌的检出率随着季节的变化也有不同(表4)。其中4 个季节的检出率分别是:春季16.0%、夏季29.6%、秋季8.5%、冬季13.3%,夏季单核细胞增生李斯特菌检出率要显著高于春秋冬3 季(春夏、夏秋、夏冬的P 值分别为0.018,0.001 和0.014),春、秋、冬3 季之间的检出率无显著性差异(P>0.05)。
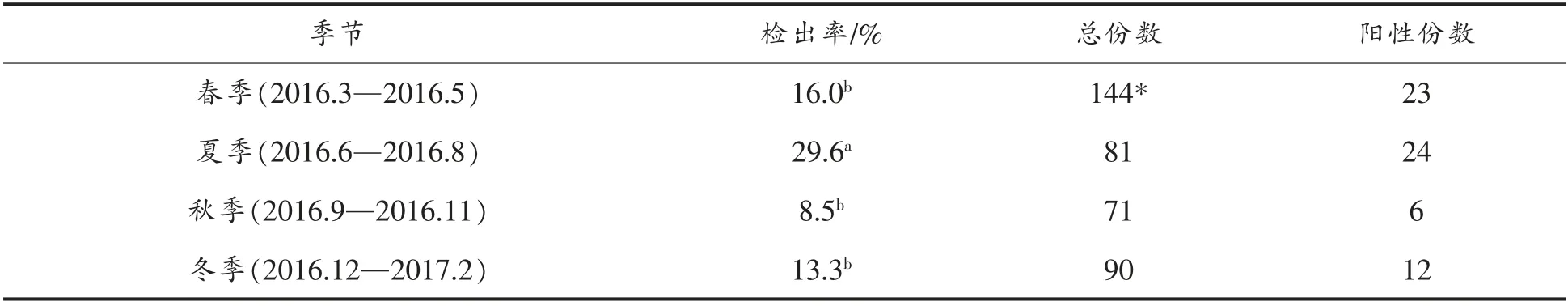
表4 不同季节中单核细胞增生李斯特菌的分布情况Table 4 The prevalence of L.monocytogenes in different seasons
2.4 单核细胞增生李斯特菌血清分型
多重PCR 血清分型的部分结果见图1,共有5 种带型:泳道1 扩增出370 bp 和691 bp 片段,对应血清组(1/2a,3a);泳道2 扩增出370 bp 和470 bp 片段,对应血清组(1/2b,3b,7);泳道3 扩增出370,691 bp 和906 bp 片段,对应血清组(1/2c,3c);泳道4 扩增出370,471 bp 和597 bp 片段,对应血清组(4b,4d,4c);泳道12 只扩增出370 bp 片段,对应血清组(4a,4c)。
79 株单核细胞增生李斯特菌被分为5 个血清组:44 株(53.0%)属于血清组1/2a 或3a;17 株(20.5%)属于血清组1/2c 或3c;14 株(16.9%)属于血清组1/2b 或3b 或7,3 株(7.2%)属于血清组4a 或4c;1 株(2.4%)属于血清组4b 或4d 或4e。不同农产品来源的单核细胞增生李斯特菌血清组分布详见表4。7 种农产品的分离株血清组都以1/2a 或3a 为主,该血清组菌株在7 种农产品中的占比为45.5%~100%,1/2c 或3c 占比为16.7%~31.8%,1/2b 或3b 或7 占比为6.7%~27.3%,4a 或4c 占比为3.3%~7.7%,4b 或4d 或4c 来源于超市生牛肉样品。
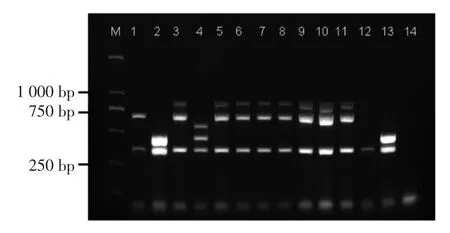
图1 部分单核细胞增生李斯特菌多重PCR 血清分型结果Fig.1 Multiplex-PCR amplification patterns of selected L.monocytogenes isolates

表5 79 株单核细胞增生李斯特菌农产品分离株的血清组分布Table 5 Distribution of serogroups among 79 L.monocytogenes isolates obtained from different types of produce
3 讨论
农产品是食源性致病菌传播的主要载体,加强农产品中单核细胞增生李斯特菌的风险监测,对保障整个饮食框架的安全将起到积极作用。本研究调查了上海市9 大区437 份农产品中单核细胞增生李斯特菌的污染状况,并对这些样品来源的分离株进行了血清组分型,为上海地区单核细胞增生李斯特菌流行病学的风险监测提供了数据支持。
4 大类农产品(肉、蛋、奶和果蔬)中生鲜肉的污染最为严重,这与已有报道一致[11-13],而生肉的总体污染率为27.2%(61/224) 较高于已有的部分研究结果。王文凯[14]在2013—2014年间对上海市场的94 份生肉样品进行检测,单核细胞增生李斯特菌的检出率为16.0%;Wu 等[15]在2012—2014年间对全国24 个省市的196 份生肉样品进行检测,单核细胞增生李斯特菌的检出率为20.9%。这些差异除与微生物分布的不确定性有关外,也与样品采集的地点存在很大关系[16]。本研究涵盖了上海市9 大区域的超市、农贸市场和部分区域基地的农产品样品,每区域至少进行2 次重复样品采集,较全面地反应了上海市农产品中单核细胞增生李斯特菌的污染状况。
3 类采样地点——超市、农贸市场和基地的样品中,超市样品的总体污染率(21.4%)稍高于农贸市场(15.4%)。此外,本研究中除牛肉外,超市中采集的农产品类别其阳性率也高于农贸市场样品类别。有学者认为单核细胞增生李斯特菌能在4℃下生长,大多数细菌在此低温环境中生长受到抑制,使前者形成竞争优势而易于污染样品[17-18]。超市的畜禽肉常置于冷柜,农贸市场通常为常温放置,环境温度的差异可能导致污染率不同。同时,农产品从生产、贮运到销售任何一个环节都存在被致病菌污染的风险,各环节的卫生规范也是影响该菌分布的重要影响因素[19]。此外,本研究对上海部分基地生产的生猪肉、果蔬和生牛乳进行污染排查,除1 份生牛乳中检出目的菌外,均未在生产(种植)环节的农产品中发现该菌。流通环节中畜禽肉的高污染状况需进一步溯源分析,以确定重点防控环节。
单核细胞增生李斯特菌的污染率还受到季节的影响。本研究持续监测的1年期间,该菌在夏季污染率显著高于春秋两季,一般认为夏季高温适于细菌的生长繁殖,许多研究也呈现出致病菌夏季高污染率的趋势[20-22]。而本研究中秋季的低污染率可能与样品采集数量与种类的不均一性有关。虽然本研究对每个季节、每种样品都有涉及,但并没有对某一地点、某种样品进行针对性的季节影响调查,故本研究结果只能反应季节影响的大致趋势。
多重PCR 血清组分型克服了传统血清凝集试验对试剂、操作等要求高的缺点,避免了交叉反应出现的误判,是单核细胞增生李斯特菌血清分型中广泛采用的快速分析方法[23]。本研究得到的79 株分离株包含了目前该方法所含有的全部5个血清组:(1/2a 或3a),(1/2c 或3c),(1/2b 或3b或7),(4a 或4c),(4b 或4d 或4e)。由于3a,3c,3b,7,4d,4e 在食品和临床上极为罕见,故属于血清组(1/2a 或3a)、(1/2c 或3c)、(1/2b 或3b 或7)、(4b 或4d 或4e) 的菌株一般可认为是1/2a,1/2c,1/2b 和4b 血清型[24-25]。按照上述理论及临床统计信息,本研究从农产品中分离得到的单核细胞增生李斯特菌多为容易引起零星感染的疑似1/2a和1/2b 血清型,从生牛肉中分离得到的疑似4b血清型为流行病学暴发常见血清型,其余血清型在临床上引起的病例较不常见。
综上所述,上海9 个地区437 份农产品(肉、蛋、奶和果蔬)中,畜禽肉是单核细胞增生李斯特菌的主要载体,从这些载体中分离得到的79 株单核细胞增生李斯特菌可分为多种血清型,并存在较高致病风险,这些结果为单核细胞增生李斯特菌的风险监测提供了数据支撑。
