传统清香型白酒发酵过程中真菌群落结构及其动态演替
2020-11-12贾丽艳田宇敏王晓勇耿添霈
贾丽艳 田宇敏 王晓勇 耿添霈 韩 英
(1 山西农业大学食品科学与工程学院 山西太谷030801 2 山西省白酒生物工程研究生教育创新中心 山西太谷030801 3 山西杏花村汾酒厂股份有限公司 山西汾阳032209)
传统清香型白酒独特的酿造技艺及微生物菌群结构,协同优质的高粱、大麦和豌豆,共同造就了其独特的风格。传统清香型白酒生产包括大楂发酵和二楂发酵2 个阶段[1]。大楂和二楂酒醅的理化指标不同[2],必将影响酒醅中微生物的菌群结构;而酒醅中理化指标、微生物菌群结构不同,又会影响白酒的风味。研究酒醅发酵过程中微生物菌群结构及变化规律,对于白酒发酵过程中功能性菌株挖掘及白酒品质的提升具有重要意义。
目前,科研工作者采用微生物纯培养或非培养技术对清香型白酒发酵过程中的微生物菌群进行研究[3-11]。王薇等[9]采用传统微生物分离方法,分析了清香型白酒固态酿造过程中酵母种群结构和多样性;韩莎等[10]研究了汾酒可培养微生物的群落结构与代谢规律。然而,采用非培养技术对传统清香型白酒发酵过程中真菌菌群结构及动态变化规律的研究鲜有报道。本研究利用高通量测序技术系统研究传统清香型白酒大楂和二楂发酵过程中真菌的动态演替规律,以确定清香型白酒发酵过程中真菌优势群体,为白酒生产的可调控化及生产技术升级奠定理论基础。
1 材料与方法
1.1 样品的采集
2015年5月至6月,于某清香型白酒厂采集样品。样品包括大楂发酵0,3,7,10,15,17,21,23,28 d 和二楂发酵0,3,7,10,15,21,23,28 d 的酒醅,样品编号分别以发酵时间标记,共17 个样本。样品采集使用多点取样法[3]。
1.2 主要试剂与仪器
dNTPs、DNA Marker,大连宝生物;Taq DNA polymerase、溶菌酶,美国Sigma 公司;N,N′-亚甲基双丙烯酰胺、去离子甲酰胺,北京Solarbio 公司;蛋白酶K,德国Merck 公司。
5430 高速冷冻离心机、5427 R 台式冷冻离心机,德国Eppendorf 公司;MX-S 型可调式混匀仪,北京大龙公司;Bio-Best 200E 型凝胶成像分析系统,美国Siemon 公司;My Cycler 型PCR 仪,美国Bio-Rad 公司;SpectraMax Drop 核酸蛋白微量检测仪,美国Molecular Devices 公司;Miseq 测序仪,美国Illumina 公司。
1.3 样品总DNA 提取及高通量测序
采用倪峥飞[12]描述的方法提取酒醅中的总DNA。Illumina MiSeq 测序由上海生工公司完成。采用关统伟等[13]描述的方法对所测样品进行α,β多样性分析。
2 结果与分析
2.1 样品测序结果
从大楂和二楂样品中分别获得18S rRNA 基因序列503 566 条和655 392 条,过滤掉低质量的序列,获得有效序列488 956 条和642 670 条;在97%相似度下将其聚类为用于物种分类的OTU,共产生14 230,7 303 个OTU。
2.2 样品间α 多样性分析
覆盖率、香农指数、Chao1 指数、辛普森指数等指标可反应样品的α 多样性[13]。由表1可知,大楂样品序列覆盖率在0.98~1 之间变化,表明各样品文库的覆盖率较高;丰富度指数呈低-高-低-高-低的变化趋势,表明各样品真菌多样性不同,在发酵过程中呈动态变化;香农指数在1.94~3.55之间波动变化,也表明不同发酵阶段微生物的多样性在变化。大楂发酵过程中真菌多样性呈动态变化,发酵0~3 d,真菌菌群多样性降低;3~10 d,真菌多样性略有升高;10~17 d 又略有降低;17~21 d 又升高;21~28 d 先降低后略升高,表明大楂发酵过程中真菌菌群结构在不断变化。

表1 大楂各样品真菌α 多样性统计Table 1 Alpha diversity of fungi in different samples of Dacha
由表2可知,二楂样品覆盖率在0.99~1 之间变化,表明各样品文库的覆盖率高;丰富度指数呈低-高-低-高-低-高的变化趋势,表明各样品真菌多样性在发酵过程中呈动态变化。与大楂相比,菌群多样性变化规律略有不同。香农指数在1.56~2.26 之间波动变化,表明二楂发酵过程中真菌菌群结构发生动态变化,且多样性变化趋势小于大楂。

表2 二楂各样品真菌α 多样性统计Table 2 Alpha diversity of fungi in different samples of Ercha
2.3 样品间β 多样性分析
β 多样性可反映不同环境中物种组成的相异性或物种沿环境梯度的更替速率。采用主坐标分析法(PCoA)可直观显示样品间β 多样性。由图1a可知,主成分1(P1)和主成分2(P2)的样品差异性贡献率分别达到70.2%和17.5%,合计87.5%,是造成差异的主要来源。图1b是P1 和P2 主成分分析二维散点图,图中不同的点代表不同的样本,样本间相似度越高,空间距离越近;反之,空间距离越远。由图1b可知,各样品真菌菌群结构具有一定差别,表明大楂酒醅发酵过程中真菌菌群结构发生动态变化。

图1 大楂各样品真菌PCoA 分析散点图Fig.1 PCoA results of fungi communities from the samples of Dacha
由图2a可知,主成分1(P1)和主成分2(P2)的样品差异性贡献率分别达到75.8%和12.6%,合计88.4%,是造成差异的主要来源。图2b是P1 和P2 主成分分析二维散点图。由图2b可知,各样品真菌菌群结构具有一定的差别,表明二楂酒醅发酵过程中真菌菌群结构发生动态变化。

图2 二楂各样品真菌PCoA 分析散点图Fig.2 PCoA results of fungi communities from the samples of Ercha
2.4 样品间门水平的真菌群落结构分析
采用RDP classifier 对各样品中的OTU 进行分类信息分析,发现大楂、二楂在亚门或纲水平上,分别有26 个亚门或纲的真菌和未分类单元,主要为子囊菌纲、担子菌亚门、接合菌亚门。由图3可知,大楂发酵阶段,子囊菌纲是优势种群,占到各时期真菌种群的10.58%~83.56%;在发酵0 d,子囊菌纲仅占该时期真菌种群的10.58%;发酵0~15 d 子囊菌纲所占比例越来越高,最高达到83.56%;发酵15 d 以后,子囊菌纲所占比例降低。
由图4可知,二楂在发酵阶段,子囊菌纲是优势种群,占到各时期真菌种群的52.88%~74.3%;在发酵0~3 d,子囊菌纲所占比例升高;发酵3~15 d 子囊菌纲所占比例略有升高;发酵15 d 后先降低后升高。与大楂相比未分类真菌在二楂发酵过程中占比较高,且在发酵过程中呈动态变化。
2.5 样品间属水平的真菌群落分布
通过高通量测序,从大楂样品中获得185 个属水平真菌。属水平的真菌群落组成比例较高的前10 个属分别是腹膜孢酵母属、酵母属、假丝酵母属、横梗霉属、根霉属、毛霉属、球腔菌属、曲霉属、毛壳菌属和其它未分类单元。图5反映了大楂发酵过程中属水平真菌群落组成情况。腹膜孢酵母属、酵母属、假丝酵母属在酒醅发酵过程中相对含量较高,呈动态变化,推测它们是大楂发酵过程中的优势菌株,且在酒醅发酵过程中呈动态变化。
从二楂样品中获得185 个属水平真菌。测序结果中组成比例较高的前10 个属分别是腹膜孢酵母属、有孢汉逊酵母属、有孢圆酵母属、哈萨克斯坦酵母、隐囊菌属、青霉属、曲霉属、Vanderwaltozyma、Pleospora 和其它未分类单元等。图6反映了二楂发酵过程中属水平真菌群落组成情况。腹膜孢酵母属在发酵过程中相对含量呈逐渐降低的趋势。

图3 大楂样品真菌在亚门或纲分类水平上的分布Fig.3 Distribution of fungi communities on samples of Dacha in subphylum or class level

图4 二楂样品真菌在亚门或纲分类水平上的分布Fig.4 Distribution of fungi communities on samples of Ercha in subphylum or class level
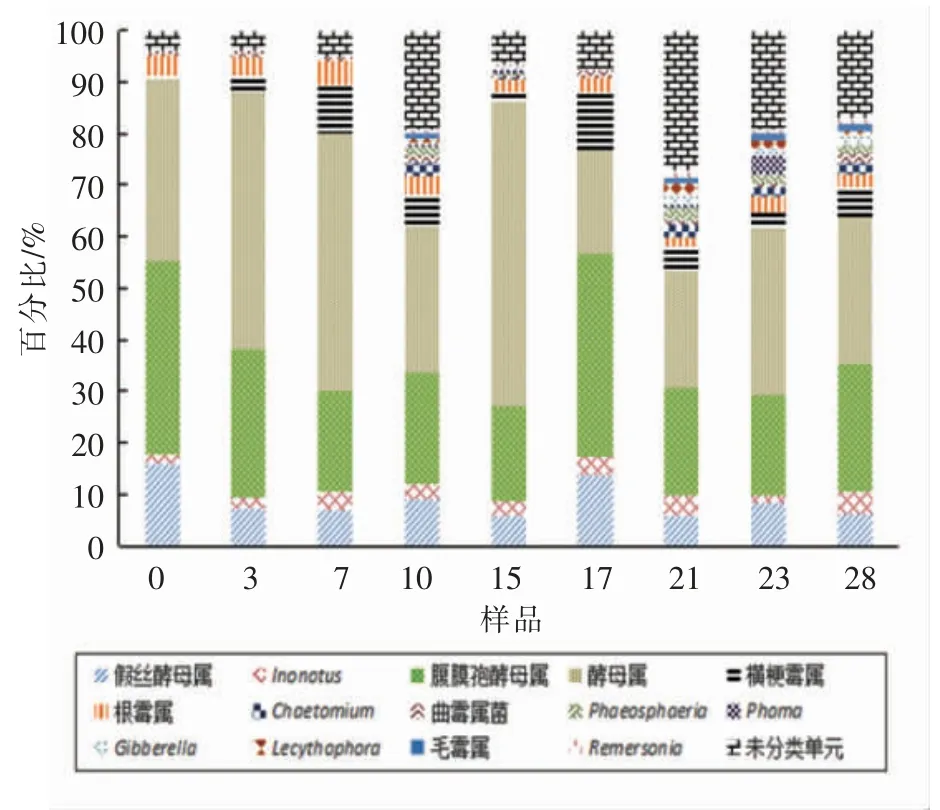
图5 大楂样品真菌在属分类水平上的分布Fig.5 Distribution of fungi communities on samples of Dacha in genus level

图6 二楂样品真菌在属分类水平上的分布Fig.6 Frequence of fungi communities on samples of Eacha in genus level
3 讨论
本研究采用高通量测序技术完成了传统清香型白酒大楂和二楂全发酵过程中真菌菌群结构的分析,结果显示传统清香型白酒大楂和二楂真菌群落组成丰富,在发酵过程中真菌的种类和数量随着发酵时间的延长和环境的改变不断变化。其中子囊菌纲的腹膜孢酵母属、酵母属、假丝酵母属、有孢汉逊酵母属和有孢圆酵母属等为大楂或二楂发酵主要优势菌。腹膜孢酵母属在酒醅发酵过程中均具有一定含量且动态变化;特别是在二楂发酵过程中,呈逐渐降低的变化趋势;酵母属在大楂和二楂酒醅发酵过程中均呈升高-降低-再升高-再降低的动态变化趋势。有孢圆酵母属主要存在于二楂的酒醅中,且相对含量在酒醅中动态变化。这些菌体在酒醅中的作用及相互关系在未来研究中需要结合代谢组学、传统微生物分离筛选及性能测定等技术手段和方法进一步阐明,以便于更好地阐释传统清香型白酒的酿造机理,为清香型白酒的技术升级提供服务。此外,在大楂和二楂酒醅的高通量测序过程中还检测到一些诸如根霉属、毛霉属的霉菌DNA。童敏江[14]研究发现,利用传统酿造技术仅可以在清香型白酒生产用大曲及大楂发酵的初期分离到根霉、毛霉等霉菌,然而在酒醅其它发酵阶段均检测不出,表明这些菌体在酒醅中不生长繁殖,之所以在发酵后期能够检测到相关DNA,可能是由于这些真菌的DNA 在酒醅发酵过程中没能及时完全分解导致。其它菌体DNA 也不排除具有以上现象。为此,在后期的研究中应将高通量测序技术和传统微生物培养方法相结合,研究清香型白酒发酵过程中的真菌群落结构及其动态演替变化规律,根据酒醅发酵基质环境和不同微生物生物学特征,建立适合于清香型白酒酒醅中不同微生物分离培养的培养基,以便充分客观地了解清香型白酒中的微生物菌群结构,挖掘出更多酒醅发酵过程中的功能性菌株。
4 结论
通过Illumina MiSeq 高通量测序技术,对传统清香型白酒大楂和二楂全发酵过程中的真菌群落结构、丰度及演替规律进行研究,结果表明大楂和二楂真菌群落组成丰富,在发酵过程中真菌的种类和数量随着发酵时间的延长以及环境的改变而不断变化,其中子囊菌纲的腹膜孢酵母属、酵母属、假丝酵母属、有孢汉逊酵母属和有孢圆酵母属等为大楂或二楂发酵的主要优势菌。
