1,2⁃二(四唑⁃5⁃基)乙烷Mg 盐和Ca 盐的合成、结构与热分析
2020-11-12李新锐杨晓明李海波李志敏张同来
李新锐,杨晓明,李海波,李志敏,王 林,张同来
(北京理工大学 爆炸科学与技术国家重点实验室,北京 100081)
1 引言
含能材料是发展先进武器装备的根基。近年来,越来越多的国内外科研人员致力于开发新型高能量密度材料(HEDMs),以满足民用、军用和航天领域等各个行业的需求[1-3]。四唑类化合物由于分子结构中含有大量的N—N 键、N=N 双键以及C—N 键,在发生分解和爆炸反应时能够释放出大量的能量。另外,由于四唑环具有类似于苯环的离域大π 键,其结构相对稳定。四唑盐具有正生成焓、高密度、良好的热稳定性和分解产物环境友好等优点,因此基于四唑环结构设计新型含能材料也成为了研究的热点之一[4-5]。1,2⁃二(四唑⁃5⁃基)乙烷(H2BTE)(也称:双四唑乙烷)的结构中具有柔性、可扭转的C—C 键,所以在作为配体形成配合物时会有更多的配位模式,从而丰富这类化 合 物 的 多 样 性。2011 年Shen 等[6]合 成 了 三 种 以1,2⁃二(四唑⁃5⁃基)乙烷为配体,以Zn2+,Mn2+为中心原子的有机框架化合物,表明反应条件和配位模式的不同会导致结构上的异构。同年Xia 等[7]合成了两种新型的化合物即[Sr(BTE)(H2O)5]n和[Ba(BTE)(H2O)5]n,两种化合物的第一放热峰峰温均高于400 ℃并通过实验证明两种化合物对高氯酸铵的分解有一定的催化作用。2016 年张悦阳等[8]采用一锅法制备了新型高氮化合物——一水合双四唑乙烷氨基胍盐,该化合物具有较低的机械感度和较高的热稳定性。国内外部分学者对1,2⁃二(四唑⁃5⁃基)乙烷为配体的化合物进行了广泛研究,表明该类配合物具有较好的热稳定性,对外界机械刺激钝感,分解产物对环境友好等特点[9-12]。
基于此,本研究以Mg2+和Ca2+作为中心离子,1,2⁃二(四唑⁃5⁃基)乙烷为配体合成了两种未见报道的新型四唑类化合物:一水合双四唑乙烷·四水合镁([Mg(BTE)(H2O)4]n·nH2O)和双四唑乙烷·五水合钙([Ca(BTE)(H2O)5]n)。培养得到了单晶,并对其结构进行了解析和表征。采用差示扫描量热法(DSC)和热重法(TG⁃DTG)研究了这两种化合物的热分解性能,通过BAM 方法测试了它们的机械感度,为进一步探索这类化合物的潜在应用提供了基础数据。
2 实验部分
2.1 试剂与仪器
丁二腈,济南子安化工厂;叠氮化钠,中国医药公司;氯化锌,兰州黄河锌品有限公司;碱式碳酸镁,天津市福晨化学试剂厂;碳酸钙,北京化工厂。实验所用试剂均为分析纯。
Rigaku Saturn 724+CCD 型X 射线单晶衍射仪(日本理学公司);Equinox 55 型傅里叶变换红外光谱仪(德国Bruker 公司,用KBr 压片,4000~400 cm-1,分辨率4 cm-1);Flash EA 1112 型元素分析仪(美国热电公司);CDR⁃4P 型差示扫描量热仪(上海乐申仪表电子有限公司);METTLER TOLEDO TGA/DSC 3+型热重分析仪(梅特勒托利多国际贸易公司)。
2.2 实验过程
采用Sharpless方法[13],以丁二腈(NC⁃CH2CH2⁃CN)和叠氮化纳(NaN3)为原料,在氯化锌(ZnCl2)的催化作用下一步合成出1,2⁃二(四唑⁃5⁃基)乙烷(H2BTE),得到的产物用乙醇、异丙醇、水等溶剂进行重结晶、提纯,得到目标产物。
在三口圆底烧瓶中加入0.1952 g(0.4 mmol)碱式碳酸镁((MgCO3)4·Mg(OH)2·5H2O)和0.3323 g(2 mmol)1,2⁃二(四唑⁃5⁃基)乙烷,加入20 mL 水,磁力搅拌,在60 ℃的条件下恒温反应30 min 至溶液中不再产生气泡。待反应液冷却至常温,过滤,得到无色透明的溶液。将滤液置于烧杯中静置5 d,得到体一水合双四唑乙烷·四水合镁白色晶,产品用乙醇清洗后在水浴烘箱烘干,产率为84.9%。IR(KBr,ν/cm-1):3110.5(H2O),2356.4(N—N,N=N),1615.6(C—N),1464.1,1396.1,1228.4,1137.2,1035.7,854.1,707.6(—CH2—CH2—),642.5,88.7;Anal. calcd. for C4H16N8O6Mg:C 16.20 H 5.44 N 37.79;found:C 16.50 H 5.56 N 37.99。
在三口圆底烧瓶中加入0.2002 g(2 mmol)碳酸钙(CaCO3)和0.3323 g(2 mmol)1,2⁃二(四唑⁃5⁃基)乙烷,加入20 mL 的水,磁力搅拌,在60 ℃的条件下恒温反应30 min 至溶液中不再产生气泡。待反应液冷却至常温,过滤,得到无色透明的溶液。将滤液置于烧杯中静置5 d,得到双四唑乙烷·五水合钙白色晶体,产品用乙醇清洗提纯,烘干,产率为90.9%。IR(KBr,ν/cm-1):3413.9(H2O),2236.2(N—N,N =N),1637.3(C—N),1461.4,1393.8,1213.9,1125.7,1034.8,782.1,708.1(—CH2—CH2—),580.7,469.5;Anal. calcd. for C4H14N8O5Ca:C 16.32 H 4.79 N 38.08;found:C 16.49 H 4.88 N 38.23。
[Mg(BTE)(H2O)4]n·nH2O 和[Ca(BTE)(H2O)5]n的合成路线见Scheme 1。
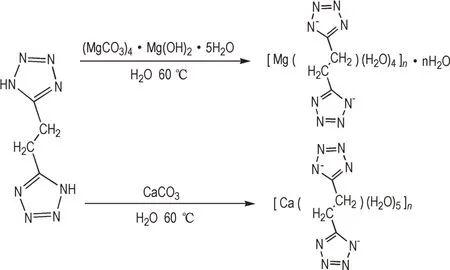
Scheme 1 Synthesis route of[Mg(BTE)(H2O)4]n·nH2O and[Ca(BTE)(H2O)5]n
3 结果与讨论
3.1 晶体结构及分析
使用Rigaku Saturn 724+CCD 型X 射线单晶衍射仪进行衍射分析,测试温度为102.0 K,选用波长λ=0.71073 Å 的Mo Kα射线。所得的晶体学参数如表1所示。
选 用 尺 寸 为0.12 mm×0.11 mm×0.03 mm 的[Mg(BTE)(H2O)4]n·nH2O 的晶体进行衍射分析,共采集到3877 个衍射点,其中1354 个独立衍射点用于结构解析。[Mg(BTE)(H2O)4]n·nH2O 属于单斜晶系,空间群为P21/c,密度为1.646 g·cm−3,a=9.0367(18)Å,b=9.1427(18)Å,c=7.4491(15)Å,β=103.51(3)°,Z=2。
[Mg(BTE)(H2O)4]n·nH2O 的不对称结构单元图和分子堆积图如图1 所示。从图1a 可以看出每个中心Mg2+均为六配位,与四个氧原子和两个氮原子相连,形成一个八面体结构。其中O(1)—Mg(1)—O(1),O(2)—Mg(1)—O(2)和N(1)—Mg(1)—N(1)的夹角均为180°,因此这四个氧原子在同一平面上,但是O(1)—Mg(1)—N(1)的夹角为92.23(5)°,说明两个氮原子所在的直线与四个氧原子所形成的面不垂直,这是由于该化合物中存在1分子的结晶水靠着氢键的作用与整个结构结合。扭转角Mg(1)—N(1)—C(1)—N(4)为164.57(12)°,两个与Mg2+直接相连的四唑环以一定的扭曲角度相互平行。除此之外,四唑环上的N—N 键的键长分布在1.3094(19)~1.350(2)Å,介于N—N 单键(1.454 Å)和N =N 双键(1.245 Å)之间。从图1b 和图1c 可以看出,分子堆积出类似于石墨的二维层状晶型结构,两个相互平行的四唑环分子错位面对面堆积在一起,同时由于水分子的存在整个结构里存在大量的氢键,进一步提高了分子框架的稳定性。
选 用 尺 寸 为0.24 mm×0.21 mm×0.20 mm 的[Ca(BTE)(H2O)5]n的晶体进行衍射分析,共采集到5771 个衍射点,其中1332 个独立衍射点用于结构解析。[Ca(BTE)(H2O)5]n属 于 正 交 晶 系,空 间 群 为Pnnm,密 度 为1.796 g·cm−3,a=11.205(2)Å,b=13.605(3)Å,c=7.1415(14)Å,Z=4。
[Ca(BTE)(H2O)5]n的不对称结构单元图和分子堆积图如图2 所示。从图2a 可以看出,每个不对称的单元里有两个Ca2+,四个BTE 配体以及十个配位水分子,每个Ca2+都是九配位,和三个BTE配体上的氮原子以及六个配位水中氧原子的相连。BTE配体与Ca2+有两种配位模式,一种是BTE的四唑环上只有N(5)位置参与配位,另一种则是BTE 四唑环上N(1),N(2)位置同时参与配位。两个Ca2+之间的两个水分子分别与两个Ca2+同时配位,形成一个桥状的结构。其中Ca(1)—N(1)的键长为2.761(2)Å,Ca(1)—N(5)的键长为2.753(2)Å,Ca(1)—N(2)的键长为2.783(2)Å;其中Ca(1)—O(1)的 键 长 为2.4361(14)Å,Ca(1)—O(2)的 键 长 为2.4469(14)Å,Ca(1)—O(3)的键长为2.5933(12)Å。结构中N—N键的键长在分布在1.307(3)Å~1.356(3)Å,介于N—N 单键(1.454 Å)和N=N 双键(1.245 Å)之间。从图2b 和图2c 可以看出,靠着BTE 配体的连接作用,使得整个结构在二维平面内以锯齿形延伸。由于配位水的存在,堆积结构中存在大量的氢键,同时也靠着氢键的作用形成堆积结构的框架。
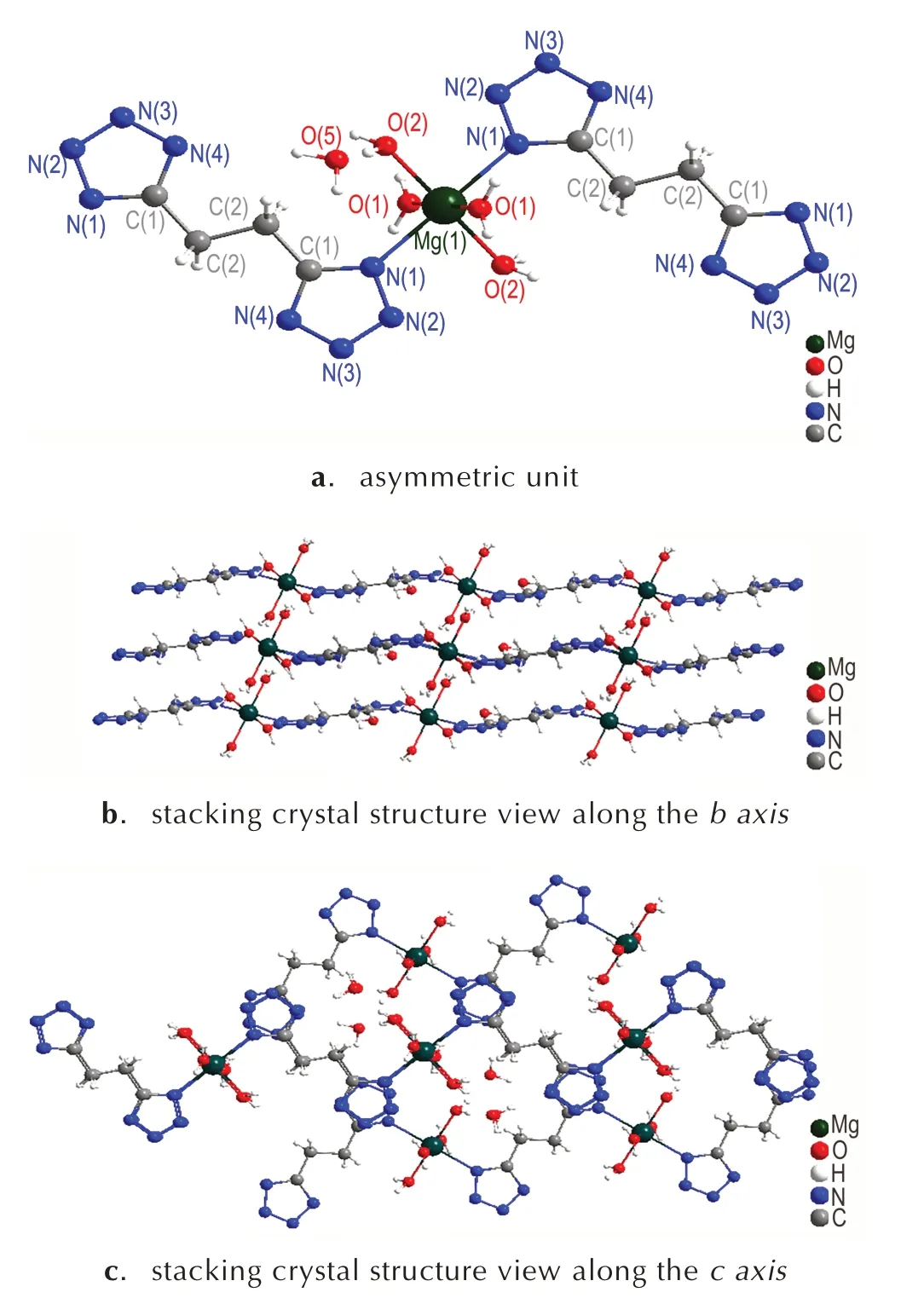
图1 [Mg(BTE)(H2O)4]n·nH2O 的不对称结构单元和分子结构堆积图Fig.1 The asymmetric unit and stacking crystal structure of[Mg(BTE)(H2O)4]n·nH2O

图2[Ca(BTE)(H2O)5]n的不对称结构单元和分子堆积结构图Fig.2 The asymmetric unit and stacking crystal structures of[Ca(BTE)(H2O)5]n
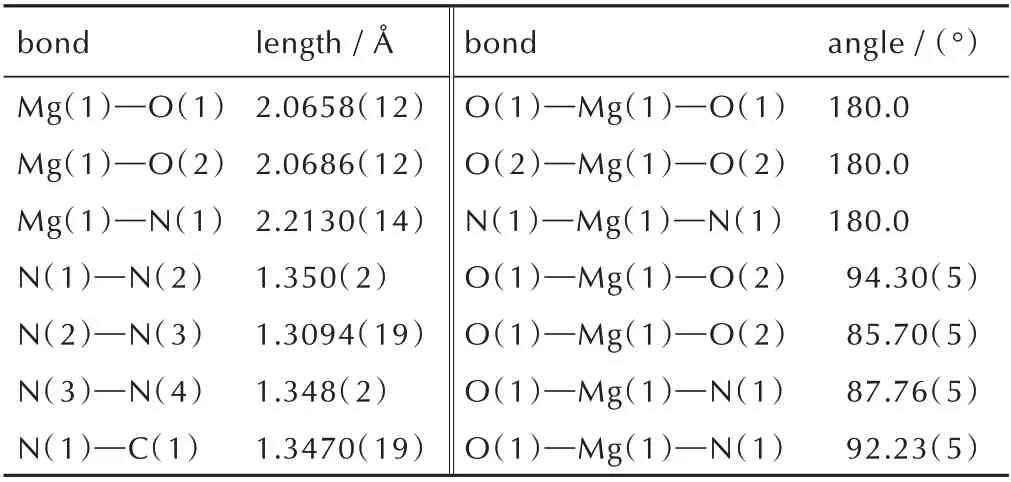
表2 [Mg(BTE)(H2O)4]n·nH2O 的部分键长和键角Table 2 Selected bond lengths and angles of compound[Mg(BTE)(H2O)4]n·nH2O
3.2 热分析
3.2.1 DSC 和TG⁃DTG 分析

图3 [Mg(BTE)(H2O)4]n·nH2O 和[Ca(BTE)(H2O)5]n 的DSC 和TG⁃DTG 曲线Fig. 3 The DSC and TG⁃DTG curves of compounds[Mg(BTE)(H2O)4]n·nH2O and[Ca(BTE)(H2O)5]n
采 用DSC 法、TG⁃DTG 法 对 化 合 物[Mg(BTE)(H2O)4]n·nH2O 和[Ca(BTE)(H2O)5]n的热分解过程进行了分析,升温速率为10 ℃·min-1,N2为保护气氛。它们的DSC、TG⁃DTG 曲线如图3 所示。其中从图3a可以看出,化合物[Mg(BTE)(H2O)4]n·nH2O 有一个吸热峰和两个放热峰,峰顶温度分别为154,387.7 ℃和405.9 ℃,吸热峰尖而窄,说明在该温度下化合物迅速脱去结晶水和配位水,放热峰相对较宽,说明化合物在该温度下迅速分解放热。从图3b 可以看出,该化合物有两个明显的质量损失过程,在106.8~190.0 ℃有一个快速的质量损失阶段,质量损失为33.6%,与[Mg(BTE)(H2O)4]n·nH2O 失去5 个水分子的计算值30.4% 基本相同,在366.1~455.1 ℃的质量损失在32.7%,该阶段主要为四唑的开环与分解,放热过程中最大质量损失速率出现在417.7 ℃处,分解产物的最终余量为23.2%,主要成分为镁的化合物和碳。从图3c 可以看出,化合物[Ca(BTE)(H2O)5]n有两个吸热峰和一个放热峰,峰顶温度分别为95.5,111 ℃和415.8 ℃,两个吸热峰表明在不同温度下不同位置的配位水分别脱去,放热峰窄而尖锐,说明在该温度下化合物迅速分解,大量放热。从图3d 可以看出,该化合物有两个明显的质量损失过程,在92.3~169.2 ℃,有一个明显的质量损失阶段,质量损失在21.2%,与[Ca(BTE)(H2O)5]n失去4 个水分子的计算值24.5%基本相同,另1 个水分子由于在桥联结构中相对稳定,在之后的升温过程中脱去,在361.5~447.6 ℃也有一个质量损失阶段,质量损失在20.7%,该阶段主要为四唑的开环与分解,C—N 键,N=N 键以及Ca—N 键在这个阶段发生断裂,放热过程中最大质量损失速率出现在416.8 ℃处,分解产物的最终余量在50.8%,主要成分为钙的化合物和碳。
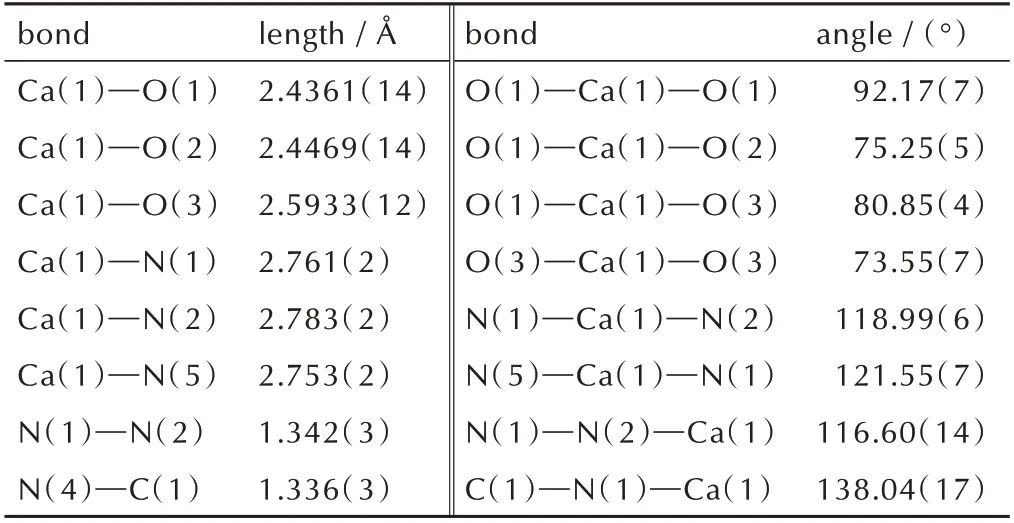
表3 [Ca(BTE)(H2O)5]n的部分键长和键角Table 3 Selected bond lengths and angles of compound[Ca(BTE)(H2O)5]n
两种化合物的第一放热峰峰顶温度均在400 ℃左右,相比于配体H2BTE(244 ℃)温度提高了近160 ℃,这是因为在分子结构中存在金属原子,同时分子间含有大量的氢键,进一步稳固了晶胞结构。在100 ℃左右,两种化合物开始脱去结晶水和配位水,通过与DSC 曲线进行对比,放热过程中最大质量损失速率处的温度与DSC 曲线上放热峰附近的温度基本相同。分解产物的残余质量要比计算值略大,这是因为整个热分解过程是在N2气氛下进行的,两种化合物本身是负氧平衡,在加热过程中未完全分解,同时四唑环生成的碳也会增加残余质量。
3.2.2 非等温反应动力学
动力学参数指前因子A 和表观活化能Ea在含能化合物的热分解动力学研究中,能够在微观上量化表征化合物的分解动力学特性,因此对化合物的非等温动力学参数和热力学参数进行研究具有重要意义。选用5、10、15、20 ℃·min-1四个不同升温速率用DSC 法测试化合物的热分解曲线,得到第一放热峰的峰温,采用Kissinger 法[14]和Ozawa 法[15]两种方法分别计算了第一放热峰的指前因子A,表观活化能E,线性相关系数r等热力学参数。计算公式如式(1)、式(2)所示:
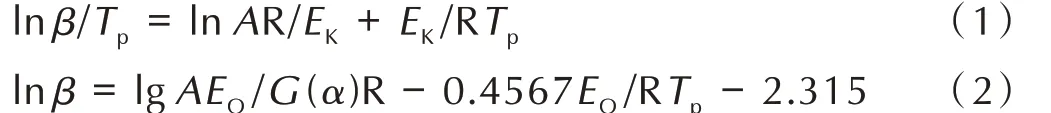
式中,β 为线性升温速率,K·min-1;Tp为第一分解放热峰的峰顶温度,K;A 为指前因子,s-1;R 为气体常数,8.314 J·K-1·mol-1;EK为 用Kissinger 法 中 计 算 的 表 观活 化 能,kJ·mol-1;EO为 用Ozawa 法 计 算 的 表 观 活 化能,kJ·mol-1;G(α)为 反 应 动 力 学 函 数。[Mg(BTE)(H2O)4]n·nH2O 和[Ca(BTE)(H2O)5]n的非等温动力学参数计算结果如表4 所示。
所以根据Kissinger 法计算得到的指前因子和表观活化能可得到化合物[Mg(BTE)(H2O)4]n·nH2O 的阿仑尼乌斯方程为:lnk=39.28-240.6×10-3/RT,其表观活化能为240.6 kJ·mol-1;化合物[Ca(BTE)(H2O)5]n阿仑尼乌斯方程为:lnk=48.40-302.8×10-3/RT,其表观活化能为302.8 kJ·mol-1。
3.2.3 热力学参数
热力学参数是评价一种化合物热安定性的重要指标,包括热力学参数包括热爆炸临界温度(Tb)、活化自由能(ΔG≠)、活化熵(ΔS≠)和活化焓(ΔH≠),其中热爆炸临界温度(Tb)可由张⁃胡⁃谢⁃李方程[16]得到,活化自由能(ΔG≠)、活化熵(ΔS≠)和活化焓(ΔH≠)这些研究含能化合物物理化学性质的参数可以通过式(3)~式(7)求得:
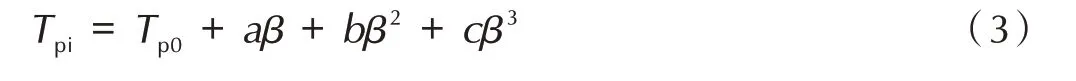

式中,Tpi为升温速率为β 时第一分解放热峰的峰顶温度,K;Tp0为升温速率β→0 K·min-1时的放热峰峰温,K;a、b、c为常数;β为线性升温速率,K·min-1;Tb为热爆炸临界温度,K;EK为用Kissinger 法中计算的表观活化能,kJ·mol-1;R 为气体常数,8.314 J·K-1·mol-1;A 为指前因子,s-1;kB为玻尔兹曼常数,1.381×10-23J·K-1;h 为普朗克 常 数,6.626×10-34J·s;ΔS≠为 活 化 熵,J·K-1·mol-1;ΔH≠为活化焓,kJ·mol-1;ΔG≠为活化自由能kJ·mol-1。计算结果如表5 所示。吉布斯自由能(ΔG≠)均大于零,说明其热分解过程是一个非自发反应的过程。
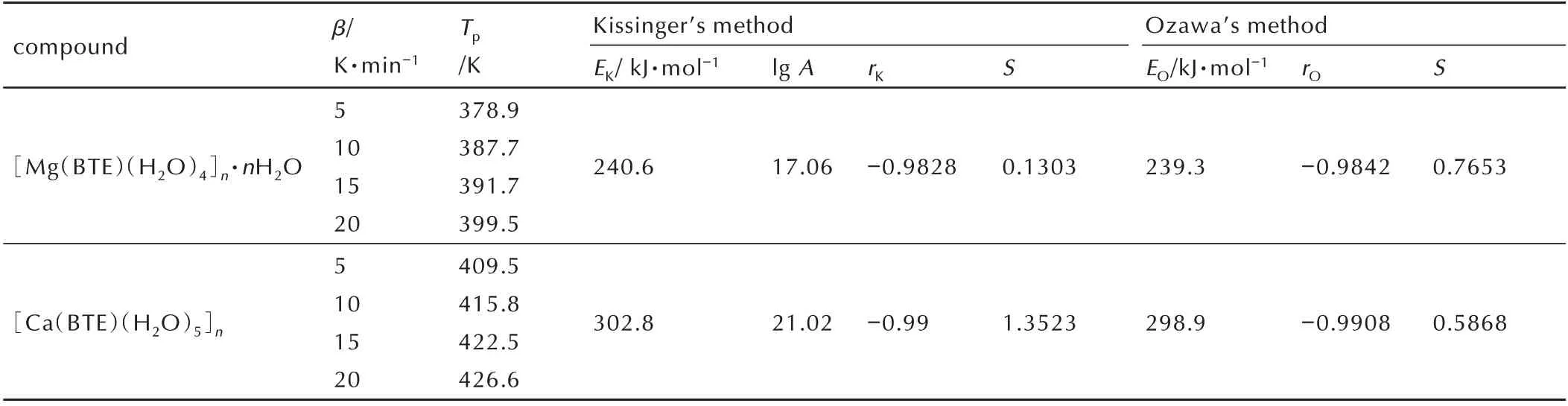
表4 化合物[Mg(BTE)(H2O)4]n·nH2O 和[Ca(BTE)(H2O)5]n的峰温和非等温动力学参数Table 4 Peak temperatures and non⁃isothermal kinetics parameters of[Mg(BTE)(H2O)4]n·nH2O and[Ca(BTE)(H2O)5]n

表5 [Mg(BTE)(H2O)4]n·nH2O 和[Ca(BTE)(H2O)5]n的热力学参数Table 5 The thermodynamic parameters of[Mg(BTE)(H2O)4]n·nH2O and[Ca(BTE)(H2O)5]n
4 结论
(1)合成了两种新型化合物——一水合双四唑乙烷·四水合镁([Mg(BTE)(H2O)4]n·nH2O)和双四唑乙烷·五水合钙([Ca(BTE)(H2O)5]n),并对两种化合物的结构进行了表征,其中[Mg(BTE)(H2O)4]n·nH2O 属于单斜 晶 系,空 间 群 为P21/c,密 度 为1.646 g·cm−3;[Ca(BTE)(H2O)5]n属于正交晶系,空间群为Pnnm,密度为1.796 g·cm−3。
(2)采用DSC 法和TG⁃DTG 法对两种新型化合物进行了热分析研究,其中[Mg(BTE)(H2O)4]n·nH2O 的第一放热峰峰顶温度为387.7 ℃,[Ca(BTE)(H2O)5]n的第一放热峰峰顶温度为415.8 ℃,较配体1,2⁃二(四唑⁃5⁃基)乙烷(H2BTE)有了很大的提高。利用Kissinger法和Ozawa 法计算了两种化合物的表观活化能和指前因子,并计算得到热分解动力学参数,其中[Mg(BTE)(H2O)4]n·nH2O 的 表 观 活 化 能 为240.6 kJ·mol-1,[Ca(BTE)(H2O)5]n的 表 观 活 化 能 为302.8 kJ·mol-1,表明两种化合物在受热分解时需要克服较高的能垒。
