绿盲蝽八个普通气味受体基因的克隆及功能鉴定
2020-11-12王晨蕊王桂荣
李 彬, 张 赛, 王晨蕊, 王桂荣, 刘 杨
(中国农业科学院植物保护研究所, 植物病虫害生物学国家重点实验室, 北京100193)
绿盲蝽Apolyguslucorum是我国黄河流域和长江流域为害棉花的优势盲蝽种类,具有包括棉花、玉米、葡萄、枣、蔬菜等农作物在内的200多种寄主植物,对我国农业生产造成了严重的破坏。自1997年转Bt基因抗虫棉在我国商业化种植以来,化学农药使用量大幅度减少,一方面增加了天敌昆虫的种类和数量,加强了部分害虫的自然调控作用,有效地控制了棉蚜的种群发展(Luetal., 2012),另一方面天敌控制作用较差的害虫如绿盲蝽上升为主要害虫(Luetal., 2010)。绿盲蝽种群的暴发还波及其他寄主作物, 近年来在各类果树、茶树等其他作物上为害也十分严重。虽然近年间人们致力于利用生态学和生物防治等手段对绿盲蝽进行综合防治,但由于绿盲蝽具有寄主范围广、寄主转换行为、高迁移性等独特的生物学特性,造成这些防治措施并没有达到最佳效果(Lu and Wu, 2011)。目前我国对绿盲蝽的防控还主要依赖化学农药,如何绿色防治绿盲蝽仍然是我国农业生产面临的重要科学问题。
植物挥发物在植物与昆虫的通讯作用中发挥了关键作用,可以调控昆虫的多种行为,如引起昆虫对寄主植物的定向选择,引导昆虫寻找合适的产卵场所,影响昆虫的交配行为等(杜家纬, 2001)。昆虫对寄主植物的定向选择是植物与昆虫相互依存关系中最重要的行为之一。昆虫通过自身的视觉器官、味觉器官、触觉器官和嗅觉器官等各种感觉系统不断收集来自植物的各种信息,从形状、颜色、大小、化学性质、形态结构等方面对植物进行综合评价,最后做出寄主选择(陆宴辉等, 2008)。在昆虫诸多的感觉系统中灵敏的嗅觉系统发挥了决定作用。昆虫主要通过对寄主植物挥发的气味分子的识别来对寄主植物识别和定位。因此,准确了解昆虫对寄主植物挥发物的识别机制不仅可以在理论上阐明昆虫嗅觉识别高度特异性的分子和神经基础,在应用上还可以开发昆虫行为调控剂用于害虫的绿色防控。
昆虫的嗅觉识别是一个复杂的过程,在外周神经水平上主要通过分布在触角上嗅觉感器中的一系列蛋白参与来完成,这些蛋白包括气味受体(odorant receptor, OR)、气味结合蛋白(odorant binding protein, OBP)、离子型受体(ionotropic receptor, IR)、化学感受蛋白(chemosensory protein, CSP)、感觉神经元膜蛋白(sensory neuron membrane protein, SNMP)、尼曼匹克C2蛋白(Niemann-Pick proteins of class C2, NPC2)和气味降解酶(odorant degrading enzyme, ODE)(Rutzler and Zwiebel, 2005; de Bruyne and Baker, 2008; Sato and Touhara, 2008; Zhuetal., 2018),其中气味受体发挥了核心作用。目前已知的昆虫气味受体分为2类:第1类为在不同昆虫间高度保守且广泛表达的非典型受体(olfactory receptor co-receptor, Orco);第2类为种间高度变异的传统气味受体(conventional odorant receptor, Orx)(Mombaerts, 1999; Bentonetal., 2006)。Orx不单独对气味分子起识别作用,而是与Orco形成异源多聚体(Butterwicketal., 2018),共同将环境中的小分子化学信号转变为电信号,使嗅觉神经元产生动作电位,最终引起昆虫作出相应的行为活动(Larssonetal., 2004)。自1999年首次从黑腹果蝇Drosophilamelanogaster中鉴定出昆虫气味受体以来,伴随着一些模式昆虫基因组数据的公布,一系列昆虫气味受体基因家族被鉴定出来。包括从果蝇基因组中鉴定出62个气味受体基因(Clyneetal., 1999; Gao and Chess, 1999; Vosshalletal., 1999)。在家蚕Bombyxmori中鉴定出48个气味受体基因(Sakuraietal., 2004; Nakagawaetal., 2005; Wanneretal., 2007)。随着气味受体基因陆续被鉴定,研究者们已经从分子和细胞层面展开对昆虫气味受体功能的一系列研究。
研究绿盲蝽的气味受体,有利于我们从分子层面深入了解绿盲蝽对寄主植物的嗅觉识别机制,为研制高效的引诱剂或驱避剂提供理论依据并开辟新途径。在实验室前期工作中,已通过绿盲蝽成虫触角转录组测序和生物信息学分析获得多条绿盲蝽气味受体基因序列。本研究中我们筛选并克隆了其中8个绿盲蝽气味受体基因,并对其表达模式和功能进行了研究,为研究绿盲蝽对寄主植物的识别机制提供理论基础。
1 材料与方法
1.1 供试昆虫与组织收集
实验所用的绿盲蝽采自中国农业科学院廊坊试验基地,在中国农业科学院植物保护研究所实验室中使用新鲜四季豆Phaseolusvulgaris和鲜食玉米Zeamays在塑料盒内进行人工饲养。饲养温度为28±1℃,相对湿度为60%~70%,光周期为16L∶8D。收集羽化3 d的绿盲蝽雌雄成虫触角、头(无触角)、胸、腹、足和翅6种组织,用液氮迅速冷冻,储存于-70℃冰箱内备用。以相同方式收集3组不同批次的昆虫各组织样品。
1.2 RNA提取与cDNA的合成
使用Trizol试剂(Invitrogen,美国)按照说明书提取1.1节3组不同批次绿盲蝽雌雄成虫6种组织(触角、无触角的头、胸、腹、足和翅)的总RNA。每组触角、头(无触角)、胸、腹、足和翅的总RNA分别取自100,50,20,20,80和80头羽化3 d的绿盲蝽成虫。提取的总RNA通过NanoDrop 2000(NanoDrop Products,美国)来检测浓度和1.0%的琼脂糖凝胶电泳来检测质量。取2 μg各个组织的RNA,以Oligo dT为引物,合成cDNA第1链,实验操作依照First Strand cDNA Synthesis Kit(Thermo Scientific,美国)使用手册。此cDNA用作PCR和实时定量PCR(qPCR)的模板。
1.3 引物设计
基于实验室前期对绿盲蝽成虫触角转录组的测序和分析,我们选择具有完整开放阅读框的AlucOR9,AlucOR16,AlucOR38,AlucOR53,AlucOR55,AlucOR56,AlucOR57和AlucOR58进行基因克隆和功能验证。在qPCR实验中,选用绿盲蝽的持家基因AlucActin(GenBank登录号: KU188517.1)为内参基因(张志翔等, 2016)。使用Primer Premier 5.0软件设计基因克隆和qPCR引物,全部引物信息见表1。所有引物均由生工生物工程(上海)股份有限公司合成。

表1 本研究所用引物信息
1.4 基因克隆
以绿盲蝽触角cDNA为模板,利用基因克隆特异性引物扩增AlucOR9,AlucOR16,AlucOR38,AlucOR53,AlucOR55,AlucOR56,AlucOR57,AlucOR58以及AlucOrco(GenBank登录号: MN657161)的完整开放阅读框序列。PCR反应体系: 2×PrimeStar Mix 12.5 μL(含Mg2+),正反向引物(10 μmol/L)各1 μL,加水至25 μL。在震荡器上混匀,短暂离心,放入PCR仪中进行扩增。其反应条件: 98 ℃预变性3 min; 98℃ 变性10 s, 55℃退火15 s, 72℃延伸90 s, 35个循环;最后72℃延伸10 min。PCR扩增产物通过1.0%琼脂糖凝胶电泳检测并将条带进行胶回收。将回收后的PCR产物连接到pEASY-Blunt克隆载体(全式金生物技术有限公司,北京)上,然后转入Trans-1-T1感受态细胞(全式金生物技术有限公司,北京)内,进行测序(华大基因,北京)。
1.5 序列分析
使用EXPASY(Expert Protein Analysis System)(http:∥www.expasy.org)的Translate tool(http:∥web.expasy.org/translate)将8条气味受体基因核苷酸序列翻译成氨基酸序列。使用TOPCONS(http:∥topcons.net)进行跨膜结构域预测。使用DNAMAN(http:∥www.lynnon.com)软件将AlucOR9, AlucOR16, AlucOR38, AlucOR53, AlucOR55, AlucOR56, AlucOR57和AlucOR58 的氨基酸序列进行比对。
1.6 qPCR检测
利用qPCR检测AlucOR9,AlucOR16,AlucOR38,AlucOR53,AlucOR55,AlucOR56,AlucOR57和AlucOR58的表达水平。采用2×Go Taq qPCR Master Mix(Promega, 美国)在实时荧光定量PCR仪iCycler iQ2(Bio-Rad,美国)上进行qPCR。反应体系: 2×Go Taq qPCR Master Mix 10 μL, 上下游引物(10 μmol/L)各0.5 μL, 1.2节合成的cDNA 模板1 μL, RNase-free Water 8 μL。反应条件: 95℃预变性2 min; 95℃变性15 s, 60℃退火1 min, 40个循环。所有样品均使用独立的RNA进行3次重复,内参基因AlucActin。通过2-ΔΔCt值法来比较各个基因不同组织的相对表达量,计算公式如下: ΔCt=Ct目标基因-Ct内参基因; ΔΔCt=ΔCt样品-ΔCt参照物。得到的3套模板的2-ΔΔCt值作图,并比较基因的相对表达量。
1.7 表达载体构建和cRNA合成
将测序结果正确的各AlucOR基因经ApaⅠ和NotⅠ双酶切后,亚克隆到表达载体pT7Ts上(体系为6 μL双酶切后的基因片段, 1 μL 10×T4 Ligase Buffer, 2 μL 双酶切过的pT7Ts 载体和1 μL T4 Ligase,连接条件为22℃保持2 h),连接体系转入Trans-1-T1感受态细胞(全式金生物技术有限公司,北京)内。过夜培养后,挑取8个阳性克隆进行菌液PCR验证,然后测序。验证正确的重组质粒,使用SmaⅠ进行单酶切质粒线性化,利用mMESSAGE mMACHINET7(Ambion,美国)进行cRNA的合成。
1.8 气味化合物
实验中共使用56种气味化合物,均来自百灵威和Sigma-Aldrich公司(纯度≥95%),见表2。实验所用气味化合物首先用DMSO配制成1 mol/L的储备液,存储在-20℃冰箱中备用。实验前,使用1×Ringer(96 mmol/L NaCl, 2 mmol/L KCl, 5 mmol/L MgCl2, 0.8 mmol/L CaCl2和5 mmol/L HEPES, pH 7.6)溶液稀释到浓度为10-4mol/L。为确保实验结果的准确,每次实验所用气味化合物均是现用现配。

表2 本研究所用气味化合物
1.9 爪蟾卵母细胞表达结合双电极电压钳记录
爪蟾卵母细胞表达和双电极电压钳记录方法参照前人的使用方法(Luetal., 2007; Wangetal., 2010)。将合成好的浓度为2 μg/μL的AlucOR和AlucOrcocRNA各1 μL混匀到一起,按照每个细胞注射27.6 nL的量注射到健康且成熟的爪蟾卵母细胞中。将注射好的爪蟾卵母细胞放在培养液(1×Ringer, 5% 马血清,50 μg/mL四环素,100 μg/mL链霉素和50 μg/mL丙酮酸钠)中以18℃恒温培养3 d。然后用OC-725C双电极电压钳(Warner,美国)记录爪蟾卵母细胞对不同气味挥发物刺激的反应。通过数模转化器Digidata 1440A和软件pCLAMP 10.2(Axon,美国)获取和分析具体的数据。
1.10 数据分析
基因表达量结果以平均值±标准差表示,雌雄各组织之间表达量的差异采用SAS软件LSD检验进行多重比较,利用one-way ANOVA的统计方法进行统计分析,显著性水平α=0.05。
2 结果
2.1 绿盲蝽气味受体基因的克隆和序列分析
根据实验室前期对绿盲蝽成虫触角转录组测序分析所得的结果,设计特异性克隆引物,克隆得到AlucOR9,AlucOR16,AlucOR38,AlucOR53,AlucOR55,AlucOR56,AlucOR57和AlucOR58的cDNA全长序列(GenBank登录号: MN905538-MN905545)。这8个气味受体基因的开放阅读框全长范围在1 131~1 312 bp,编码376~437个氨基酸。利用TOPCONS预测发现8个气味受体均具有7个跨膜结构域,N末端位于细胞膜内,C末端位于细胞膜外(图1)。通过序列比对发现这8个气味受体基因的氨基酸序列一致性在11.63%~64.23%。
2.2 8个气味受体基因在绿盲蝽雌雄成虫不同组织中的表达谱
利用qPCR方法检测8个气味受体基因在绿盲蝽雌、雄成虫不同组织的转录水平。结果表明,这8个气味受体基因均在成虫触角中高表达;除AlucOR38外,其他7个气味受体基因在雌成虫触角中的表达量显著高于在雄成虫中的(P<0.05)(图2)。
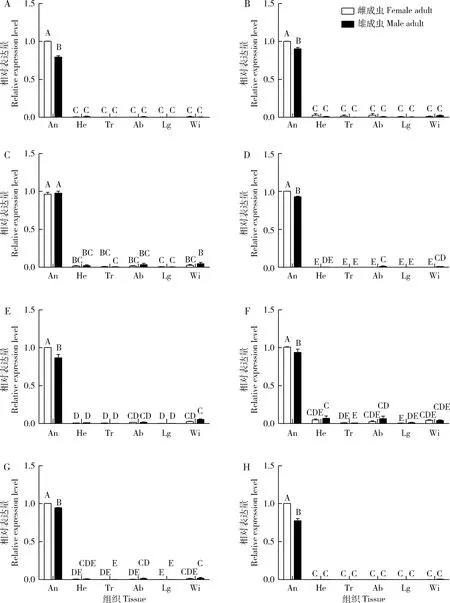
图2 8个绿盲蝽气味受体基因在成虫组织中的表达谱
2.3 8个绿盲蝽气味受体的功能分析
在爪蟾卵母细胞中分别将8个AlucOR分别与AlucOrco进行共表达,用双电极电压钳系统记录AlucOR/AlucOrco对共计56种测试气味化合物的电生理反应。电压钳记录结果显示,AlucOR57/AlucOrco对其中15种气味化合物(苯甲醛、氧化石竹烯、庚醛、反-2-己烯醛、乙酸苯甲酯、桃金娘烯醛、4-乙基苯甲醛、乙酸壬酯、四氢芳樟醇、十三烷、反-3-己烯醇、2-丙烯酸丁酯、丙酸丁酯、乙酸辛酯和乙酸戊酯)有反应(图3),对其余的气味化合物无反应;其他7个绿盲蝽气味受体对56种测试气味化合物均无反应。

图3 双电极电压钳记录的爪蟾卵母细胞共表达AlucOR57/AlucOrco对不同气味化合物的反应
3 讨论
本研究克隆得到了8个绿盲蝽气味受体的完整ORF序列,序列分析的结果显示这8个气味受体具有昆虫气味受体典型的结构特征(Bentonetal., 2006; Leal, 2013)。序列比对的结果显示绿盲蝽8个气味受体的氨基酸序列一致性非常低,这一结果符合昆虫气味受体序列高度特异性的特征,也与我们以前关于绿盲蝽气味受体的研究结果一致,暗示绿盲蝽的不同气味受体在功能上也可能存在较大差异(Yanetal., 2015)。
气味受体的功能与其表达模式具有密切的联系(Kriegeretal., 2002; Legeaietal., 2011),因此不同气味受体在组织表达模式上存在很大差异。性信息素受体一般在雄虫触角内高表达或特异性表达,而普通气味受体的表达模式则变化很大。一些气味受体可能在雌虫触角上高表达或特异表达,例如家蚕的BmOR19, BmOR30, BmOR45和BmOR47都在雌虫触角中高表达,且能识别芳樟醇、苯甲酸、2-苯乙醇和苯甲醛等植物挥发物,推测其可能参与雌虫对产卵场所的选择(Andersonetal., 2009)。很多气味受体在雌雄成虫触角间具有相同的表达水平,如苜蓿盲蝽Adelphocorislineolatus的AlinOR8在雌雄成虫触角中均高表达,且对7种酯类、芳香族和醇类化合物有反应,因此推测其可能参寄主植物的选择(严曙玮, 2015)。某些气味受体还在触角之外的其他组织中表达。qPCR结果(图2)显示8个绿盲蝽气味受体基因均在触角中高表达,暗示它们参与了绿盲蝽的嗅觉识别过程;而不同气味受体基因在雌雄触角中的表达存在明显不同,虽然8个气味受体基因在雌雄触角中的表达量都很高,但其中7个气味受体基因在雌虫触角中表达量均高于雄虫触角中的,暗示它们可能在雌虫的嗅觉感受中发挥重要的作用。
利用爪蟾卵母细胞异源表达结合双电极电压钳记录系统,我们检测了8个绿盲蝽气味受体对56种气味化合物的反应。结果显示只有AlucOR57对15种气味化合物(苯甲醛、氧化石竹烯、庚醛、反-2-己烯醛、乙酸苯甲酯、桃金娘烯醛、4-乙基苯甲醛、乙酸壬酯、四氢芳樟醇、十三烷、反-3-己烯醇、2-丙烯酸丁酯、丙酸丁酯、乙酸辛酯和乙酸戊酯)有反应,而其余7个气味受体对这56种气味化合物均无反应(图3)。AlucOR57可以识别的15种气味化合物组分包括多种已知的绿盲蝽寄主植物挥发物,如潘洪生(2013)从绿盲蝽寄主植物的花期挥发物中鉴定出了2-丙烯酸丁酯和丙酸丁酯,这两种化合物可以激活绿盲蝽雌雄成虫触角的电生理反应。2-丙烯酸丁酯和丙酸丁酯混合物(3∶1)在田间对绿盲蝽显示出很好的诱集效果(潘洪生等, 2014)。而对于绿盲蝽的近缘物种中黑盲蝽Adelphocorissuturalis、苜蓿盲蝽和三点盲蝽Adelphocorisfasciaticollis,2-丙烯酸丁酯和丙酸丁酯也有显著的吸引作用(修春丽, 2014)。AlucOR57对多种植物挥发物均有反应,我们推测该受体可能参与绿盲蝽对寄主植物的识别和定位。但以上推测仍需要进一步的RNAi或基因敲除实验进行体内功能和行为学实验验证。
除AlucOR57以外,我们检测的其他7个绿盲蝽气味受体对检测的56种气味化合物均无反应(图3),这可能是由于我们检测的气味数量较少,这7个气味受体的配体不在检测的范围之中。此外,在昆虫体内气味受体对气味分子的识别还需要其他蛋白包括气味结合蛋白、化学感受蛋白、感觉神经元膜蛋白以及NPC2蛋白的参与,而我们在进行体外功能检测时并未加入这些蛋白,可能影响到气味受体发挥其正常的功能。这几个受体的具体功能如何,仍需后续试验进行验证。
根据本研究的结果,我们推测AlucOR57在绿盲蝽对寄主植物识别过程中发挥了重要功能,对此气味受体的研究有助于我们进一步了解绿盲蝽识别寄主植物的分子机制,为研发高效环保的绿盲蝽行为调控剂提供理论指导,为绿盲蝽的综合防治提供新思路和新方法。
