雄性棉铃虫感受性信息素的分子和神经机制研究进展
2020-11-12刘晓岚尹新明王桂荣赵新成
刘晓岚, 尹新明, 王桂荣, 赵新成,*
(1.河南农业大学植物保护学院, 郑州 450002; 2.中国农业科学院植物保护研究所, 植物病虫害生物学国家重点实验室, 北京 100193)
通常,性成熟雌性昆虫释放的微量信息化合物即性信息素,作为化学信号作用于同种雄性个体,引起趋向和交配行为(Karlson and Butenandt, 1959)。蛾类昆虫主要依赖于性信息素通讯引诱同种异性个体,完成雌雄识别,实现交配和种群繁衍。关于蛾类性信息素的研究一直是化学生态学领域的热点和重心,研究结果有助于开发和改进害虫防治的性引诱剂(Symonds and Elgar, 2008)。国内学者曾就实夜蛾属Heliothis和铃夜蛾属Helicoverpa性信息素通讯系统(赵新成等, 2003a)、蛾类性信息素通讯系统的遗传与进化(赵新成和王琛柱, 2006)和昆虫触角叶的结构(赵新成等, 2015)方面的研究进展进行了综述。本文将对棉铃虫Helicoverpaarmigera雄虫感受雌虫释放的性信息素的分子和神经机制的研究进展进行综述,以期为深入研究棉铃虫及其他相关昆虫的嗅觉机理提供参考。
1 棉铃虫性信息素组分及功能
1959年,首个蛾类性信息素即家蚕Bombyxmori雌性信息素成分反-10, 顺-12-十六碳双烯醇(trans-10,cis-12-hexadecadienol,E10,Z12-16∶OH)获得鉴定(Karlson and Butenandt, 1959),其后,鳞翅目其他昆虫信息素的提取鉴定工作陆续展开。Piccardi等(1977)首次从棉铃虫雌虫性信息素腺体提取物中鉴定到顺-11-十六碳烯醛(cis-11-hexadecenal,Z11-16∶Ald)。随后,顺-11-十六碳烯醇(cis-11-hexadecenol,Z11-16∶OH)、顺-9-十六碳烯醛(cis-9-hexadecenal,Z9-16∶Ald)、十六醛(hexadecanal, 16∶Ald)和十六醇(hexadecanol, 16∶OH)等化合物在棉铃虫雌虫性信息素腺体中获得鉴定(Nesbittetal., 1979)。Kehat 和 Dunkelblum(1990)发现棉铃虫雌虫性信息素腺体内除上述已鉴定的成分外,还有顺-7-十六碳烯醛(cis-7-hexadecenal,Z7-16∶Ald)和顺-9-十四碳烯醛(cis-9-tetradecenal,Z9-14∶Ald)(Kehat and Dunkelblum, 1990)。Zhang JP等(2012)在棉铃虫雌虫性信息素腺体内共鉴定出10种化合物成分,其中庚醛(heptanal, 7∶Ald)、壬醛(nonanal, 9∶Ald)和十四醛(tetradecanal, 14∶Ald)为新鉴定出的组分。腺体中10种组分7∶Ald, 9∶Ald, 14∶Ald,Z9-14∶Ald, 16∶Ald,Z7-16∶Ald,Z9-16∶Ald,Z11-16∶Ald, 16∶OH和Z11-16∶OH的含量相对比例为0.56∶4.92∶0.81∶0.30∶3.77∶0.96∶1.37∶100∶1.27∶4.40(Zhang JPetal., 2012)。在不同的研究中,所有被鉴定出的化合物中,Z11-16∶Ald在信息素腺体内的相对含量均为最高,然而,与其他组分的比例存在变异,其原因可能是在不同地理位置分布的棉铃虫本身信息素腺体成分含量具有差异。电生理研究表明,9∶Ald,Z9-14∶Ald,Z7-16∶Ald,Z9-16∶Ald,Z11-16∶Ald和Z11-16∶OH均能引起棉铃虫雄虫触角的电生理反应(Piccardietal., 1977; Nesbittetal., 1979; Zhang JPetal., 2012)。
室内行为生测和田间诱捕试验证明,单独使用Z11-16∶Ald就能够引诱棉铃虫雄虫,证明Z11-16∶Ald是棉铃虫重要的性信息素成分(Piccardietal., 1977; Nesbittetal., 1979; Kehatetal., 1980; Kehat and Dunkelblum, 1990; Wuetal., 1997; Zhang JPetal., 2012)。但是,单独的Z11-16∶Ald引诱率非常低,而加入少量Z9-16∶Ald组成混合物可显著增加引诱活性(Kehatetal., 1980; Nesbittetal., 1980)。这说明性信息素腺体内次要成分Z9-16∶Ald也是棉铃虫的性信息素成分。但对不同的地理种群,性信息素混合物Z11-16∶Ald与Z9-16∶Ald的诱捕效果最佳比例不同,变化范围一般为90%~99%的Z11-16∶Ald对1%~10%的Z9-16∶Ald(Kehatetal., 1980; Wuetal., 1997; Tamhankaretal., 2003),在我国山东棉铃虫种群Z11-16∶Ald与Z9-16∶Ald的比例为97∶3时田间诱捕效果最佳(Wuetal., 1997)。然而,在性信息素混合物Z11-16∶Ald与Z9-16∶Ald中加入Z11-16∶OH或Z9-14∶Ald均显著降低了对棉铃虫雄虫的引诱效果(Kehat and Dunkelblum, 1990; Wuetal., 1997),所以Z11-16∶OH和Z9-14∶Ald是抑制棉铃虫引诱行为的拮抗剂。最近研究发现,Z11-16∶OH具有调节棉铃虫最佳交配时间的作用,新羽化的棉铃虫雌虫性腺内含有较高比例的Z11-16∶OH,能抑制棉铃虫雄虫与未成熟的雌虫交配(Changetal., 2017)。但最新研究发现棉铃虫雌虫在实际交配过程中不太可能释放出足量的Z11-16∶OH来抑制交配行为,雌虫释放Z11-16∶OH在求偶交配发挥的作用还有待进一步研究(Hughes and Cardé, 2020)。而化合物Z9-14∶Ald虽能抑制棉铃虫雄虫对性信息素的反应,但当在Z11-16∶Ald与Z9-16∶Ald混合物中加入0.3%的Z9-14∶Ald时,性信息素混合物对棉铃虫雄虫的诱捕量增加1倍(Zhang JPetal., 2012),这说明Z9-14∶Ald也是棉铃虫的性信息素成分,但只在低剂量时具有引诱效果,而剂量较高时会表现出抑制效果(Wuetal., 2015)。田间诱捕试验证明Z7-16∶Ald对性信息素混合物诱捕效果没有影响,但实验室内行为试验证明在混合物中添加1%的Z7-16∶Ald可以提高交配率(Kehat and Dunkelblum, 1990)。化合物9∶Ald虽能引起棉铃虫雄虫触角的电生理反应,但室内行为生测和田间诱捕均证明9∶Ald没有行为活性(Zhang JPetal., 2012)。化合物16∶Ald不能引起明显的雄虫触角电生理活性(Nesbittetal., 1979),但Wu等(1997)发现在混合物Z11-16∶Ald与Z9-16∶Ald加入4%~7%的16∶Ald能明显增加田间诱捕效果。然而Kehat和Dunkelblum(1990)在风洞试验和Zhang JP等(2012)在田间诱捕试验却未发现16∶Ald有增效作用。因此,16∶Ald是否有行为引诱活性还需要开展更多试验进行验证。性信息素腺体内其他化合物7∶Ald, 14∶Ald和16∶OH对棉铃虫雄虫没有电生理活性,也没有行为活性。
综上所述,棉铃虫雌虫性信息素腺体合成和释放多种长链、饱和或非饱和的脂肪醛和醇,其中Z11-16∶Ald为主要性信息素成分,Z9-16∶Ald和Z9-14∶Ald为次要性信息素成分,不同组分间按一定比例混合可明显增强对棉铃虫雄虫的引诱效果,而化合物Z11-16∶OH和高剂量的Z9-14∶Ald对性信息素引诱活性具有明显的抑制效果。
烟青虫Helicoverpaassulta是棉铃虫近缘种,其性信息素腺体成分包括16∶Ald,Z9-16∶Ald,Z11-16∶Ald, 顺-9-十六碳烯醇(cis-9-hexadecenol,Z9-16∶OH),Z11-16∶OH, 十六碳酯(hexadecenyl acetate, 16∶Ac), 顺-9-十六碳烯乙酸酯(cis-9-hexadecenyl acetate,Z9-16∶Ac), 顺-11-十六碳烯乙酸酯(cis-11-hexadecenyl acetate,Z11-16∶Ac)和Z7-16∶Ald,其中Z9-16∶Ald和Z11-16∶Ald为烟青虫的性信息素,比例为93∶7时引诱效果最佳,与棉铃虫性信息素的比例恰好相反(Wangetal., 2005; Zhaoetal., 2006; 董钧锋等, 2015)。化合物Z9-16∶OH为行为拮抗剂,抑制烟青虫雄虫对性信息素的行为反应。除此之外,在性信息素混合物中加入Z9-14∶Ald,性信息素对烟青虫雄虫的引诱活性也被抑制。棉铃虫和烟青虫性信息素腺体成分相似,性信息素引诱活性成分和抑制活性成分也相似,这为比较研究性信息素感受的分子机制、神经机制以及物种形成机制提供了适宜的模型。烟青虫和棉铃虫主要性信息素和次要性信息素比例不同;此外,烟青虫性信息素腺体内含有棉铃虫性腺所没有的酯类,并且其醇类化合物含量也高于棉铃虫,这些差异可能为近缘种之间的生殖隔离提供了保障(Lietal., 2017)。
2 棉铃虫感受性信息素的分子机制
昆虫感受气味化合物的过程,需要多种化学感受蛋白共同参与(图1)。气味分子大多为脂溶性化合物,气味分子进入昆虫嗅觉感器内,与对应的气味结合蛋白(odorant binding proteins, OBPs)结合,穿过昆虫血淋巴到达感器内嗅觉受体神经元(olfactory receptor neurons, ORNs)的树突膜,与相应的气味受体(odorant receptors, ORs)相互作用,从而激活嗅觉受体神经元,产生膜电位,使气味化学信号转换为神经元电信号沿神经元轴突传入脑。气味分子随后被气味降解酶(odorant degrading enzyme, ODE)降解(Leal, 2013)。
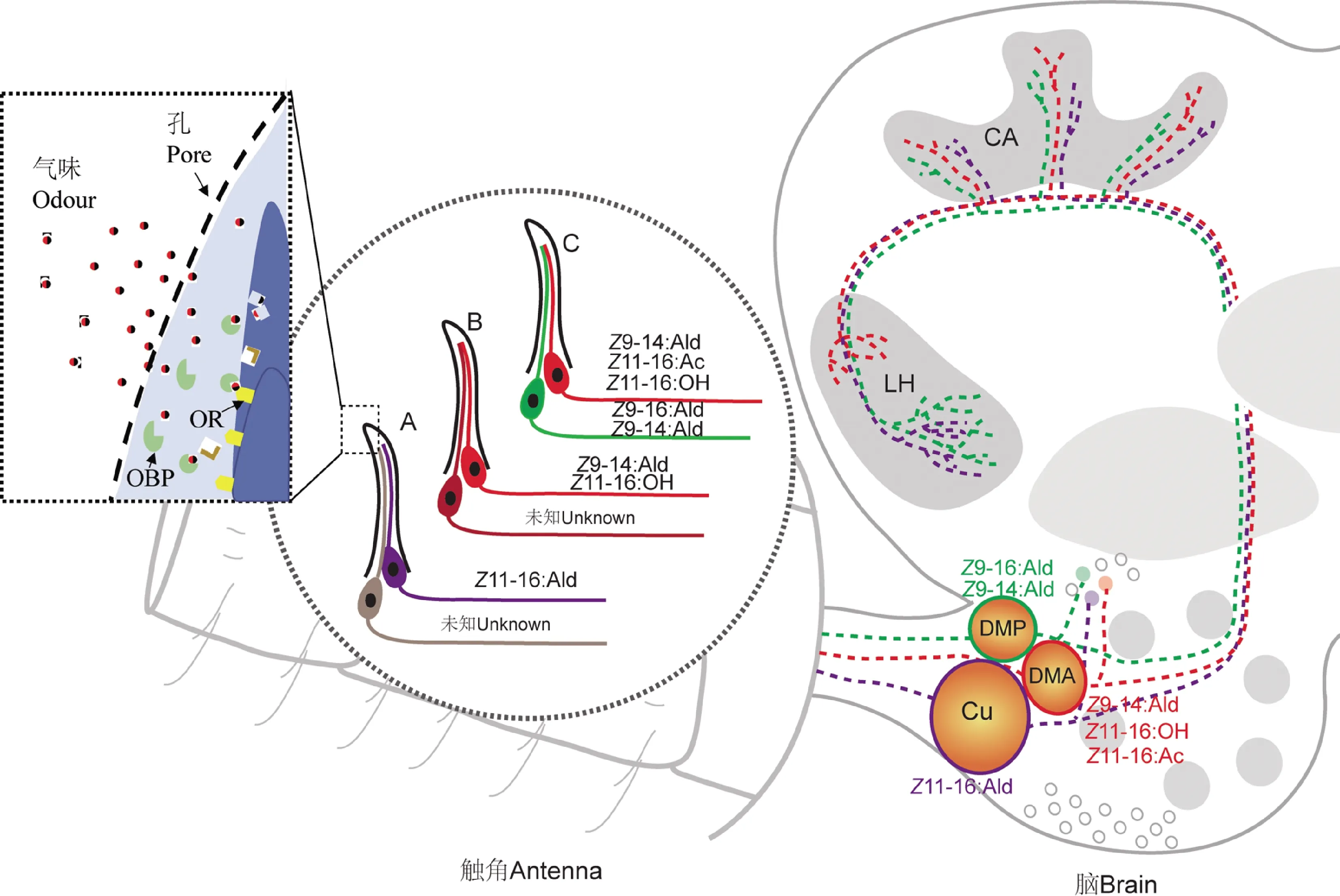
图1 棉铃虫的嗅觉系统及神经通路
目前在棉铃虫中已鉴定出3种性信息素结合蛋白(pheromone binding proteins, PBPs),分别是HarmPBP1, HarmPBP2和HarmPBP3(表1)(Wangetal., 2004; Guoetal., 2012; Liuetal., 2012; Zhang TTetal., 2012; Zhangetal., 2015)。3种PBP主要在雄蛾触角上表达。它们与近缘种的PBP的氨基酸序列一致性很高:HarmPBP1与烟青虫的PBP1(HassPBP1)和烟芽夜蛾Heliothisvirescens的PBP1(HvirPBP1)的氨基酸序列一致性分别达到75.29%和88.82%;HarmPBP2与HassPBP2和HvirPBP2的氨基酸序列一致性分别达到83.03%和96.67%;HarmPBP3与HassPBP3的氨基酸序列一致性达到97.56%。运用荧光竞争结合试验发现,HarmPBP1可以与Z11-16∶Ald和Z9-16∶Ald结合,与Z9-16∶Ald的结合力较强(Zhang TTetal., 2012; Dongetal., 2017a; Yeetal., 2017)。HarmPBP2和HarmPBP3与Z11-16∶Ald和Z9-16∶Ald的结合能力表现为弱或无,但HarmPBP3对低浓度的Z9-16∶Ald具有亲和力。这3种PBPs与Z9-14∶Ald均不结合。进一步利用RNA干扰技术研究PBP功能发现,单独对PBP1或PBP2进行干扰对雄蛾感受Z11-16∶Ald的电生理及行为反应无显著影响,而PBP1与PBP2同时沉默则会导致雄蛾对Z11-16∶Ald感受的敏感性降低,说明PBP1与PBP2都参与了主要性信息素组分的识别(Dongetal., 2017b)。而利用CRISPR-Cas9基因敲除技术敲除PBP1基因后,雄蛾对Z11-16∶Ald,Z9-16∶Ald,Z9-14∶Ald的电生理反应都会显著降低,表明了PBP1对感受雌蛾释放的性信息素混合物有重要作用(Yeetal., 2017)。HarmPBP1的3D模型模拟以及定点诱变与荧光竞争结合试验证明Phe12, Trp37和Phe119是HarmPBP1结合性信息素化合物配体的关键残基(Zhang TTetal., 2012; Dongetal., 2017a)。除PBP外,普通气味结合蛋白HarmOBP7对Z11-16∶Ald和Z9-16∶Ald也有结合作用,说明普通气味结合蛋白也可能参与性信息素的识别(Sunetal., 2013)。

表1 棉铃虫性信息素结合蛋白
通过序列分析鉴定了棉铃虫7个性信息素受体,分别为HarmOR6, HarmOR11, HarmOR13, HarmOR14(或HarmOR14a)HarmOR14b, HarmOR15和HarmOR16(表2)。其中HarmOR13, HarmOR11和HarmOR16在第一次报道中分别被称为HarmOR1, HarmOR2和HarmOR3(Zhangetal., 2010)。爪蟾卵母细胞表达系统、钙离子成像系统、CRISPR-Cas9基因敲除技术和转基因果蝇系统为研究棉铃虫性信息素受体的功能提供了有力工具(Liuetal., 2013; Jiangetal., 2014; Liuetal., 2014; Changetal., 2017; Wangetal., 2018)。研究发现,受体HarmOR13的配体是Z11-16∶Ald(Liuetal., 2013; Liuetal., 2014; Jiangetal., 2014; Changetal., 2017; Wangetal., 2018),HarmOR14b配体为Z9-14∶Ald(Jiangetal.,2014; Changetal., 2016),HarmOR16的配体是Z11-16∶OH和Z9-14∶Ald(Liuetal., 2013; Changetal., 2017; Wangetal., 2018),HarmOR6的配体是Z9-16∶Ald和Z9-14∶Ald(Liuetal., 2013),或Z9-16∶OH(Jiangetal., 2014),最近,果蝇Or67dGAL4系统证明HarmOR6的配体为Z9-16∶OH和顺-9-十四碳烯醇(cis-9-tetradecenol,Z9-14∶OH)(Wangetal., 2018)。不同的研究中,HarmOR6的配体化合物存在差异,可能与表达系统的不同和测定化合物谱的大小相关。然而,在烟青虫内,HarmOR14b直系同源体HassOR14b的配体为Z9-16∶Ald。HarmOR14b与HassOR14b仅在2个氨基酸位点F232I和T355I具有差异,说明氨基酸的单点突变可以改变受体对化合物的结合特性(Yangetal., 2017)。这也说明了此前Jiang 等(2014)和Chang等(2016)所获得的HassOR14b因3个氨基酸位点之差未能鉴定到其配体。氨基酸的点突变为理解近缘种棉铃虫和烟青虫的演化关系提供了新视角。在烟青虫中,与棉铃虫直系同源的其他受体HassOR6, HassOR13和HassOR16的配体分别为Z9-16∶OH,Z11-16∶Ald和Z9-14∶Ald(Jiangetal., 2014)。目前尚未发现受体OR11, OR14与OR15的配体。最近研究发现,OR14基因突变的棉铃虫成虫交配时间和持续时长发生变化,说明OR14参与调控棉铃虫的交配行为(Caoetal., 2020)。

表2 棉铃虫性信息素受体
3 棉铃虫的嗅觉神经系统
3.1 嗅觉外周神经系统
昆虫的嗅觉器官主要是触角,上面密布着不同类型的感器。棉铃虫触角上主要包含6种感器类型,分别为毛形感器、锥形感器、腔锥形感器、栓锥形感器、刺形感器及耳形感器,其中毛形感器数量最多,约占80%。毛形感器分为长毛和短毛2种亚型,长毛形感器长约20~30 μm,与触角表面呈50~80°,端部呈弧形或钩状;短毛形感器长约10~20 μm,多数基部弯曲(王桂荣等, 2002; Changetal., 2016)。触角电位图记录显示棉铃虫雄虫触角对雌虫性信息素有明显的电生理反应(赵新成等, 2003b)。目前,通过单感器记录(single sensillum recording, SSR)技术已鉴定出棉铃虫触角上对不同信息素成分反应的A, B和C类3种类型的毛形感器(图1)。A类型毛形感器感受主要性信息素成分Z11-16∶Ald; B类型毛形感器感受Z9-14∶Ald; C类型毛形感器感受Z9-16∶Ald和Z9-14∶Ald,Z11-16∶OH和Z11-16∶Ac(Changetal., 2016)。其中,B类型毛形感器可分为2种亚型,B1亚型能感知Z9-14∶Ald,B2亚型能感知Z9-14∶Ald和Z11-16∶OH;C类型毛形感器可分为3种亚型,C1亚型感受Z9-14∶Ald,Z9-16∶Ald,Z11-16∶OH和Z11-16∶Ac, C2亚型感受Z9-14∶Ald,Z11-16∶OH和Z9-16∶Ald, C3亚型感受Z9-14∶Ald和Z9-16∶Ald(Xuetal., 2016)。各类感器亚型的存在可能是物种形成过程中化学感觉适应的一种现象(Xuetal., 2016)。棉铃虫雄性的A类型毛形感器数量最多,B类型的数量次之,C类型毛形感器数量最少;而烟青虫雄性的A和C类型感器数量与棉铃虫的正好相反(Wuetal., 2013, 2015; Xuetal., 2017)。棉铃虫和烟青虫的种间杂交实验表明,棉铃虫的A类型与C类型感器数量比例在杂交后代中呈显性(Zhaoetal., 2006; Xuetal., 2017)。双色原位杂交技术研究发现棉铃虫雄蛾触角A, B和C类型毛形感器内均含有2个ORNs,A类型毛型感器内的2个ORNs分别表达OR11与OR13,B类型毛型感器内分别表达OR15和OR14b,C类型毛型感器内分别表达OR6和OR16(Changetal., 2016)。同时,在该项研究中Chang等(2016)还发现烟青虫表达OR6和OR16的2个ORNs共同位于同一个C类型感器内,与棉铃虫的相似。然而,Yang等(2017)开展的共定位研究发现C类型毛形感器内2个ORNs分别表达OR6和OR14b或者分别表达OR16和OR14b。表达OR6和OR16的2个ORNs总是位于不同感器中,而不在同一感器内。类似于受体HassOR14b功能的研究,两项研究的结果不同,原因或许是作者使用的聚合酶和表达载体不同(Yangetal., 2017)。关于棉铃虫和烟青虫受体OR6, OR16及OR14b在ORN的定位上的差异仍需要进一步研究和验证。
3.2 棉铃虫嗅觉中枢神经系统
触角叶(antennal lobe, AL)为昆虫脑内第一个整合和处理嗅觉信息的神经中枢,具有气味识别、处理、整合和学习的功能(Hansson and Stensmyr, 2011)。棉铃虫触角叶呈半球状,成对,位于中脑,食道咽喉两侧,通过触角神经束与外周2触角连接。荧光染色标记证明棉铃虫触角叶由4类神经元构成,即嗅觉受体神经元(ORN)、局域中间神经元(local interneuron, LN)、投射神经元(projection neuron, PN)和远心神经元(centrifugal neuron, CN)(Zhaoetal., 2016a)。这4类神经元通过突触联系,形成许多球状神经纤维网,称为触角叶神经纤维球(Zhaoetal., 2016a)。棉铃虫每个触角叶内约有80个神经纤维球。纤维球形态和位置具有明显雌雄二型性(Zhaoetal., 2016b)。棉铃虫雄虫触角叶具有3个特异的神经纤维球,位于触角神经进入脑的入口处,分别为云状体(cumulus, Cu)、背中间前侧纤维球(anterior dorsomedial glomerulus, DMA)和背中间后侧纤维球(posterior dorsomedial glomerulus, DMP),其体积分别为222.47×103, 45.1×103和46.54×103μm3,合称为扩大型纤维球复合体(macroglomerular complex, MGC)(Zhaoetal., 2016a, 2016b)。
通过钙离子成像技术研究表明,棉铃虫神经纤维球Cu感受性信息素Z11-16∶Ald,DMP感受Z9-16∶Ald,DMA感受Z9-14∶Ald,Z11-16∶OH和Z11-16∶Ac(Wuetal., 2013, 2015; Xuetal., 2016)。这说明棉铃虫神经纤维球Cu和DMP参与性信息素引诱信息的接受和处理,而DMA参与性信息素拮抗剂的接受和处理。最近我们采用单感器记录和荧光染色标记相结合的技术成功地记录和染色标记了对Z11-16∶Ald反应的受体神经元,结果显示其轴突末端投射到神经纤维球Cu(马百伟等,2020)。
神经纤维球接受和处理的气味化合物的信息将通过投射神经元投射到脑的高级中枢蕈形体冠(mushroom body calyx, CA)和侧角(lateral horn, LH),产生行为指令调控棉铃虫的行为反应。到目前,关于棉铃虫的嗅觉脑高级中枢对性信息素的反应尚未见有报道。
4 小结与展望
综上所述,目前,已在棉铃虫雄虫触角上明确了感受性信息素腺体活性成分的感器,鉴定了感器内气味结合蛋白和受体等感受性信息素的功能;在中枢神经水平上,已利用钙离子成像技术鉴定了接受和处理不同性信息素腺体活性成分的触角叶神经纤维球。这些研究成果为深入了解棉铃虫对性信息素的编码机制奠定了重要基础。在此基础之上,以下几个方面值得深入研究。首先,一些棉铃虫性信息素受体的功能和定位尚未明确,需要进一步鉴定。其次,棉铃虫性信息素单个组分活性低或无,而特定比例的性信息素组分混合物具有明显的增效作用,其机制亟待研究。深入研究脑内嗅觉初级中枢和高级中枢对性信息素信息的接受、处理和整合机制将有助于揭示性信息素混合物的增效机制。再者,棉铃虫一个受体神经元可以感受多种性信息素成分刺激并呈现出不同的反应特征,具体体现在反应的频率、振幅和时间的持久度差异;不同亚型的毛形感器内受体神经元感受的气味化合物有重叠的现象,这现象是否是一种性信息素感受的保障机制且在物种分化或生殖隔离发挥更重要的作用?这一问题需要进一步研究。还有,棉铃虫性信息素感受受到寄主植物、光周期、温度、湿度等环境因素的影响,环境因子对棉铃虫性信息素感受的影响及其分子和神经机制也是重要的研究内容。最后,在明确棉铃虫嗅觉信息处理的神经及生理基础上,以环保绿色的化学生态学手段防控害虫,将科研工作与实际农业生产相结合也是重要的研究目标。
