拟黄花乌头中生物碱的杀虫活性研究
2020-11-11范丹丽杨玲玲曾东强唐文伟
范丹丽,杨玲玲,曾东强,唐文伟
(广西大学农学院,广西农业环境与农产品安全重点实验室,南宁 530005)
拟黄花乌头AconitumanthoroideumDC.,毛茛科Ranunculaceae乌头属Aconitum,多年生草本植物,分布于阿尔泰山脉,新疆特有植物。随着生物技术的发展,乌头属植物的药用价值被广泛研究,其天然产物的生物活性也得到了越来越全面的发掘。关于乌头属的生物活性报道其主要作用成分为二萜类生物碱(徐汉虹, 2004;杨丽华, 2016;尹田鹏, 2016),其在临床医学方面研究较多,谢艳芳从制黄草乌中分离得到具有抗人卵巢腺癌细胞SK-OV-3、人肺癌细胞A549、人宫颈癌细胞Hela活性的化合物(谢艳芳, 2015),蒋莹从毛果吉林乌头中分离得到9个二菇生物碱化合物,其中Delcosine(1),Tuguaconitine(2),Denudatine(3)对大肠杆菌和金黄色葡萄球菌具有一定的抑制作用,Delcosine(1),Tuguaconitine(2),Lepenine(5),11 a-hydroxy lepenine(6),JiYuan-Aconitine(7)具有抗人前列腺癌细胞PC-3的作用(蒋莹, 2010),海力马依·海米提等从乌头属植物中分离得到对人宫颈癌细胞Hela细胞、人肺腺癌细胞A549细胞株具有细胞毒活性的生物碱(海力马依·海米提, 2016)。乌头属植物在农业上的生物活性也有一些研究,顾地周等人发现高山乌头、北乌头、黄花乌头长白山3种乌头属植物的水蒸气蒸馏液对大豆荚螟、大螟、玉米螟有触杀活性(顾地周, 2011),陈琳在展毛大渡乌头和毛序准喝尔乌头中发现aconitine、pubescensine、3-deoxyaconitine和chasmanthinine (EC50≤ 0.07 mg/cm)对甜菜夜蛾幼虫有显著拒食作用(陈琳, 2017)。拟黄花乌头天然产物成分近年来研究较多,张吉发从拟黄花乌头中共分离鉴定了22个二萜生物碱,发现化合物Nominine对MPP+诱导的SH-SY5Y慢性损伤细胞有较弱保护性(张吉发, 2018),但鲜见拟黄花乌头在农业领域的生物活性报道。
本研究发现拟黄花乌头的甲醇粗提物对褐飞虱、白背飞虱具有显著的触杀活性,为明确其触杀活性成分,基于活性跟踪对其进行天然产物分离,以期为开发拟黄花乌头提供基础数据。
1 材料与方法
1.1 试验材料
1.1.1供试植物
拟黄花乌头AconitumanthoroideumDC.,全草,2006年采自新疆石河子,由广西林业勘察设计研究院钟业聪研究员鉴定。
1.1.2供试昆虫
褐飞虱NilaparvatalugensStål:从田间采集褐飞虱成虫或若虫400头,放在网室中用分孽期至孕穗期的TN1水稻品种饲养1~2代,待其种群繁殖到足够的数量时,用长翅成虫作为供试昆虫。
白背飞虱SogatellafurciferaHorvath:从田间采集白背飞虱成虫或若虫400头,饲养方法同褐飞虱,用长翅成虫作为供试昆虫。
Tn5B1-4(Trichoplusiani)为粉纹夜蛾卵巢细胞,引自华中师范大学,由华南农业大学天然农药与化学生物学教育部重点实验室传代培养。培养温度为27±1℃,无需CO2,在单层细胞生长至铺满整个瓶底时,用吸管轻轻吹打成细胞悬液,以1 ∶3的比例传代培养。培养基为Grace’s昆虫细胞培养基,加适量酵母提取物、水解乳蛋白,用超纯水溶解。完全培养基按9%的比例加入新生牛血清即可。
1.2 试验方法
1.2.1植物粗提物的提取
采用冷浸法提取,将采集的植物材料放在室内通风处阴干,再在50℃的恒温鼓风干燥箱内充分干燥,用植物粉碎机粉碎。将材料干粉(2.0 kg)装入大型溶剂桶内(10 kg),加入甲醇,溶剂比为5 ∶1(v/m),期间间断摇晃溶剂桶,每次提取72 h,重复提取3次,合并滤液用大型浓缩仪减压浓缩,得到甲醇粗提物(30 g),置于冰箱中备用。
1.2.2植物材料生物活性成分的分离
以活性跟踪为基础,确定活性部位,综合应用硅胶柱层析、MCI柱层析、Sephadex LH-20、HPLC制备等方法对甲醇粗提物分离纯化,得到化合物。
1.2.3结构鉴定
核磁共振谱(NMR)测定:以氘代试剂为溶剂,四甲基硅烷(TMS)为内标,测定1H NMR、13C NMR和必要的2D NMR;质谱(MS)测定:采取EI源、ESI源测定。根据MS图谱分析判断出化合物的分子量,由核磁共振谱推测C、H原子数及相关基团,结合二者的情况推测出化合物的结构,然后通过比对文献,鉴定出化合物的结构,并进行波谱数据的归属。
1.2.4生物活性测定
1.2.4.1 褐飞虱的生物活性测定
采用毛细管微量点滴法。先用丙酮或甲醇将植物甲醇粗提物或化合物溶解,再用丙酮配成所需浓度的药液。从网室中采回2~5日龄的褐飞虱长翅成虫,雌雄虫分开采集和测定,用CO2气体麻醉后,用毛细管将0.09239 μL或0.1164 μL药液(对照用相应溶剂)点滴在虫体的前胸背板上。每种药剂共点滴90头虫左右,重复3次。处理过的试虫待苏醒后放入自制的养虫笼中,每个养虫笼放虫约30头。养虫笼是用聚酯薄膜制成的高14 cm、直径7 cm的圆筒,圆筒下部用海绵塞堵住,上部用纱布封口,笼中放2支TN1稻茎,稻茎穿过海绵塞剪口浸入罐头瓶的水中。将养虫笼连同盛水的罐头瓶放进温度25±1℃,相对湿度75%~85%,每日光照16 h的光照培养箱中,分别于24 h、48 h检查死虫数。计算死亡率(Fujieetal., 1987;Yechengetal., 2005;Wenweietal., 2009)。校正死亡率按公式:校正死亡率(%)=(处理组死亡率-对照组死亡率)/(1-对照组死亡率)×100。
1.2.4.2化合物的细胞毒性测定
药液配制:用少量丙酮或二甲基亚砜(DMSO)将供试化合物溶解后配成母液,在超净工作台上以0.22 μm的微孔滤膜过滤除菌,并用含1% DMSO的培养基分别将药剂配成试验所需浓度,丙酮最终浓度为2.5%,DMSO最终浓度为1%。以含1% DMSO或2.5%丙酮的培养基为对照。
MTT(methylthiazoletrazolium)溶液配制:称取50.0 mg MTT,加入10 mL三蒸水培养基,待完全溶解后过滤,此时MTT溶液的浓度为5 mg/mL,置于4℃冰箱中备用。
测试方法为MTT法(Fickovaetal., 2008;Zhangli, 2008):取对数生长期的SL细胞接种于96孔培养板内,每孔加入100 μL,培养24 h,将培养板翻转倒出培养液,每孔加入100 μL相应浓度的药液,继续培养20 h、44 h,即测定前4 h加入MTT母液10 μL并轻微震荡,放入27℃继续培养4 h后倒出培养液,每孔加入100 μL DMSO用酶标仪进行检测490 nm的吸光值,整个过程需避光。以对照的细胞相对活力为100%,将各组吸光值按以下公式换算为细胞相对活力。细胞活力小于100%表示药剂降低了细胞活力,反之则表明药剂对细胞活力影响不大。细胞活力(%)=凋零后受试组OD490/凋零后对照组OD490×100,细胞抑制率(%)=(1-细胞活力)×100。
1.2.5数据分析
本文中,生物活性测定结果的平均数据均以“平均数±标准误(SE)”表示,采用DPS 7.05软件计算死亡率、毒力回归方程、LD50及其95%置信区间。方差分析采用邓肯氏极差多重比较法(Duncan’s Multiple Ranger Test, DMRT)。
2 结果与分析
2.1 植物提取物的生物活性
植物材料(2.0 kg)经烘干、粉碎后,用甲醇采用冷浸法提取,浓缩得到甲醇粗提物(30.0 g)。甲醇粗提物用2%HCl水溶解,过滤,过滤后固体物加蒸馏水洗至pH值为7.0,然后过滤,60℃烘干,为非生物碱部分;酸水层加氨水调节pH值为9.0,CHCl3萃取,萃取液Na2SO4干燥后浓缩,为生物总碱部分。
测定了拟黄花乌头的非生物碱和生物总碱部分对白背飞虱、褐飞虱的触杀活性。非生物碱部分和生物碱部分,分别以5 μg/头(毛细管0.1164 μL)的剂量测定了其对褐飞虱和白背飞虱长翅型雌虫48 h的触杀活性,结果见表1。结果表明,拟黄花乌头中对褐飞虱和白背飞虱具有触杀活性的主要成分分布于总生物碱部分。
进一步测定了拟黄花乌头生物总碱对褐飞虱和白背飞虱长翅型成虫48 h的触杀毒力,结果见表2。

表1 拟黄花乌头粗提物(5 μg/头)对褐飞虱和白背飞虱长翅型成虫48 h的触杀活性

表2 拟黄花乌头生物总碱对褐飞虱和白背飞虱长翅型成虫48 h的触杀毒力
拟黄花乌头生物总碱部分对两种稻飞虱均具有一定的触杀活性,其对褐飞虱和白背飞虱的48 h触杀毒力LD50值分别为1.29 μg/头、0.95 μg/头(表2)。
2.2 拟黄花乌头中生物活性成分的分离
拟黄花乌头中生物活性成分的分离以活性追踪为基础,综合应用硅胶柱层析、ODS、Sephadex LH-20等方法对拟黄花乌头生物总碱部分进行分离纯化,从中分离鉴定了4个化合物,分别为4-hydroxynicotinic acid methyl ester(1),Ranaconitine(2)、Lappaconitine(3)、13-hydroxylappaconitine (4)。
化合物1为无色针状结晶,溶于甲醇、丙酮,难溶于氯仿。
根据化合物1的EIMSm/z153 [M]+准分子离子峰,结合13C NMR和DEPT谱,可判断其分子式为C7H7NO3。综合化合物1的1H NMR、13C NMR和DEPT谱示有一个间位取代的质子(δH8.43, d,J=3.0 Hz, H-6)、两个邻位取代的质子(δH7.95, dd,J=9.6, 2.4 Hz, H-2)、(δH6.51, d,J=9.0 Hz, H-3),一个羰基碳(δC167.1, C-7)、一个与羟基相连的碳(δC165.3, C-4),一个甲氧基(δH3.60, s, 3H,δC38.5)。结合HSQC、HMBC归属了化合物1的1H、13C关系,其波谱数据归属如下:
1H NMR (600MHz, CD3OD):δ8.43 (1H, d,J=3.0 Hz, H-6), 7.95 (1H, dd,J=9.6, 2.4 Hz, H-2), 6.51 (1H, d,J=9.0 Hz, H-3), 3.60 (3H, s, OMe);
13C NMR (150MHz, CD3OD):δ167.1 (C-7), 165.3 (C-4), 145.7 (C-6), 141.0 (C-2), 119.3 (C-3), 112.3 (C-5), 38.5 (OMe)。
上述数据根据1H NMR、13C NMR、HSQC、HMBC进行归属,经鉴定化合物1为4-hydroxynicotinic acid methyl ester。该化合物在文献上首次出现为化学合成中间产物(Kitagawa, 1978),其后的文献报道也都为合成中间体或终产物(Bernofsky, 1979; Maquestiauetal., 1988)。该化合物为首次从天然产物中分离得到并对其进行波谱数据归属,其分子式为C7H7NO3,化学结构图如图1中化合物1所示。
Ranaconitine (2):无色针状结晶;ESI-MS m/z 600[M]+;波谱数据与文献中Ranaconitine相同(Pelletieretal., 1978;Ayhanetal., 1996;Tanetal., 2006);Lappaconitine (3):无色针状结晶;ESI-MS m/z 584[M]+;波谱数据与文献中Lappaconitine相同(Manzooretal., 2008;Nikolayetal., 2008);13-hydroxylappaconitine (4):无色无定形粉末;ESI-MS m/z 600[M]+;波谱数据与文献中13-hydroxylappaconitine相同(Manzooretal., 2008)。

图1 拟黄花乌头甲醇层分离得到的化合物Fig.1 Structures of compounds 1 to 4 isolated from Aconitum anthoroideum
2.3 化合物对褐飞虱和白背飞虱的毒杀活性
用毛细管微量点滴法,测定了化合物4-hydroxynicotinic acid methyl ester (1),Ranaconitine (2)、Lappaconitine (3)、13-hydroxylappaconitine (4),对褐飞虱,白背飞虱长翅型雌成虫处理48 h后的触杀毒力,结果见表3。
4个化合物在处理48 h后对褐飞虱和白背飞虱长翅型雌成虫均具有触杀活性,其中Ranaconitine的杀虫活性最强,对褐飞虱和白背飞虱点滴处理后48 h的LD50值分别为0.26 μg/头、0.25 μg/头(表3)。
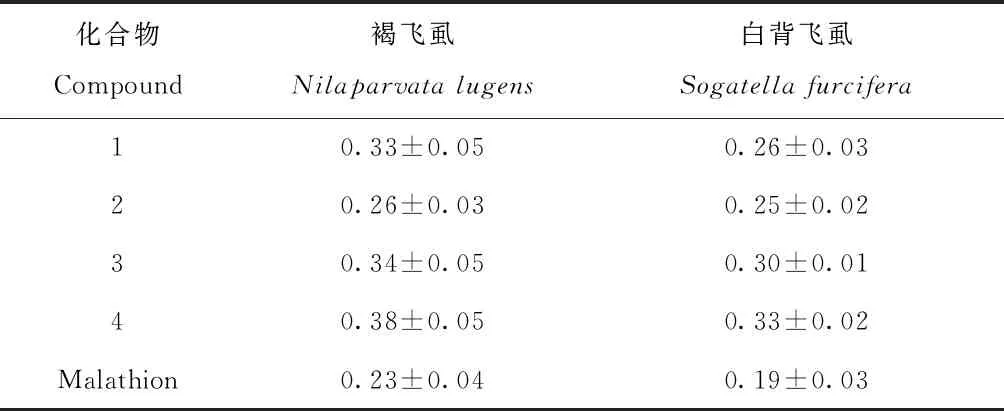
表3 供试化合物对褐飞虱和白背飞虱长翅型雌成虫48 h的触杀毒力
2.4 化合物的细胞毒性
在100 μg/mL、50 μg/mL的浓度下测定了化合物Ranaconitine (2)对粉纹夜蛾卵巢细胞(Tn5B1-4) 24 h的细胞毒性,结果见表4。
由表4可以看出,在50 μg/mL、100 μg/mL浓度下,化合物Ranaconitine 对Tn5B1-4细胞的细胞毒性均较弱,校正死亡率均在50%以下。

表4 供试化合物对Tn5B1-4细胞的毒性
2.5 Ranaconitine对Tn5B1-4细胞膜通透性影响
在测定Ranaconitine对Tn5B1-4细胞的细胞毒性时,通过显微镜观察发现,经化合物Ranaconitine处理的细胞的细胞膜有明显的孔洞,为进一步明确其对Tn5B1-4细胞膜的影响,以FITC法检测了化合物Ranaconitine在50 mg/mL浓度下对Tn5B1-4细胞膜的通透性影响,结果见表5和图2。
从表5可以看出,处理48 h后,Ranaconitine的FITC的荧光强度值为6.32,荧光强度增加率为1.44%,低于印楝素A。从图2可以看出,Ranaconitine处理后有一定的影响,但作用远低于印楝素。

表5 Ranaconitine对Tn5B1-4细胞膜通透性影响(48 h)

图2 Ranaconitine对Tn5B1-4细胞膜通透性影响(48 h)Fig.2 Effect of the membrane permeability of Ranaconitine to Tn5B1-4
3 结论与讨论
在前期试验活性测定结果的基础上,综合应用硅胶柱层析、ODS、Sephadex LH-20等方法对拟黄花乌头中对褐飞虱和白背飞虱具有杀虫活性的化学成分进行分离纯化,从中分离得到了4个化合物,4-hydroxynicotinic acid methyl ester(1)、Ranaconitine(2)、 Lappaconitine(3)、 13-hydroxylappaconitine(4),关于活性有研究报道Lappaconitine有清除自由基,镇痛,抗心律失常,抗炎作用(Niuetal., 2018; Sunetal., 2018),从异叶乌头AconitumheterophyllumWall.中分离得到的13-hydroxylappaconitine对金黄色葡萄球菌StaphylococcusaureusRosenbach.有抑菌作用,Lappaconitine对铜绿假单胞杆菌PseudomonasaeruginosaSchr9ter. 和伤寒沙门氏杆菌Salmonellatyphi有抑菌作用(周利娟等,2017),本实验分离得到的4个化合物均具有杀虫活性,其中化合物Ranaconitine (2)对稻飞虱的触杀活性最为显著。从现有研究结果来看,从拟黄花乌头中分离得到的成分以二萜生物碱为主,有研究表明半枝莲中二萜生物碱Scutegxbatine F,Scutebate F,Scutebarbatine F,Scutebarbatine Y具有逆转肿瘤多药耐药性(李丹丹,2018),从紫花高乌头中分离得到的Lappaconitine(1)、Ranaconitine (2)、septentriodine (3)、6-demethyldelsodine (4)、6-methylumbrofine (5)、8-methyl-10-hydroxylycoctonine (6)和8-methyllycoctonine (7)对慢性支气管炎有一定的治疗效果(王艳等,2019)。本研究中分离鉴定的Ranaconitine对稻飞虱有好的触杀活性,在杀虫谱上是否具有拓展潜力有待进一步研究。本研究首次对拟黄花乌头的化学成分展开研究,因为采集到的植物材料量少的原因,分离和活性测定研究并不完全,是否还有其他对稻飞虱有活性的成分或者对其他生物有活性的化学成分有待进一步研究。
