IVIM预测乳腺肿块良恶性及乳腺癌免疫组化指标价值
2020-11-11赵晓艳
赵晓艳
(许昌学院医学院,河南 许昌 461000)
乳腺癌作为临床常见的妇科肿瘤,有研究[1]报道指出,其发病率占全身各种恶性肿瘤的7%~10%,仅次于子宫癌。其发病常与遗传、年龄有关,40~60岁绝经期前后的妇女发病率较高。我国每年新发乳腺癌病例超过150万,死亡人数超过75万,对于早中期乳腺癌患者而言,手术切除为其提供了治愈机会,显著提高患者生存期[2-3],因此,对乳腺肿块的良恶性早期诊断具有重要意义。目前,临床对于乳腺癌的诊断多采用钼靶及MRI,特异度、灵敏度均较低,但诊断价值有限。动态增强MRI虽能检测患者血流动力学参数,但其获得的指标无法排除微循环灌注效应,应用受限[4-6]。随着影像学技术的不断发展,体素内不相干运动(intravoxel incoherent motion,IVIM)逐渐开始在临床应用。作为一种在磁共振扩散加权成像(DWI)技术发展的基础上建立的检测模型,可分离患者病灶部位组织灌注及扩散效应,对微细结构的反应效果更佳,而在乳腺肿块患者中,良性及恶性肿瘤病灶部位微循环灌注及扩散效应往往具有明显区别。因此,笔者推测,IVIM对其良恶性的诊断应具有较大价值[7]。同时,对确诊的乳腺癌患者,免疫组化指标往往是评估患者预后及制订治疗方案的重要依据。但目前对于IVIM预测乳腺肿块良恶性及乳腺癌免疫组化指标的相关报道较少,临床应用缺乏理论支持。本研究对96例乳腺肿块患者进行研究,旨在为IVIM在乳腺癌患者中的应用提供临床依据,报道如下。
1 对象与方法
1.1 对象 选取2017年1月—2018年12月许昌学院医学院附属医院诊治的乳腺肿块患者96例为研究对象,年龄24~63(38.42±5.44)岁。纳入标准:①经MRI等影像学检测确定有乳腺肿块者。②年龄>18岁。③于本院全程检测并资料完备者。④所有患者及其家属均自愿参加本研究并签署知情同意书。排除标准:①已进行放化疗治疗者。②合并其他部位肿瘤者。③已进行穿刺活检等有创检测者。④检测结果不清晰,影响临床评估及数据处理者。
1.2 方法
1.2.1 检测方法 所有患者均进行IVIM检测,使用钆喷酸葡胺注射液(上海旭东海普药业有限公司,国药准字H19991368,规格:20 mL:9.38 g)作为对比剂,注射完成后立即扫描。使用飞利浦Achieva 1.5 T磁共振扫描仪及乳腺专控线圈,患者取俯卧位,双侧入港自然下垂,置于线圈。经三平面矫正后,行轴面T2WI-SPAIR(参数设置:层厚4 mm、层数40、间隔0 mm、激励数1、TE 65 ms、TR 5 000 ms、FOV 32 cm×37 cm、矩阵400×382)、IVIM检测(参数设置:b=0,10,20,50,100,200,500,800 s/mm2;层厚4 mm、层数32、间隔1 mm、激励数1、TE 69 ms、TR 5 098 ms、FOV 35 cm×24 cm、矩阵140×93)。IVIM检测完成后进行病理学检测。患者肿块良恶性及免疫组化指标以穿刺活检或术后病理学检测结果作为金标准。检测结果由3名以上主治医生会诊诊断。若IVIM检测及诊断结果为阴性,病理学确诊患者肿块为恶性,则为假阴性,否则为真阴性;若检测及诊断结果为阳性,病理学确诊患者肿块为良性,则为假阳性,否则为真阳性。诊断效能使用ROC曲线评价。敏感度=真阳性例数/(真阳性例数+假阴性例数)×100%,反映诊断患者的能力;特异度=真阴性例数/(真阴性例数+假阳性例数)×100%。
1.2.2 观察指标 ①乳腺肿块良性与恶性病变患者IVIM序列参数慢扩散系数(D)值、快扩散系数(D*)值和灌注分数(f)值。②D值、D*值、f值以及表观扩散系数(ADC)值对鉴别乳腺良恶性病变效能指标(敏感度和特异度)比较。③比较雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)、人类表皮生长因子受体2(human epidermal growth factor receptor-2,HER-2)和细胞增殖抗原标记物Ki-67 (antigen identifed by monoclonal antibody Ki-67,Ki-67)阳性表达与阴性患者的D值、D*值、f值之间的差异。
1.2.3 数据处理 结合患者增强CT扫描结果,选取病灶高信号区最均匀处手动勾画感兴趣区(ROI),使用飞利浦DWI-tool软件对IVIM各参数进行梳理,获取D、f及D*值。所有数据均检测3次,取平均值。
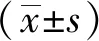
2 结果
2.1 良性与恶性病变患者IVIM各指标水平比较 乳腺肿块恶性病变患者D低于良性者,f高于良性者,差异均有统计学意义(P<0.001),2组D*值差异无统计学意义(P>0.05)。见表1。
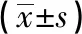
表1 良性与恶性病变患者IVIM各指标水平比较
2.2 IVIM各参数鉴别乳腺良恶性病变效能比较 绘制ROC曲线,结果显示,D、D*、f及ADC指标中,D值诊断效能较高。见表2、图1。

表2 IVIM各参数鉴别乳腺良恶性病变的诊断效能

图1 IVIM各参数鉴别乳腺良恶性病变效能ROC曲线
2.3 不同免疫组化表达患者IVIM各指标水平比较 ER、PR不同表达下,IVIM各指标水平差异无统计学意义(P>0.05);HER-2阳性者D、D*显著高于阴性表达,差异有统计学意义(P<0.05),f值差异无统计学意义(P>0.05);Ki-67不同表达者D*、f值差异无统计学意义(P>0.05),Ki-67高表达者D值显著低于低表达者,差异有统计学意义(P<0.05)。见表3。
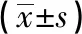
表3 不同免疫组化表达患者IVIM各指标水平比较
3 讨论
乳腺癌的病因尚未完全清楚,患者由于病灶处细胞密度上升,间隙减小,水分子扩散减弱,同时其乳腺微血管密度增加,灌注效应上升,扩散现象减弱,DWI则是一种观察组织水分子微观运动的无创影像学检查[8]。但在患者体内,由于肿瘤组织微血管的无规则分布及水分子的无规律运动,DWI参数无法对水分子扩散及组织灌注两个方面进行区分,导致其价值受限[9]。而在DWI成像基础上发展而来的IVIM技术是一种活体组织水分在运动检测成像方式,能将患者水分子弥散及组织微血管灌注参数分离,独立显示患者机体水分子扩散及组织灌注效应,而在良性乳腺肿块患者中,其水分子灌注及扩散效应与恶性肿瘤患者往往具有较大区别[10]。本研究结果显示,恶性病变患者D低于良性者,f高于良性者,提示乳腺肿块的良恶性对IVIM检测中D、f值具有影响。笔者猜测,通过D值反映出单独的分值扩散程度,使用f及D*值反映患者微血管灌注情况,在乳腺肿块患者中,若其D值明显降低,f值明显升高,则其恶性病变概率较高,使用IVIM检测能有效提高患者诊断准确率。本研究结果还显示,D、D*、f及ADC 4个指标中,D值诊断效能较高,可作为临床诊断乳腺肿块良恶性鉴别的独立指标。
此外,乳腺癌患者的免疫组化检测结果是对其治疗指导及预后评估的重要指标[11-12],传统穿刺活检或术后病理学检测时间往往较长,笔者认为,若能在最短时间内预测患者免疫组化结果对患者早期的针对性治疗具有重要意义。ER和PR在乳腺癌发生发展中具有重要作用,ER具有抗血管生成,抑制肿瘤生长作用,PR则能调控患者机体血管新生因子水平[13],两者互相作用,可降低患者病灶处微血管灌注。本研究结果显示,ER、PR不同表达下,IVIM各指标水平差异无统计学意义(P>0.05)。但也可看出,在ER与 PR阳性患者中,其D、D*值略低于阴性患者,可能是由于此两者的表达对患者微循环影响较小导致。Ki-67级HER-2是促进肿瘤发展的重要因子,在本研究中可观察到,Ki-67高表达者D值显著低于低表达者。笔者分析,Ki-67是一种核蛋白质由MKI-67基因编码,又称之为MKI-67,提示细胞的增殖活跃程度。Ki-67指数作为一种细胞增殖周期中生成的核抗原,其水平与肿瘤细胞的增殖程度呈正相关,此外,随着Ki-67水平上升,患者肿瘤细胞血管化程度上升,引起其微血管灌注增加[14]。HER-2是重要的乳腺癌预后判断因子,HER-2阳性(过表达或扩增)的乳腺癌, HER-2基因,即c-erbB-2基因,定位于染色体17q12-21.32上,编码相对分子质量为185 000的跨膜受体样蛋白,具有酪氨酸激酶活性,其临床特点和生物学行为有特殊表现,治疗模式也与其他类型的乳腺癌有很大区别。HER-2的过表达可促进患者新生血管生成,增强其肿瘤侵袭、转移能力[15-16],在本次研究中,HER-2阳性者D、D*显著高于阴性表达者,笔者分析,HER-2阳性表达,促进患者新生血管生成,引起其微血管密度上升,进一步引起D、D*值的改变。 本研究不足:①就目前而言,b值选取尚无统一标准,本研究b值选取范围及精度还可进一步完善。②在纳入患者时未对其年龄及月经周期纳入考量范围,可能对结果造成影响,以上不足,有待进一步研究完善。
综上所述,IVIM预测乳腺肿块良恶性及乳腺癌免疫组化指标具有较高准确度,其参数水平与乳腺癌患者HER-2及Ki-67的表达有密切联系,对患者早期的治疗方案制订及预后评估具有重要价值,IVIM用于预测乳腺肿块良恶性及乳腺癌免疫组化指标具有临床价值。但本研究选取样本较少,且全为该院患者,可能对本研究可信度造成一定影响,此结论有待多中心、大样本实验证实。
