干细胞移植对帕金森病大鼠的旋转行为和肿瘤坏死因子α及白细胞介素-4的影响
2020-11-11樊志刚师瑞红
樊志刚, 高 丽, 师瑞红
(河南医学高等专科学校生理学教研室,郑州 451191)
帕金森病(Parkinson’s disease,PD)是一种常见的中枢神经系统退行性疾病,病因尚未明确,可能与包括遗传在内的多种因素有关[1],其病理特征为黑质致密部的色素脱失和多巴胺(DA)神经元的大量丧失及路易小体的出现,好发于中老年人,平均始发年龄为57岁,大于60岁的患病率1%~2%[2]。目前PD治疗仍以左旋多巴为代表的药物治疗为主,药物治疗只能暂时缓解临床症状,不能从根本上替代黑质DA能神经元的变性缺失。
目前,细胞治疗成为了一个新的方向,PD的细胞治疗主要是将各种DA能细胞移植入纹状体[3-5]。多年来人们尝试各种细胞作为种子细胞进行研究,脐血又称胎盘血或脐带血,是胎儿出生时脐带内和胎盘近胎儿一侧血管内的血液。脐血中含有丰富的造血干细胞和间充质干细胞[6](mesenchymal stem cells,MSCs),但干细胞分化为DA能神经元比率较低,体内存活能力较差,与其所处局部微环境密切相关。研究[7]发现,干细胞与宿主损伤组织间的相互作用可导致一些炎症因子的表达变化,这些炎症介质在功能恢复方面起着重要作用。本次实验将在体外培养的人脐血来源间充质干细胞(humanumbilical cord blood-derived mesenchymal stem cell,HUMSCs)立体定向注射到PD大鼠脑室内,观察移植后对PD大鼠旋转行为和炎症因子的影响,旨在为进一步的实验和临床移植途径提供更多选择,报道如下。
1 材料与方法
1.1 材料
1.1.1 实验动物 随机对照动物实验,雄性SD大鼠20只,清洁级,体质量220~250 g用于PD造模,购自河南省实验动物中心,许可证号:2019-0003。笼中喂养,饲养过程中给予充足的饮水和饲料,实验中对动物的处置符合动物伦理学要求。
1.1.2 主要试剂和仪器 6-羟基多巴胺(H4381-100 mg)、阿扑吗啡(H4393-100 mg)购自Sigma公司(美国);脐血干细胞提纯分离试剂(天津生物制药公司);酶联免疫吸附测定试剂盒(ELISA)购自上海酶联生物科技有限公司;白细胞介素-4(IL-4)试剂盒检测范围20~400 ng·L-1,肿瘤坏死因子α(TNF-α)试剂盒检测范围80~1 000 ng·L-1;宝特Epoch酶标仪,倒置显微镜Olympus BX41购自日本Olympus公司。
1.2 方法
1.2.1 PD大鼠模型的建立 用35 g·L-1水合氯醛(350 mg·kg-1)(青岛宇龙海藻,国药准字H37022673,规格:0.5 g)腹腔注射麻醉SD大鼠后,将大鼠固定于立体定向器上,以前囟为零点,参照文献[8]的《大鼠脑立体定位图谱》,确定大鼠右侧前脑内侧束(anterior medial cerebral bundle,MFB)和腹侧被盖区(ventral tegmental area,VTA)两点坐标(MFB为前囟后4.1 mm,矢状缝右侧1.7 mm,颅骨下7.8 mm;VTA为前囟后4.5 mm,矢状缝右侧1.5 mm,颅骨下7.8 mm)。向每点用微量进样器注射新鲜配置的6-羟基多巴胺(6-Hydroxydopamine,6-OHDA)溶液5 μL。1周后腹腔注射阿扑吗啡(1.0 mg·kg-1)以诱发旋转实验,编制随机数目表,用完全随机法将20只造模成功大鼠分成实验组与对照组,各10只。
1.2.2 脐血干细胞制备 ①选择35岁以下健康产妇的产后脐带内残余血液,采集脐带血之前产妇知情同意并签署捐献同意书。每份有效脐带血量为80~160 mL。②采集好的脐带血在30 min内利用脐血干细胞提纯分离试剂进行提纯分离干细胞,将分离的细胞以5×106mL-1接种于含体积分数为20%胎牛血清(普诺赛,批号164210,规格:100 mL)的DMEM/F12培养液中培养观察。取第4代细胞用于后续实验。
1.2.3 脐血干细胞移植 取第4代HUMSCs将调整细胞浓度调整为3.0×105μL-1,立即进行细胞移植。将PD模型大鼠麻醉后固定于立体定位器上,以前囟为零点,定位右侧纹状体2个移植点:前囟前1.1 mm,矢状缝右2.7 mm,颅骨下5.1 mm;前囟前1.3 mm,矢状缝右2.7 mm,颅骨下7.1 mm。实验组每点注射5 μL HUMSCs,对照组按上述方法和坐标,注入5 μL磷酸盐缓冲溶液(PBS)。
1.2.4 观察指标
1.2.4.1 行为学检测 移植后每周1次腹腔注射阿扑吗啡(1.0 mg·kg-1),观察PD大鼠旋转行为的改善。细胞移植后3、6、9周,每组每只大鼠腹腔注射1.0 mg·kg-1的阿扑吗啡,进行旋转测试,注射后15 min开始计数旋转圈数,并计数1 min。
1.2.4.2 ELISA法检测 脑内炎症因子水平细胞移植后3、6、9周,每组各取大鼠3只,以戊巴比妥钠麻醉后取脑,参照文献[9]实验方法使用BCA蛋白定量试剂盒进行组织蛋白定量,严格按照ELISA试剂盒说明书操作,检测TNF-α及IL-4水平。
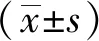
2 结果
2.1 HUMSCs分离培养 倒置显微镜下可见培养初期胞体小且呈圆形,7 d以后逐渐变为椭圆,胞体变大。见图1。14 d(第4代)后向两级伸出凸起为长梭形。见图2。
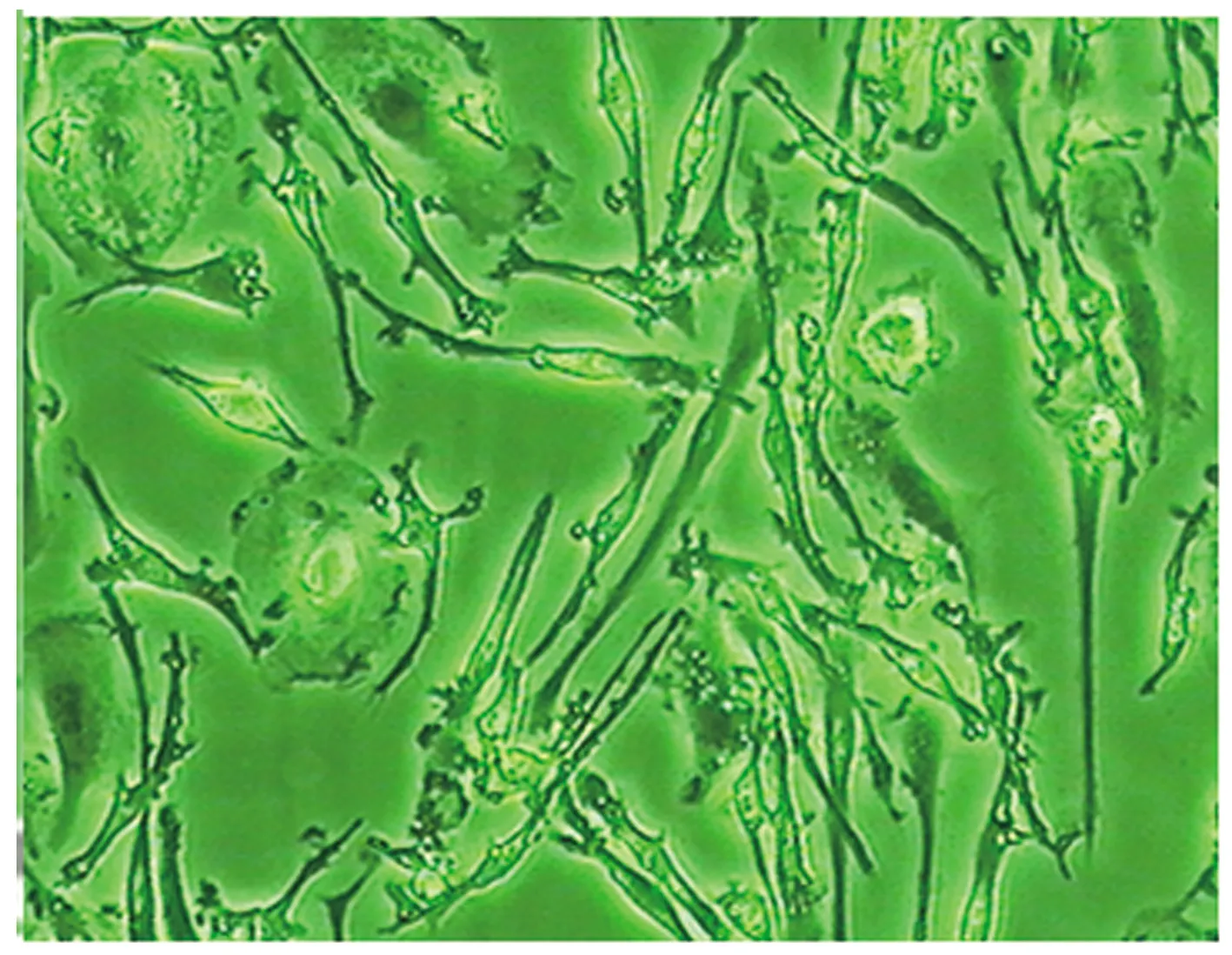
图2 14 d脐血干细胞形态(×100)
2.2 HUMSCs移植对PD大鼠旋转行为的影响 与对照组比较,移植后3周实验组PD大鼠出现旋转行为下降,差异无统计学意义(P>0.05)。与对照组比较,移植后6、9周,实验组旋转次数均出现明显减少,差异有统计学意义(P<0.05)。与移植前比较,实验组移植后6、9周,旋转次数减少,差异有统计学意义(P<0.05)。见表1。
2.3 HUMSCs移植对PD大鼠脑内TNF-α水平的影响 与对照组比较,实验组移植后3周,TNF-α水平下降不明显,差异无统计学意义(P>0.05);与对照组比较,实验组移植后6、9周,TNF-α水平明显降低,差异有统计学意义(P<0.05);与移植前比较,实验组移植后6、9周,TNF-α水平均明显下降,差异有统计学意义(P<0.05)。见表2。
2.4 HUMSCs移植对PD大鼠脑内IL-4的影响 与对照组比较,实验组移植后3周,IL-4水平升高不明显,差异无统计学意义(P>0.05);与对照组比较,实验组移植后6、9周,IL-4水平明显升高,差异有统计学意义(P<0.05);与移植前比较,实验组移植后6、9周,IL-4水平也显著升高,差异有统计学意义(P<0.05)。见表3。
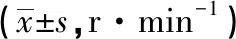
表1 移植HUMSCs前后2组PD大鼠旋转次数比较
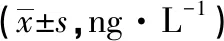
表2 移植HUMSCs前后2组TNF-α水平比较
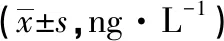
表3 移植HUMSCs前后2组IL-4水平比较
3 讨论
目前用于治疗PD的细胞主要有MSCs、胚胎干细胞及神经干细胞[10]。间充质干细胞具有较强的增殖及分化能力,不易成瘤,免疫原性低,是干细胞治疗理想的首选细胞之一[11]。HUMSCs可诱导分化为神经元、胶质细胞,并分泌脑源性神经营养因子(brain derived neurotrophic factor, BDNF)、胶质细胞源性神经营养因子(glial cell-derived neurotrophic factor,GDNF)等多种神经营养因子[12]。实验[13-14]证实,猴子纹状体内移植HUMSCs可在其脑内存活并向黒质迁移,且动物肢体力量、平衡能力增强,机械运动也无障碍。本研究结果显示,实验组在移植后6、9周大鼠旋转次数较移植前均显著下降;且均低于对照组的旋转次数,表明HUMSCs移植有利于PD大鼠运动功能的改善。
研究[15]发现,细胞因子构成的炎症免疫微环境与MSCs移植效果密切相关,细胞移植后与宿主间发生相互作用,上调或下调特定细胞因子水平,进一步影响细胞的存活、迁移及分化。TNF-α为常见促炎症因子,可激活多条信号通路,如核因子-κB(nuclear factor-kappa B,NF-κB)、p38丝裂原活化蛋白激酶(p38MAPK)、c-Jun氨基末端激酶(JNK)、Smad泛素调节因子1(Smurf 1)等信号通路,并抑制Runx2的表达,NF-κB是一种核转录因子,不仅参与细胞增殖、凋亡等生理过程,还参与炎症、免疫反应相关的基因转录过程[16-17]。NF-κB信号通路分为经典通路与非经典通路,经典通路由TNF-α、IL-6、IL-1β等炎症因子活化,非经典通路则主要是由BAFF、CD40L、LT-βR等TNF-α受体家族亚类活化。白细胞介素是一种多细胞源的细胞因子,在促进细胞生长与分化中发挥着重要作用,同时参与调节机体的免疫和炎症反应,可通过刺激巨噬细胞极化及成纤维细胞活化来促进神经纤维再生[16-17]。本实验结果显示,移植后6、9周,实验组大鼠脑内TNF-α较对照组明显减低,说明HUMSCs移植后可显著抑制TNF-α的水平,减少炎症反应对功能恢复的不利影响。相对于对照组,HUMSCs移植后6、9周,实验组大鼠脑内IL-4水平均明显升高,说明HUMSCs移植后,抗炎因子IL-4的升高抑制了促炎因子的表达,可能间接促使了大鼠旋转行为有了明显改善。
目前MSCs移植治疗PD的机制还不十分清楚,有研究[5]表明是促进内源性神经干细胞的分化;抑制神经细胞凋亡;促进血管再生,重建突触等。本实验也存在一些不足,PD主要是DA能神经元受损,在以后的实验中会检测神经递质DA的含量,用免疫组化证实DA能神经元的恢复等。
综上所述,HUMSCs移植后一定时间可以明显改善PD大鼠旋转行为,降低TNF-α水平和提高抗炎因子IL-4的水平。
