HBsAg、抗-HCV、抗-HIV 检测灰区设置范围及其必要性探讨
2020-11-11李玉熊丽红蔡县成
李玉,熊丽红,蔡县成
(1.江西省血液中心,江西 南昌 330077;2.上饶市中心血站,江西 上饶 334000)
ELISA 作为一种免疫技术,由于生物学标本中存在各种干扰实验和影响结果的因素,有部分血液标本测定的吸光度值,达不到试剂盒规定判断阳性的临界值(Cut-off)水平,特别是接近Cut-off 值的结果,很难判断其是否携带某些病原体的抗原或抗体[1],研究者将其定义为灰区。 目前国内对灰区临界值设置并无统一标准,若灰区设置范围过窄,则存在一定输血感染风险,无法确保血液安全;若范围设置过宽,则会造成不必要的血液报废,影响固定献血者队伍的建立,那么有无必要设置灰区以及灰区范围如何设置,一直是实验室讨论的焦点。 为此,本文针对酶免检测0.5≤S/CO<2.0 范围内标本进一步核酸检测,并分区段进行统计分析,具体结果报告如下。
1 材料与方法
1.1 标本来源 取本中心 2018 年 4 月 1 日-2019年6 月30 日无偿献血者血液标本86314 人份与上饶地区 2018 年 4 月 1 日-2019 年 1 月 31 日血液标本 36831 人份,进行 HBsAg、抗-HCV、抗-HIV、梅毒抗体常规酶免检测,收集S/CO 值在0.5≤S/CO<2.0 区间的试验样本,进行分段统计分析(0.5≤S/CO<0.8,0.8≤S/CO<1.0,1.0≤S/CO<2.0), 后统一进行核酸单检实验。
1.2 仪器与试剂 采用STAR 全自动加样仪 (深圳爱康),FAME 全自动酶免分析系统(澳斯邦),血液核酸检测仪器: 全自动核酸提取仪 (COBAS AmpliPrep)、全自动核酸扩增仪(COBAS TaqMan(瑞士罗氏公司)。 ELISA 检测试剂(厦门新创,北京万泰, 质控物均为康彻斯坦); 核酸检测试剂盒:COBAS TaqScreen MPX V2.0 test 核酸检测试剂盒(瑞士罗氏有限公司),所有试剂批批检合格,均在有效期内使用。
1.3 标本处理 由采血人员完成标本留取, 其中1管(带分离胶EDTA-K2 抗凝)用于核酸检测,另1管(EDTA-K2 抗凝)用于血清学检测。 所留标本置2~8℃冰箱保存, 酶免测定后 0.5≤S/CO<2.0 标本对应核酸管置于-20℃冷库保存, 便于统一进行试验。
1.4 研究方法 ⑴期间所有血液标本先进行酶免四项检测,初复检均阴性标本进行核酸六混样模式进一步确证;⑵留取乙肝、丙肝、艾滋酶免检测单试剂、双试剂结果S/CO 值在0.5~2.0 范围标本,进行核酸单检模式确证, 因NAT 实验提取的是病毒的DNA 或RNA,故梅毒项目另行采取其他方法确证。
1.5 统计学处理 应用统计软件SPSS17.0, 采用卡方检验 (chi-square test),P 小于 0.05 有统计学意义。
2 结果
2.1 2018.4.1-2019.6.30 期间根据 ELISA 检测结果,共留取 HBsAg、抗-HCV、抗-HIV 0.5≤S/CO<2.0 范围标本数各 89、89、12 人份。 其中,核酸单检试验结果显示,有反应结果数10 人份,均为HBVDNA,未检测出 HCV-RNA 和 HIV-RNA 阳性,将乙肝核酸单检结果与丙肝、艾滋单检结果比较,经卡方检验,差异有显著统计学意义(P<0.005)。 见表1。

表1 各项目S/CO 分段样本数及核酸单检阳性数
2.2 10 人份标本酶免初复检结果显示,单边0.5≤S/CO<0.8(万泰复检)共计 3 人份;0.5≤新创试剂<0.8、0.8≤万泰试剂<1.0 共计 2 人份;0.5≤新创试剂<0.8、1.0≤万泰试剂<2.0 (单边阳性) 共计 3 人份,双边试剂阳性(S/CO≥1.0)共计2 人份,分别占分段内总数百分率为16.7%、8.7%、10.4%,三区段内阳性数百分比,三者差异不明显,无统计学意义(P>0.05)。 见表2,表3。

表2 NAT 阳性样本双试剂S/CO 值及核酸检测CT 值对比
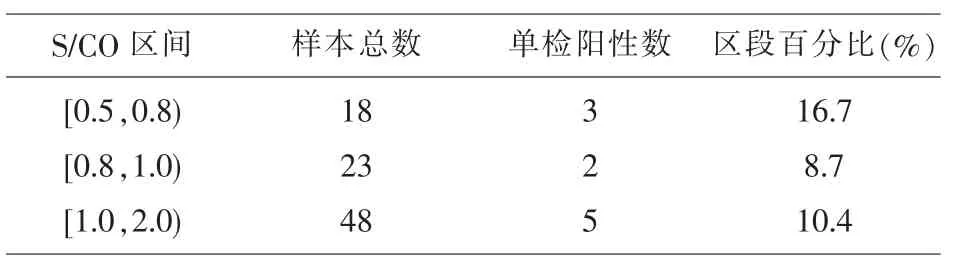
表3 HBV 各区段样本总数及NAT 单检阳性数百分比
3 讨论
ELISA 主要检测血浆中存在的传染性标志物抗原、 抗体, 但由于不同试剂盒阳性判断临界值(Cut-off)存在差异;病毒感染存在窗口期;病毒变异后表达产物含量低以及个体差异等,以及各种干扰实验和影响结果的因素,给其应用带来了一定的局限性。 血清学筛查虽已极大程度降低了经输血和血制品感染病毒的风险,但仍未完全消除,其中,最主要的风险就是血清转换窗口期的漏检[2]。 NAT检测的是病毒的DNA 或RNA,敏感性较高,可有效缩短病毒感染的窗口期检测时间, 相关研究表明,通过核酸检测可将HBV、HCV 和HIV 感染的平均“窗口期”缩短至 9、59 和 11d,此外 NAT 还可检测出因病毒变异、 隐匿性感染等原因而漏检的污染血液。 由此可降低或减少ELISA 漏检导致的输血残余风险的发生,进一步保障临床供血安全[3,4]。
本研究中,S/CO 在 0.5~1.0 区间内乙肝、丙肝、艾滋标本数分别为41、28、3 人份,由此可以看出乙肝项目灰区标本占比最多,这从侧面印证了部分血清HBsAg 呈低水平状态存在[5],极易出现弱反应性结果,当然也不排除实验过程中受各种不确定因素干扰引起的临界值样本存在;其中艾滋项目灰区标本数最少,丙肝居中。 从后续核酸单检实验数据来看, 均为 HBV 有反应性,0.5≤万泰单试剂<0.8 阳性数3 人份,双边试剂均未超过CO 值阳性标本数5 人份,占本研究总阳性数50%,说明临床用血经常规筛查后出现输血传播疾病的风险主要为HBV感染,而且最有可能就是隐匿性 HBV 感染(OBI)[6,7]。丙肝、艾滋(0.5≤S/CO<2.0)均未检出阳性,这与本站艾滋病确证实验室结果基本相符。
从核酸单检阳性的CT 数值看,循环数35 以内占 6 人份,35 以上 4 人份。 尽管 NAT 从理论上并不能完全消除感染“窗口期”,但病毒核酸转阳之前的血液传染性极低,可以有效地预防经输血传播病毒性疾病[8]。 由于灰区标本在日常标本中占比极少,且还要鉴别明显因人为操作、拖带、污染等因素导致的假性弱反应标本,收集零散样本后还需经过冷冻与复融等过程,所以完成整个检测周期需较长时间[9,10],另外病毒的核酸检测依赖于样本中的病毒颗粒数量,并可能受到样本采集方法、患者因素(例如年龄、是否存在症状)和/或感染状况等影响,建议核酸单检后做进一步的跟踪筛检确证试验,有条件情况下能尽可能多的收集符合要求样本进行相关试验,提供数据支持,以期最大限度确保试验结果的可靠性,这是后续阶段我们需要改进之处。
由本研究可见,对于血站系统而言,酶免检测设置适当的灰区范围非常必要,HBsAg 项目建议严格“灰区”设置范围,可设置为0.5~0.8 倍S/CO值,特别对于酶免检测双试剂S/CO 值大于0.5、小于1.0 可疑标本,条件允许时应进行核酸单检试验,确保血液安全;而抗-HCV、抗-HIV 在 S/CO 值 0.5~2.0 范围内NAT 单检均未有阳性检出,二者建议可不设置灰区,若设置“灰区”,则可能造成一定的血液浪费。 因此,各实验室可根据自身使用试剂情况及当地流行病学情况综合平衡考虑,制定科学合理的灰区设置范围[11-16]。
