Sec62/Sec63 复合物对乙型脑炎病毒在HEK-293 细胞中复制影响的研究
2020-11-10步志高华荣虹
王 晗,刘 靖,钟 杰,步志高,华荣虹
(中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室,黑龙江 哈尔滨 150069)
蛋白质在内质网(Endoplasmic reticulum,ER)膜中的转运是真核细胞中高度保守的生物过程,对许多跨膜蛋白和大多数分泌蛋白的生物合成至关重要,该过程可分为3 个主要步骤:将新合成的前体蛋白或新生多肽链靶向内质网膜;将蛋白质插入多肽传导通道;以及跨膜蛋白从通道向磷脂双层的横向释放或转运至内质网内。在真核细胞中,分泌蛋白的新生多肽链通过共翻译转运或者翻译后转运方式至内质网,通过Sec61 复合物进行跨膜转运[1]。在该转运过程中,另一位于内质网膜中的异二聚体复合物(Sec62/Sec63)在某些蛋白的内质网转运过程中也起着重要作用[2]。文献报道,Sec62 是位于ER 上的跨膜蛋白,主要功能是同Sec63 一起,与Sec61 复合物相互作用于核糖体,协调蛋白质翻译,辅助蛋白质易位,并可进一步影响内质网应激(Endo⁃plasmic reticulum stress,ERS)诱导的细胞反应。沉默SEC62 能够抑制含信号肽的前体蛋白的翻译后转运[3]。Sec63 蛋白由3 个跨膜结构域组成,内质网内J结构域与分子伴侣Bip(Binding protein)相互作用,促进前体蛋白通过Sec61 通道进行易位[4]。有研究报道,PrP(Prion protein)和ppcecA(Presecretory protein preprocecropin A)依赖于Sec63 插入到Sec61 通道,因此Sec63 蛋白可以特异性影响部分多聚体蛋白的合成[5]。
流行性乙型脑炎病毒(Japanese encephalitis vi⁃rus,JEV)是一种蚊媒性人兽共患病病原,属黄病毒科(Flaviviridae)黄病毒属(Flavivirus)。JEV 通过受体介导的内吞和转运进入细胞内吞体,内吞体内部酸性环境使病毒囊膜糖蛋白发生结构改变,诱导病毒囊膜与内吞体膜发生融合,释放病毒基因组[6]。ER 是JEV 复制周期中的重要场所,也是膜蛋白的合成、转运和加工修饰场所,prM 与E 蛋白的合成和转运可能与ER 常驻蛋白有关[7]。有研究表明口蹄疫病毒(Foot-and-Mouth disease virus,FMDV)感染BHK-21 细胞后,细胞内Sec62 表达上调;沉默Sec62基因后,则抑制FMDV 复制[8]。还有研究发现牛病毒性腹泻病毒(Bovine viral diarrhea virus,BVDV)在感染细胞中Sec62 的表达上调可能有助于病毒糖蛋白在感染后期向ER 转移[9]。Sec62 与Sec63等宿主因子在JEV 复制过程中的作用与机制目前还不清楚。
CRISPR(Clustered regularly interspaced short palin⁃dromic repeats)/Cas 是细菌和古细菌用来抵御噬菌体感染和躲避哺乳动物免疫反应的获得性免疫系统[10],其中CRISPR/Cas9 技术已经发展为高效的基因打靶工具而得到广泛运用,可以作为一种新型高效的基因编辑工具,对内源基因DNA 序列进行靶向删除、插入或修饰[11]。为了研究Sec62、Sec63 等宿主因子对JEV 复制的影响,本研究利用CRISPR/Cas9技术构建了SEC62、SEC63基因敲除的细胞系,分析了SEC62、SEC63基因敲除后对JEV 的感染效率、病毒蛋白表达水平以及病毒复制效价的影响,为进一步研究Sec62、Sec63 等宿主因子对JEV 复制影响机制提供了依据。
1 材料与方法
1.1 主要实验材料 HEK-293 细胞、BHK-21 细胞、pSpCas9(BB)-2A-GFP(PX458)载体均由本实验室保存;DMEM、胎牛血清、0.05%胰酶购自Gibco公司;BbsI 酶、T4 连接酶购自NEB 公司;pMD19-T载体、Ex Taq酶购自宝生物工程(大连)有限公司;GAPDH 抗体购自Proteintech 公司;抗JEV E 蛋白单克隆抗体(MAb)由本实验室制备;兔源抗Sec62 多克隆抗体购自Abcam 公司;Triton X-100 购自Sigma公司;Albumin Bovine V 购自Biotopped 公司;FITC标记的山羊抗小鼠IgG 购自北京中杉金桥生物技术有限公司;Hoechst 33342、LipofectamineTMLTX Re⁃agent 转染试剂、红外荧光(RDye 680CW)标记驴抗鼠IgG 购自Thermo 公司;红外荧光(RDye 800CW)标记驴抗兔荧光二抗购自LI-COR 公司;NP-40 裂解液购自上海碧云天生物技术有限公司;大肠杆菌DH5a感受态细胞、ClonExpress II One Step Cloning Kit 购自南京诺唯赞生物科技有限公司;质粒提取试剂盒购自Omega 公司;基因组DNA 提取试剂盒购自Tiangen公司;sgRNA 与PCR 引物由哈尔滨睿博兴科生物技术公司合成。
1.2SEC62、SEC63基因敲除HEK-293 细胞系的建立
1.2.1 sgRNA 的设计与合成 参考人类SEC62(NM_003262.3)与SEC63(NM_007214)基因序列,利用网络在线工具(www.e-crisp.org/E-CRISP/designcrispr.ht⁃ml)进行sgRNA 设计。针对SEC62基因选取其204 bp位置的sgRNA,对应的正链编码寡核苷酸序列为SEC62-gRNA-A,其互补链名称为SEC62-gRNA-B。针对SEC63基因选取410 bp 位置的sgRNA,对应的编码寡核苷酸序列命名为SEC63-gRNA-A,互补链为SEC63-gRNA-B。寡核苷酸序列如表1 所示,寡核苷酸由哈尔滨睿博兴科生物技术公司合成。
1.2.2 sgRNA 表达质粒的构建 将pSpCas9(BB)-2A-GFP(PX458)载体经BbsI 酶切,回收线性化的PX458 载体。将合成的sgRNA 寡核苷酸进行退火处理,反应体系为SEC62-gRNA-A(100 μmol/L)1 μL,SEC62-gRNA-B(100 μmol/L)1 μL,T4 PNK 1 μL,T4 buffer 1 μL,H2O 4 μL。95 ℃3 min 后,自然冷却20 min(SEC63sgRNA 寡核苷酸的退火体系与反应条件同上)。将退火后的双链DNA 与线性化后的PX458 载体连接。将连接产物转化至DH5α 感受态细胞,挑取单克隆菌落培养后由睿博兴科公司测序,将测序结果正确的质粒分别命名为pSec62-sgRNA 与pSec63-sgRNA,提取质粒后使用超微量分光光度计测定浓度。

表1 编码SEC62、SEC63 基因sgRNA 寡核苷酸序列Table 1 The oligo DNA sequence encoding of sgRNA of SEC62, SEC63
1.2.3SEC62、SEC63基因敲除细胞的克隆筛选待6 孔板中HEK-293 细胞汇合度达80%时,利用LipofectamineTMLTX Reagent 试 剂 分 别 转 染2.5 μg pSec62-sgRNA 与pSec63-sgRNA。转 染48 h 后弃 去细胞培养液,胰酶消化,将细胞悬液加入流式细胞术上样管中,利用MoFlo XDP 超速流式细胞分选系统将绿色荧光阳性细胞分选至含有20%胎牛血清的DMEM 液的96 孔板中,置37 ℃培养5 d~6 d 后观察、标记和换液,待细胞生长密度达70%时将细胞消化转至24 孔板培养,后逐渐扩大至细胞培养瓶中。
1.2.4 基因敲除细胞系的测序鉴定 将上述克隆细胞消化分散,离心后提取细胞基因组DNA,在靶sgRNA位点两端设计引物,命名为SEC62-1s/SEC62-2a、SEC63-1s/SEC63-2a(表2),分别经PCR扩增SEC62和SEC63基因,同时以HEK-293细胞作为对照。反应程序为:94 ℃5 min;94 ℃30 s、50 ℃30 s、72 ℃40 s,35 个循环;72 ℃5 min。PCR 产物由哈尔滨睿博兴科生物技术公司测序,将测序结果与基因序列比较分析,将鉴定阳性的细胞克隆分别命名为SEC62KO HEK-293、SEC63KO HEK-293 细胞。
1.2.5 基因敲除细胞系的western blot 鉴定 将HEK-293 细胞与SEC62KO HEK-293 细胞传代至10代,PBS洗涤后1 000 r/min,离心5 min弃去上清,加入100 μL 含蛋白酶抑制剂的NP-40 裂解液,4 ℃裂解1 h,10 000 r/min 离心5 min,取10 μL,以兔抗Sec62蛋白抗体(1 1 000)及鼠抗GAPDH 抗体(1 5 000)为一抗,以红外荧光(RDye 800CW)标记的驴抗兔IgG(1 10 000)及红外荧光(RDye 80CW)标记的驴抗鼠IgG(1 10 000)为二抗,经western blot 检测,SEC62KO HEK-293 细胞系中Sec62 蛋白的敲除效果,并以野生型HEK-293 细胞作为对照。
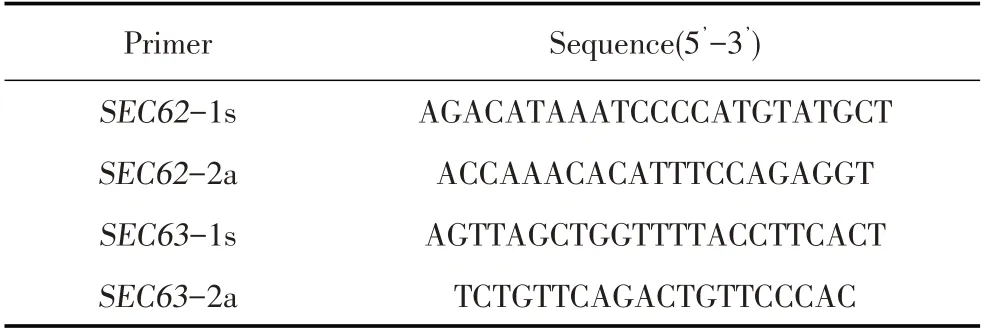
表2 扩增目的基因的PCR 引物Table 2 Primers for target segments amplification
1.3SEC62、SEC63基因敲除对JEV 复制的影响 分别将HEK-293、SEC62KO HEK-293、SEC63KO HEK-293 细胞接种于24 孔板中,置37 ℃培养24 h,分别以MOI 为1、0.05 的JEV 感染上述细胞。感染48 h 后弃去细胞培养液,以鼠抗JEV E 蛋白MAb 为一抗,以Alexa Fluor®488 标记的山羊抗小鼠IgG(1 150)为二抗, Hoechst 33342(1 10 000)室温染细胞核,利用间接免疫荧光试验(IFA)检测SEC62、SEC63基因敲除对JEV 复制的影响。
1.4SEC62、SEC63基因敲除对JEV E 蛋白表达影响的检测 分别将HEK-293、SEC62KO HEK-293、SEC63KO HEK-293 细胞接种于24 孔板中,置37 ℃培养24 h 后,将JEV 以MOI=1 分别感染上述细胞,且设置未感染对照组。于感染后12 h、24 h、48 h 收集并裂解细胞,对照组于48 h 收集细胞,10 000 r/min 离心5 min,取裂解上清液制备电泳蛋白样品,分别以鼠抗JEV E 蛋白抗体及GAPDH 抗体(1 5 000)为一抗,以红外荧光(RDye 680CW)标记的驴抗鼠IgG(1 10 000)及红外荧光(RDye 800CW)标记的驴抗兔IgG(1 10 000)为二抗,利用western blot 检测JEV E 蛋白的表达。
1.5SEC62、SEC63基因敲除对JEV 子代病毒影响 将HEK-293、SEC62KO HEK-293、SEC63KO HEK-293 细胞于24 孔板中37 ℃培养24 h,将JEV以MOI=1 感染上述细胞,于感染后12 h、24 h、48 h 收集细胞培养液,以DMEM 10 倍倍比稀释后以100 μL/孔接种于37 ℃培养24 h 后的BHK-21 细胞,按常规方法测定上清液中子代病毒滴度;进一步以MOI 为1、0.5、0.05 梯度感染HEK-293、SEC62KO HEK-293、SEC63KO HEK-293,于48 h 收集细胞上清,以上述方法进行稀释和检测。
2 结 果
2.1 重组质粒pSec62-sgRNA 和pSec63-sgRNA 的构建与鉴定结果 将退火得到的双链DNA 克隆至PX458 载 体, 构 建 重 组 质 粒pSec62-sgRNA 和pSec63-sgRNA,经测序鉴定后显示已正确构建含有编码目的sgRNA 序列的重组质粒。质粒模式图如图1 所示。

图1 pSec62-sgRNA 和pSec63-sgRNA 质粒模式图Fig. 1 Schematic diagram of the pSec62-sgRNA and pSec63-sgRNA
2.2 基因敲除细胞系的鉴定
2.2.1 基因敲除细胞系靶基因序列检测结果 提取SEC62KO HEK-293 细 胞、SEC63KO HEK-293 细 胞及HEK-293 细胞基因组,采用表2 中引物,以基因组为模板进行PCR 扩增,对扩增产物进行测序分析。结果显示,与人SEC62基因序列进行比对,SEC62KO HEK-293 细胞中SEC62基因缺失2 bp,导致缺失序列后第5 个密码子突变为终止子,另一编辑方式为缺失19 bp 序列;与人SEC63基因序列比对后结果表明,SEC63KO HEK-293 细胞中SEC63基因分别发生缺失4 bp 与缺失1 bp 两种突变,均导致在缺失突变后立即出现终止密码子。序列测定结果均显示所构建的细胞系目的基因SEC62和SEC63分别发生了缺失性突变(图2)。表明正确构建SEC62基因敲除细胞系和SEC63基因敲除细胞系。
2.2.2SEC62KO HEK-293 细 胞 的western blot 鉴 定结果 Western blot 方法检测SEC62KO HEK-293 细胞与HEK-293 细胞中Sec62 蛋白的表达情况。结果显示野生型HEK-293 细胞中Sec62 蛋白(45.8 ku)正常表达,而未能检测到SEC62KO HEK-293 细胞中该蛋白条带(图3),表明SEC62KO HEK-293 细胞中SEC62基因发生了缺失,SEC62KO HEK-293 细胞已正确构建。

图2 基因编辑HEK293 细胞中SEC62、SEC63 等位基因的序列测定Fig. 2 Sequencing of SEC62, SEC63 alleles in gene-edited HEK293 cells

图3 SEC62 KO HEK-293 细胞的western blot 鉴定Fig. 3 Western blot analysis of SEC62 KO HEK-293 cells
2.3SEC62、SEC63基因敲除影响JEV 的复制 将
JEV(MOI 为1、0.05)分别感染HEK-293 和SEC62、SEC63基因敲除细胞系后48 h,利用IFA 检测JEV 复制情况,结果显示,以不同剂量的JEV 感染细胞后,SEC62KO HEK-293 和SEC63KO HEK-293 细 胞内的荧光阳性细胞均少于HEK-293 细胞对照组,且荧光随着病毒感染剂量的减小而减少,并且SEC63KO HEK-293 细胞组荧光信号阳性细胞少于SEC62KO HEK-293 细胞的荧光信号阳性细胞(图4)。表明SEC62、SEC63基因缺失后JEV 的复制效率降低,而且SEC63基因缺失后对JEV 复制的抑制作用强于SEC62。

图4 JEV 复制的IFA 检测Fig. 4 Detecting JEV replication by indirect immunofluorescence test
2.4SEC62、SEC63基因敲除影响JEV E 蛋白的表达 将MOI 为1 的JEV 分别感染HEK-293、SEC62KO HEK-293、SEC63KO HEK-293 细胞后12 h、24 h和48 h,裂解细胞经western blot 检测JEV E 蛋白表达情况。结果显示感染后12 h、24 h 和48 hSEC62KO HEK-293 细胞 和SEC63KO HEK-293 细 胞 中均检测不到JEV E 蛋白的表达;但在HEK-293 细胞中于感染后24 h、48 h 均可检测到该蛋白,且JEV E蛋白表达量随感染时间的延长而逐渐增多;未接毒对照未检测出目的条带(图5)。结果表明SEC62、SEC63基因缺失后抑制JEV E 蛋白表达。
2.5SEC62、SEC63基因敲除对JEV 滴度的影响以MOI 为1 的JEV 感染HEK-293 细胞、SEC62KO HEK-293 细胞和SEC63KO HEK-293 细胞,培养液经病毒滴度测定,结果显示在感染后12 h,SEC62KO HEK-293、SEC63KO HEK-293 和HEK-293 细胞上清中的病毒滴度经检验,差异不显著(p>0.05);感染后24 h,SEC62KO HEK-293、SEC63KO HEK-293 上清病毒滴度降低,与野生型相比差异显著(p<0.01);感染后48 h,SEC62KO HEK-293、SEC63KO HEK-293 上清病毒滴度明显降低,与野生型相比差异极显著(图6A)。表明SEC62、SEC63基因缺失后影响上清中子代病毒的产生。
分别以不同剂量JEV 感染HEK-293、SEC62KO HEK-293 和SEC63KO HEK-293 细 胞,48 h 时 检 测病毒滴度,结果显示不同感染剂量下,SEC62KO HEK-293 细胞、SEC63KO HEK-293 细胞和HEK-293 细胞上清液中病毒滴度经检验,MOI 为1、0.5、0.05 时,SEC62KO HEK-293、SEC63KO HEK-293上清病毒滴度与HEK-293 中上清相比差异极显著(p<0.01)。在不同剂量感染下基因敲除细胞组与对照组病毒效价差异均为极显著(图6B)。进一步证明SEC62、SEC63基因敲除影响JEV 的复制效率。
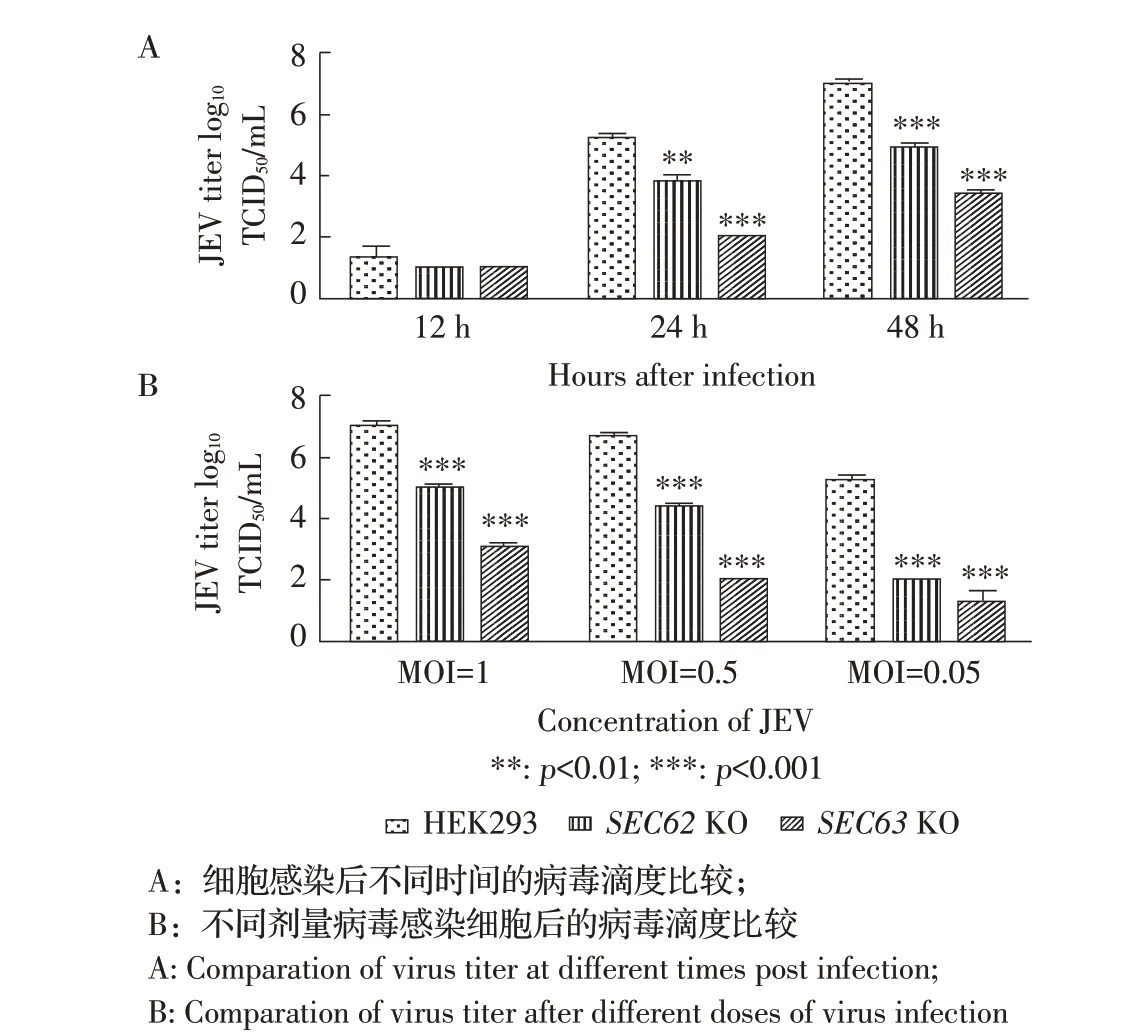
图6 基因敲除细胞系对JEV 病毒滴度的影响Fig. 6 The effect of SEC62 and SEC63 knockout on JEV titers
3 讨 论
研究表明,JEV 的复制过程中,不仅需要病毒自身基因组表达的蛋白参与,还需要大量的宿主表达的蛋白的参与[12]。因此研究宿主因子对JEV 复制的影响有助于了解JEV 复制机制与致病机理,进而为抗病毒治疗提供新方法。
有研究表明Sec62 可以与核糖体相互作用,从而调节翻译[13-14]。Sec62 蛋白可能参与蛋白质于ER易位的早期阶段[15]。Sec63 蛋白与Bip 相互作用,可控制蛋白质在ER 中易位的方向[16]。ER 为JEV 复制的重要场所,探究ER 相关宿主因子对JEV 复制的影响有助于理解JEV 的致病机理。Sec62/Sec63 复合物作为内质网膜蛋白,可调节蛋白质翻译和易位,但其对于JEV 的复制的影响尚不明确。为了解其是否为JEV 的复制相关宿主因子及其对复制的影响,进而研究JEV 致病机理,本实验将HEK-293 细胞中的SEC62和SEC63分别敲除后感染JEV 研究其对JEV 复制的影响。
由于CRISPR/Cas9 系统是一种高效、方便的基因编辑工具,且操作简单、基因修饰率高、可遗传和实验成本低[17],本研究利用CRISPR/Cas9 技术成功建立SEC62、SEC63基因敲除的HEK-293 细胞系,为进一步研究SEC62、SEC63基因对JEV 的影响奠定基础。等位基因存在两种编辑方式,但其通过移码突变以及提前终止的形式均影响了目的蛋白的表达。因HEK-293 细胞中Sec63 蛋白表达水平较低,本实验所选用Sec63 抗体无法检测HEK-293 细胞中的Sec63 蛋白,所以未能通过western blot 方法鉴定SEC63KO HEK-293 细胞,但基因测序结果表明基因敲除后均发生了缺失突变,且缺失突变后立即出现终止子,表明所构建的细胞系中Sec63 发生了功能突变。SEC62、SEC63基因敲除的HEK-293 细胞系的细胞活性与HEK-293 无差异。通过IFA、west⁃ern blot 和子代病毒滴度的测定,显示SEC62、SEC63基因缺失后抑制JEV 蛋白的表达以及子代病毒的形成,研究结果表明SEC62与SEC63敲除后抑制了JEV 的复制,表明Sec62 和Sec63 是JEV 在细胞内进行复制的相关宿主因子。SEC62、SEC63基因缺失可能导致Sec62 与Sec63 无法协同作用参与JEV 多聚蛋白向内质网Sec61 通道的选择性插入过程,或者影响参与JEV 复制的其他宿主因子的易位过程,从而影响JEV 复制。其具体影响机制待进一步实验研究。
