老年慢性肾脏病相关抑郁症发病机制研究进展
2020-11-10许慧晶钱楚岳董丹许颖
许慧晶 钱楚岳 董丹 许颖
(1长春理工大学外国语学院日语专业,吉林 长春 130000;2吉林大学第一医院肾病科)
慢性肾脏病(CKD)在普通人群的发病率为10%~13%〔1,2〕。随着年龄的增长,CKD的危险因素如糖尿病、高血压等发生率增加,导致老年CKD发病率明显增加。美国NHANES 2011~2012年调查数据显示,65~79岁CKD发病率为31.5%,80岁及以上CKD发生率高达65%〔3〕。我国流行病学研究也显示同样的趋势,60~69岁人群中CKD发病率为18%,≥70岁人群中CKD发病率为24.2%,远超过了普通人群的发病率〔4〕。老年CKD患者合并症和并发症复杂,很多患者在发生终末期肾病以前就己经发生死亡或心脑血管事件〔5,6〕,除了常见的并发症以外,还常常合并抑郁症〔7〕。而CKD患者抑郁的发病率远高于普通人群和其他慢性病患者。研究显示,CKD患者抑郁症的患病率为26.5%〔8〕。CKD患者的抑郁患病率是一般人群的3~4倍,是其他慢性疾病(包括糖尿病、冠心病和慢性阻塞性肺病)的2~3倍〔9~11〕。老年人CKD相关抑郁症是目前亟待解决的临床问题,但其机制不明,所以对CKD相关抑郁症发生机制及防治措施的研究具有重大的社会意义和经济效益。本文将对CKD相关抑郁症的发病机制综述。
1 CKD相关抑郁症的发病机制与中枢有关
目前,对于抑郁症发病机制的研究认为抑郁症与以下几方面因素有关:神经环路、单胺类神经递质、神经内分泌与神经免疫功能、遗传因素等。单胺类递质在抑郁症发病中的作用在60年前已被广泛证明,一直是研究的热点。该假说认为抑郁症是由单胺类递质功能降低引起的。基于单胺类递质的药物至今仍是抑郁症治疗的一线药物,包括抑制递质再摄取的药物(如选择性5-羟色胺再摄取抑制剂)和抑制递质降解的药物(如单胺氧化酶抑制剂),通过升高单胺类递质的浓度起作用。但是一项纳入201例来自3个美国医疗中心的CKD 3~5期非透析患者的随机、双盲、安慰剂对照试验表明〔12〕,服用选择性5-羟色胺再摄取抑制剂舍曲林12 w并没有显著改善CKD患者的抑郁症状和生活质量,但不良反应却明显增加。这些证据不支持使用选择性5-羟色胺再摄取抑制剂舍曲林治疗CKD相关抑郁症,单胺类学说不能解释CKD相关抑郁症的发病机制。CKD相关抑郁症发病率明显高于其他疾病相关抑郁症,提示CKD相关抑郁症的发病机制更具独特性,与CKD疾病本身对患者产生的心理因素有关,更与CKD疾病本身对中枢神经系统产生的影响有关。
肾脏和脑有相似的血流动力学特征,使肾脏和脑之间存在多种联系,且互相影响,这种相互作用被称为肾-脑交叉对话,这是CKD继发情感障碍类疾病的理论基础〔13〕。CKD释放的尿毒症毒素直接导致脑损伤,CKD引起的血流动力学改变、贫血、甲状旁腺功能亢进、多药治疗和睡眠障碍,及CKD合并的炎症分子、氧化应激和血管紧张素Ⅱ水平的增加,均可导致CKD患者合并情感障碍类疾病;另一方面,偏头痛和脑外伤等中枢神经系统疾病可能会加重CKD疾病的进展。见图1。研究表明,抑郁症患者伴有大脑高级神经功能紊乱,表现为与抑郁症有关的脑内结构和功能异常及与抑郁症有关的神经环路受损,抑郁症患者磁共振成像(MRI)显示,额叶区、海马、壳核和尾状核、前扣带回、杏仁核等神经核团体积减少且伴有白质病变〔14〕。有学者应用MRI技术进一步对CKD患者大脑灰质和白质的结构性改变进行了分析,并重点研究了与抑郁相关的区域(额叶-皮层下),结果显示,与对照组相比,CKD患者整体灰质体积较少而白质病变加重,减少的灰质簇主要集中在额叶,这种改变在伴有抑郁症的CKD患者中更明显〔15〕。另有学者进一步使用静息态功能核磁(fMRI)研究了与抑郁症密切相关的脑区之一前额叶皮质在CKD中的变化,结果显示,与不伴有抑郁症的CKD患者相比,伴有抑郁症的CKD患者前额叶受损严重〔16〕。另一项神经影像学研究采用f-18氟脱氧葡萄糖正电子发射断层扫描技术探讨透析前CKD抑郁症状与脑葡萄糖代谢的关系,结果伴抑郁症状的透析前CKD患者大脑多个区域葡萄糖代谢水平下降,主要集中在皮层,右侧眼窝前额皮质的脑葡萄糖代谢与汉密尔顿抑郁量表呈负相关〔17〕。而进一步对CKD所致抑郁症分子机制的研究显示,CKD患者体内的高尿素通过使雷帕霉素靶蛋白(mTOR)甲酰化下调CKD模型小鼠内侧前额叶皮质中mTORC1-S6K通路诱导抑郁样行为,特异性上调内侧前额叶皮质中的S6K,可逆转尿素诱导的S6磷酸化下降并改善CKD所致的抑郁样行为〔16〕。由此可见,CKD相关抑郁症伴有中枢神经系统的改变,多个核团参与其中,而对中枢核团的干预有望成为CKD相关抑郁症治疗的新靶点。
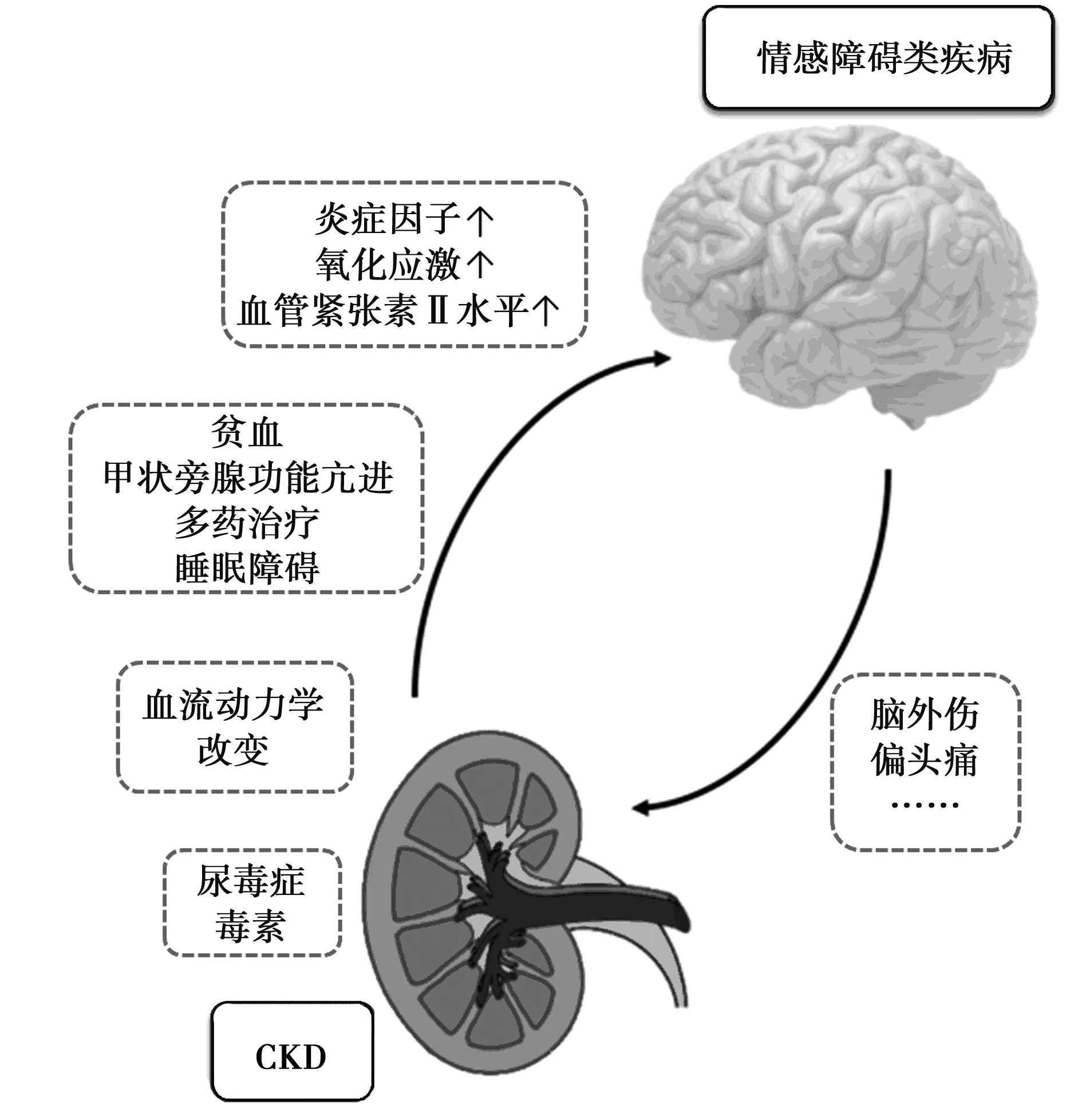
图1 CKD和情感障碍类疾病相互影响
2 外侧僵核(LHb)在CKD相关抑郁症中的作用不容忽视
在众多与抑郁症有关的中枢核团中, LHb作为介导从前脑向中脑腹侧被盖区等奖赏相关脑区传递信息的核心枢纽,被认为是参与抑郁症形成的关键脑区〔18〕,引起国内外学者的广泛关注。LHb神经元受压力、失望、恐惧等厌恶的情绪刺激而激活,不同的抑郁模型中均发现LHb神经元活动度增加〔19,20〕,抗抑郁药物治疗可降低啮齿类动物LHb的神经元活动度,电损毁LHb可缓解抑郁〔19〕,更有力的临床证据表明,深部电刺激LHb产生快速、持久的抗抑郁作用〔21〕。
LHb对CKD起调节作用。Le Foll等〔22〕对人类LHb的转录组学研究显示,对1 849个疾病相关基因在人类LHb的表达情况进行检测并统计,按基因数排在前10位的疾病是:流感、肺炎、类风湿关节炎、钙质沉着症、IgA肾病、过敏、多发性硬化、尿毒症、肺纤维化和肝硬化〔22〕。由此可见,LHb同时调控抑郁症和CKD,LHb可能参与了CKD相关抑郁症。
3 LHb调控CKD相关抑郁症可能的分子机制
研究显示,CKD 4~5期患者血浆中氨基酸浓度明显升高〔23〕。5/6肾切除CKD大鼠血浆中谷氨酸含量明显升高〔24〕。与健康对照组比较,维持性血液透析的尿毒症患者前额皮层的谷氨酸浓度增高,且患者抑郁程度与腹内侧前额皮层谷氨酸浓度呈负相关〔25〕。谷氨酸是脊椎动物中枢神经系统中主要的兴奋性神经递质,在正常生理条件下,谷氨酸从突触前神经末梢释放,并与突触后膜上的谷氨酸受体结合。未结合的谷氨酸被突触间隙中的神经元和胶质细胞迅速吸收〔26〕。而病理条件下,细胞外谷氨酸积累可引起谷氨酸受体的过度激活〔27〕。文献报道,尿毒症患者脑组织内增加的胍类化合物可通过激活N-甲基-D-天冬氨酸受体(NMDAR)对中枢神经系统起调节作用〔28,29〕。NMDAR为谷氨酸受体,是一种大型的异四聚体膜蛋白复合物,大部分由两个必需的GluN1和两个GluN2亚基组成。GluN2亚基包括GluN2A、B、C和D〔30〕,在大脑发育、突触可塑性和记忆形成及神经毒性等方面起重要作用〔31〕。而氯胺酮作为NMDAR拮抗剂,可改善腺嘌呤诱导的CKD所致的抑郁样行为〔16〕。所以推测NMDAR参与CKD相关抑郁症的发病过程。最新研究表明氯胺酮的快速抗抑郁作用主要是通过抑制依赖NMDAR的LHb神经元的爆发式放电实现的〔32〕。NMDAR的激动剂N-甲基-D-天冬氨酸(NMDA)可使LHb的放电增加〔33〕,局部阻断LHb中NMDAR可引起快速的抗抑郁作用〔32〕,推测LHb中NMDAR的上调参与CKD相关抑郁症的发生发展。
NMDAR的过度激活可激活下游的Ca2+/钙调蛋白激酶(CaMK)Ⅱ-CREB-BDNF信号通路。研究显示,NMDAR激活导致大量的Ca2+内流〔34〕。细胞内Ca2+浓度升高导致CaMKⅡ的过度磷酸化和一系列信号通路的激活,从而引发兴奋性毒性〔35〕。Ca2+/CaMKⅡ是由Ca2+/CaMK复合物调控的一种多功能蛋白激酶,涉及多种疾病,包括阿尔茨海默病、抑郁症和心律失常〔35~37〕,文献报道,抑制LHb的CaMKⅡ活性可改善抑郁模型大鼠的抑郁样行为〔37〕。Ca2+/CaMKⅡ通路可激活环AMP反应元件结合转录因子(CREB),即使CREB磷酸化〔38〕。一项使用应激诱导的抑郁症动物模型的研究显示,LHb中CREB的活性增强,即磷酸化水平增加〔39〕,可见抑制LHb中CREB的磷酸化可缓解抑郁。CREB磷酸化后与脑源性神经营养因子(BDNF)的启动子解离,进而使BDNF表达上调〔40〕。体外实验表明,BDNF可诱导大鼠原代皮层神经元c-Fos(神经元活动的一种标志物)的表达〔41〕,而LHb神经元活性的增加是抑郁症状发生的重要因素〔42,43〕,所以推测LHb中 NMDAR-CaMKⅡ-CREB-BDNF信号通路的上调参与调控CKD相关抑郁症。而尚有文献报道:(1)不同抑郁症动物模型LHb神经元活性增加,电损毁LHb可以改善抑郁〔19,44〕,进一步提示LHb活性增加是抑郁症发病的重要因素。(2)LHb参与调控多种疾病相关抑郁症:同相关抑郁症、帕金森相关抑郁症和甲状腺功能减低相关抑郁症模型LHb神经元活性增加,电损毁LHb可以改善抑郁,提示LHb也可能参与CKD相关抑郁症〔45~47〕。(3)下调LHb中的NMDAR和BDNF可改善抑郁:慢性束缚应激(CRS)抑郁模型小鼠LHb中BDNF的表达明显增加,而特异性下调LHb中的BDNF可使LHb活动度下降,CRS不能再诱发小鼠的抑郁样行为。抑制GluN2B受体(NMDAR的一个亚基)通过下调LHb中的BDNF抑制LHb神经元活动度,进而改善小鼠的抑郁样行为〔48〕。这些研究结果提示,抑郁时LHb中NMDAR和BDNF均上调,而下调LHb中的NMDAR和BDNF可改善抑郁。所以,进一步推测下调LHb中NMDAR-CaMK Ⅱ-CREB-BDNF信号通路可缓解CKD相关抑郁症,见图2。
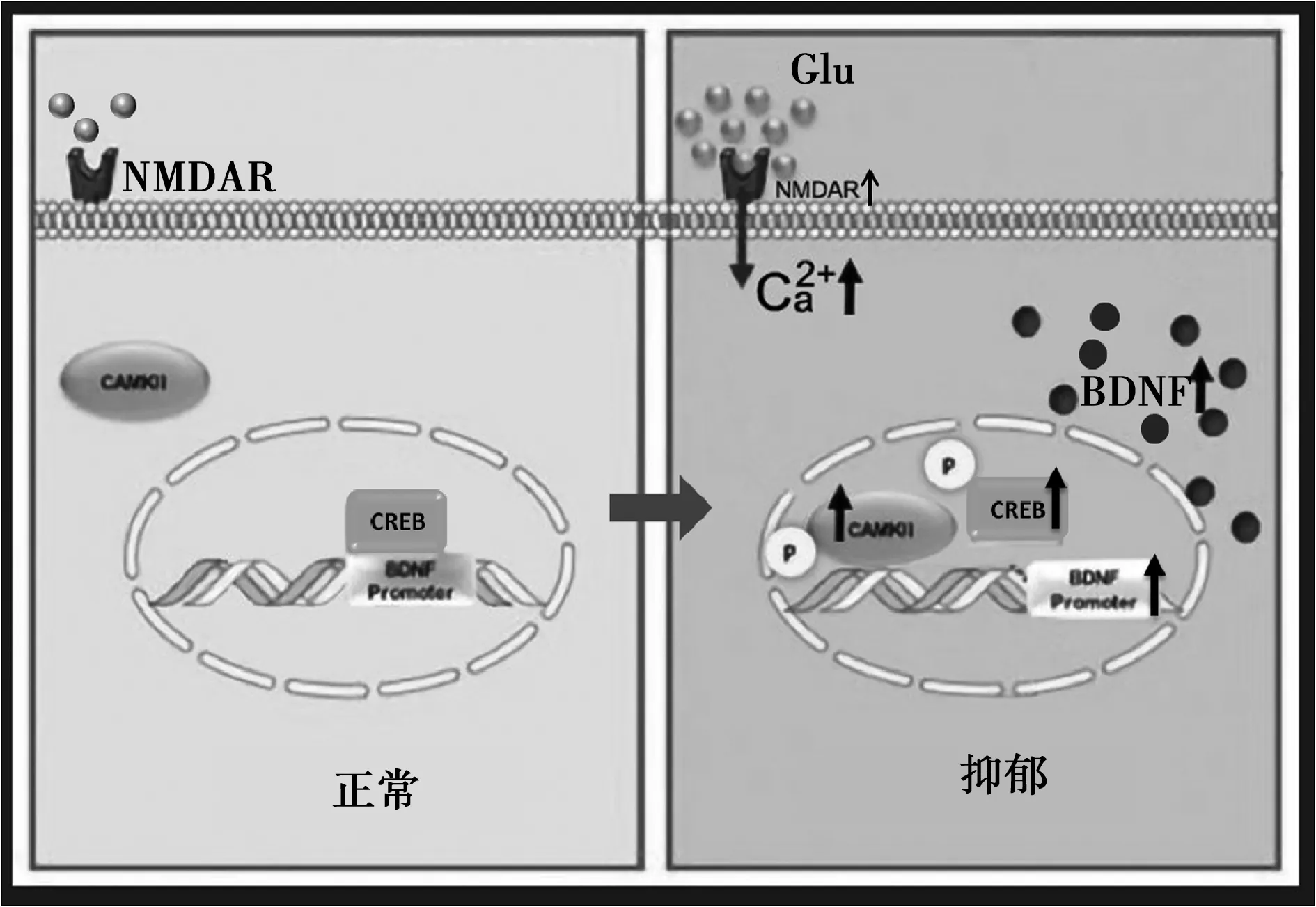
图2 LHb中的NMDAR-CaMKⅡ-CREB-BDNF参与调控CKD相关抑郁症的模拟图
综上,LHb中的 NMDAR-CaMKⅡ-CREB-BDNF信号通路可能是中枢神经系统参与CKD相关抑郁症的重要分子机制,特异性的靶向治疗有望使老年人CKD相关抑郁症的研究和治疗获得突破性进展。
