卵巢交界性黏液性肿瘤的临床病理特征分析
2020-11-10奉泽锦陈廷安李星兵江小林韩亮
奉泽锦 陈廷安 李星兵 江小林 韩亮
卵巢交界性黏液性肿瘤(mueinous borderline ovarian tumor,MBOT)和卵巢交界性浆液性肿瘤(serous borderline ovarian tumor,SBOT)是卵巢交界性肿瘤(特指卵巢上皮性交界性肿瘤)中的两种常见分型,二者约占卵巢交界性肿瘤的90.00%以上[1]。相较于SBOT而言,MBOT的恶性程度更低。既往研究发现,这类肿瘤虽然在一定程度上可表现为恶性,但却无破坏性的间质浸润,因此预后效果较其他卵巢肿瘤更好[1]。研究发现,与SBOT比,MBOT发生浸润性复发的概率显著更高,约有13.0%的MBOT患者在患病后10年可出现浸润性复发,这极有可能与卵巢粘液癌有关[2]。故有必要开展针对性研究,对MBOT的临床病理特征进行更科学、合理的研究,为进一步了解MBOT的病变过程和采取针对性治疗措施进行治疗,提升患者预后提供理论依据。选取78例MBOT患者进行回顾性实验,分析不同亚型的MBOT患者的临床病理特征。
1 资料与方法
1.1 一般资料 纳入时间:2001年1月至2010年1月,随访时间≥1 800 d,患者经两位病理科医师复核诊断均确诊为MBOT者;纳入标准:(1)纳入患者均为女性,年龄≥20岁;(2)保守型手术和广泛性手术者均可;(3)无药物过敏史者及随访资料(症状、盆腔检查和肿瘤标志物、超声检查等)完整者;(4)签署《知情同意书》和临床资料完整者。排除标准:(1)不符合上述纳入标准者;(2)MBOT伴其他恶性肿瘤(脑、心、肝、肺、肾、膀胱等)或功能不全、免疫异常、凝血障碍者;(3)SBOT者;(4)神经或精神异常者。患者均按世界卫生组织(WHO)提出的诊断标准[3]判定。
1.2 方法
1.2.1 手术方式:保守型手术(单侧附件切除术、肿瘤剔除术等)和广泛性手术(全子宫+双侧附件切除术,全子宫+双侧附件切除术+全面分期术)两种,上述两种手术方式的判定标准均按国家妇产科联盟(international federation of gynecology and obstetrics,FIGO)卵巢恶性肿瘤分期标准进行判定后选择合适的手术类型。
1.2.2 病理学检测方法:78例患者的手术标本,均在甲醛溶液固定(中性,4.0%)的基础上进行常规脱水处理后予以石蜡包埋、切片(切片厚度:3 μm),进行HE染色、中性树胶封片及光学显微镜下观察。
1.3 诊断标准 (1)胃肠型MBOT:细胞增生复层化≤3层,常见杯状细胞,衬覆上皮由肠型上皮组成。细胞核有异型性,且多以轻度、中度为主,核分裂≤4个/10 HP,间质侵犯不显著或无;(2)浆黏液性MBOT:上皮成分主要为混合性,即宫颈内膜型黏液性上皮和浆液性上皮;(3)MBOT伴微小浸润癌:微小浸润是指小灶性间质浸润,其最大浸润灶直径<0.5 cm;(4)MBOT伴上皮内癌:细胞复层>3层或伴有明显的核异型性,而间质浸润不显著或无,同时MBOT中有部分组织的细胞学特征表现为上皮内癌,但无间质浸润;(5)MBOT伴腹膜假黏液瘤:是指在MBOT基础上存在黏液性腹水或者腹膜表面附着有黏液结节,黏液中缺乏上皮细胞或上皮细胞较少且核异型性较小,为低级别改变。
2 结果
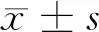
2.1 78例MBOT患者的年龄与治疗方式情况 78例MBOT患者中<40岁者48例(61.54%),其中手术治疗时选择保留生育功能者22例,占比(45.83%)最高,平均患病年龄(42.37±5.88)岁;≥40岁者30例(38.46%),根治性手术治疗者15例,占比(50.00%)最高,平均患病年龄(48.23±6.14)岁。见表1。

表1 78例MBOT患者的MBOT分期及年龄分布情况 例
2.2 术前血清肿瘤标志物 78例MBOT患者中术前血清CA125水平(21.43±2.34)kU/L者53例(67.95%),其中血清CA125水平升高[(126.72±24.22)kU/L]者18例(33.96%);术前血清CA19-9水平[(21.33±2.21)kU/L]检测者25例(32.05%),其中血清CA19-9水平升高[(612.33±28.95)kU/L]者11例(44.00%)。
2.3 病理学特征 (1)交界性黏液性囊腺瘤51例(伴上皮内癌、间质微小浸润癌、腹膜假黏液瘤分别为11例、5例、2例),局部交界性卵巢黏液性囊腺瘤27例,各占65.38%、34.62%;(2)肿瘤平均最大径线(15.76±10.34)cm,包括最大径线≥10 cm者43例和最大径线≥20 cm者35例,各占55.13%、44.87%;(3)单侧肿瘤、双侧肿瘤各63例(包括左侧41例、右侧22例)、15例,各占80.77%、19.23%。
2.4 复发情况 78例MBOT患者中治疗出院后随访复发者共9例(11.54%),其中手术至初次复发时的平均间隔时间(25.34±3.75)个月,所有复发者的初次复发时间均在术后5年内出现。见表2。

表2 MBOT复发患者的具体情况
2.5 术后化疗 78例MBOT患者中11例(14.10%)行术后化疗,包括4例复发者(胃肠型MBOT伴腹膜假黏液瘤、胃肠型MBOT伴微小浸润癌、胃肠型MBOT分别为2例、1例、1例)。化疗方案包括5-氟脲嘧啶(5-fluorouracil,5-Fu)+环磷酰胺(Cytoxan,CTX)、紫杉醇(Taxol)+顺铂/卡铂(Cisplatin/carboplatin,PDD/CBP)、CTX+阿霉素(Adriamycin,ADM)+PDD等,平均化疗疗程2个。
2.6 MBOT复发的多因素Logistic回归分析 多因素Logistic回归分析显示,病理类型、手术方式、手术分期、术后化疗等指标均是影响MBOT复发的多因素(OR=3.781、6.322、0.875、0.562,P均<0.05)。见表3、4。

表3 MBOT复发的单因素分析 例(%)

表4 MBOT复发的多因素多因素Logistic回归分析
3 讨论
据统计,卵巢交界性肿瘤(borderline ovarian tumors,BOT)的发生率约占人类卵巢肿瘤总发生率的10.0%~15.0%,不同国家或地区有一定的地域性差异[2]。而近年来的流行病学研究发现,虽然卵巢交界性黏液性肿瘤(MBOT)在北美洲及欧洲国家中的发生率长期稳居BOT的第二位,但在包括中国、日本在内的亚洲国家其发生率较上述地区偏低,且在世界范围内的恶性程度均较低[4]。WHO将其定义为介于明显良性和明显恶性的同类肿瘤(生长方式和细胞学特征)间的有显著无损毁性间质浸润且预后效果较好的一种卵巢肿瘤。有学者跟踪142例Ⅰ期卵巢上皮性交界性肿瘤患者的资料发现,在相对较长的随访期内,死亡率0.70%,对侧卵巢复发率3.50%,保守性手术率20.42%[5]。而对于MBOT患者而言,其临床病理学特征与其他的BOT类型(SBOT、混合性SBOT、Brenner肿瘤)相比又有其特殊性[6],这是值得区别与研究的。结合本研究结果来看,78例MBOT患者的临床病理学特征主要体现在以下几个方面。
3.1 MBOT的临床特征和诊断 78例MBOT患者中,<40岁者共48例,占61.54%,包括22例保留生育功能者,平均患病年龄(32.37±5.88)岁,而流行病学研究则表明,其高发年龄多集中在30~50岁,与本研究结果相近,而单就<40岁的MBOT患者而言,48例患者的患病年龄与侯敏敏等[7]研究中的平均发病年龄36.8岁较接近。本文中≥40岁者30例,占38.46%,其中根治性手术治疗者15例,占50.00%,平均患病年龄(48.23±6.14)岁。同时文中的术前血清CA125、CA19-9水平检测发现,78例MBOT患者中这两种血
清肿瘤标志物表达水平均存在升高现象,其中CA125水平升高(126.72±24.22)kU/L,共18例,血清CA19-9水平升高(21.33±2.21)kU/L,共11例,各占33.96%和44.00%。但这并不完整证实血清CA125、CA19-9表达异常与MBOT患者的病情发生、发展、转归及预后等存在直接关系。研究发现,由于MBOT的临床表现无显著特异性,故导致术前诊断较困难[5]。虽然超声诊断是其首选方法,但由于不能对其做出准确的特异性诊断,故还需其他的辅助性诊断方法,如血清肿瘤标志物、影像学检查等[8,9]。而结合本研究结果与既往研究情况后我们不难发现,上述检测方法虽然能发挥较好的辅助作用,但与病理学检查相比还是存在一定差异。文中病理学诊断发现,78例MBOT患者中交界性黏液性囊腺瘤51例(伴上皮内癌、间质微小浸润癌、腹膜假黏液瘤各11例、5例、2例),占65.38%;局部交界性黏液性囊腺瘤27例,占34.62%;肿瘤平均最大径线(15.76±10.34)cm,最大径线≥10 cm 者43例和最大径线≥20 cm者35例,各55.13%、44.87%;单侧肿瘤、双侧肿瘤各63例(左侧41例、右侧22例)和15例,各占80.77%、19.23%。上述病理学诊断符合率均100%。如有学者研究证实,其病理学诊断(术中冰冻切片与术后石蜡包埋组织切片诊断)的符合率则为72.70%,这与本文中的有显著差异,而导致差异的原因与冰冻诊断影响手术方式的制定有关[10],这也是导致部分MBOT患者初次手术后仍需再次接受分期手术治疗。
3.2 MBOT的手术治疗 手术是恶性肿瘤治疗的主要手段,MBOT也包括在内,但更为重要的是,为获得更好的治疗效果,切除MBOT患者的阑尾也十分必要。如美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)指南(2012年版)[11]则建议在MBOT患者初次手术治疗时可采取与上皮性卵巢癌相同的治疗方法,且应尽量将肉眼所见的病灶进行切除或实行全面分期手术治疗。而结合本文来看,<40岁者切除阑尾的MBOT患者共4例,≥40岁者切除阑尾者共2例,共占7.69%,与既往研究中的阑尾切除比例相比较低,可能与样本量的多少或MBOT位置存在一定关系。近年来,随着生育年龄的逐渐延后,很多疾病患者在接受卵巢手术治疗的同时,对保留生育功能极有帮助[12]。这在MBOT的临床诊治过程中同样如此。本文中有22例患者在手术期间保留生育功能,占总数的28.21%,这与WHO分类中所描述的交界性浆粘液性肿瘤(2014年版)中的手术期保留生育功能所占比例较接近。而对于根治性手术治疗的MBOT患者而言,文中共计15例,占50.00%。但不容忽视的是[13-15],无论是保守性手术还是广泛性手术的MBOT患者,同样存在复发迹象,文中所发9例复发者中,死亡者共2例,而其余患者除失访外,大多患者则以带瘤生存和无瘤生存居多。复发部位主要集中与盆腔、腹盆腔和双侧附件,复发率无显著差异(P>0.05)。手术至初次复发时的平均间隔时间(25.34±3.75)个月,且所有复发者的初次复发时间均在术后5年内出现。但结合既往与本次研究来看,受复发者多集中在≤60岁,故多数患者仍可再行手术治疗,尤其适用于年轻或有较强生育愿望的MBOT患者,但若需获取更有效的预后效果,术后必须对其进行严密的检测与随访。
3.3 MBOT的预后 整体而言,MBOT的预后效果均较理想。研究结果证实,MBOT的发生、发展可能是卵巢黏液癌的癌前病变引起。病理学与分析遗传学研究所提供的大量研究结果证实[16],MBOT的病变多存在渐进性,即良性-交界性上皮内癌-间质微小浸润癌-浸润癌的渐变趋势。预后效果的好坏受各种因素的影响,本文中的多因素Logistic回归分析后发现,病理类型、手术方式、手术分期、术后化疗等指标均是影响MBOT复发的多因素(OR=3.781、6.322、0.875、0.562,P均<0.05),这与孙力等[17-19]研究结果相近。同时袁光文等的生存分析结果提示,MBOT患者预后的不良因素与临床分期(晚期)和伴腹膜假黏液瘤等息息相关,其随访10年的生存率约95.40%,死亡率约3.03%。本文随访生存率97.44%,死亡率2.56%,与上述研究较接近。据文献报道,MBOT的5年生存率可高达100%,但该结果也会受随访时间的长短而改变,复发率也会随之变化[20]。本文所有纳入者的5年生存率均可达100%。与既往研究相比,本文多因素Logistic回归分析发现,其独立危险因素主要是病理类型、手术方式、手术分期、术后化疗,而其他学者的研究却将肿瘤复发与保留生育功能手术、微乳头、浸润性种植、FIGO分期晚等归结为MBOT预后(复发)的独立危险因素范畴,导致这种差异的原因可能与样本的选择和MBOT病变有关[21]。另外,鉴于MBOT的复发多集中于晚期,因此要获得更加准确的预后支持依据,延长随访时间至10年甚至更长十分必要,具体随访内容除了年龄、性别、病型、临床分期等,还可将其扩散至血清肿瘤标志物、病理学诊断等领域。最终获取更科学、合理的诊治依据。
综上所述,MBOT的预后效果较好,临床病理特征为年龄轻、临床分期早、复发率低及复发间隔时间长等。值得注意的是,MBOT分型的临床病理学特征存在一定差异,如胃肠型MBOT和浆黏液性MBOT。而对于手术治疗而言,虽然现阶段MBOT行保守性手术治疗的复发率较广泛性手术相比略高,但其优势也是相对明显的,尤其是在保留生育功能方面更是如此。而但就本文研究来看,虽然效果较好,但依旧存在缺陷,如分期手术方法的选择、术后辅助治疗的选择及术后化疗等均仍有尚待补充与完善之处。
