小剂量糖皮质激素、N-乙酰半胱氨酸联合有氧抗阻肺康复疗法治疗特发性肺纤维化的临床疗效及对相关炎症介质表达的影响
2020-11-10戴勇曾崎冈段晨霞徐飞龙魏成功
戴勇 曾崎冈 段晨霞 徐飞龙 魏成功
1广东省中西医结合医院呼吸内科(广东佛山528200);2广州中医药大学(广州510006)
特发性肺纤维化(idiopathic pulmonary fibrosis,IPF)是一种病因复杂间质性疾病,好发于中老年,与年龄及遗传有关,男性多于女性,在亚洲的发病率较欧美低,发病率在1.2 ~4.16/100 000 之间[1]。IPF 病变局限在肺脏,由于打破了肺组织损伤修复的平衡,引起肺组织的异常修复,加速炎症因子、趋化因子聚集,使细胞外基质过度沉积,最终导致肺组织结构的异常重塑[2-4]。IPF 特征是呼吸困难和肺功能逐渐恶化,最终导致呼吸衰竭而死亡。最近一些研究[5]发现,合并有心血管系统方面疾病的IPF 患者,预后更差。
由于IPF 病因复杂,尚未完全阐明其具体发病机制,针对IPF 的药物治疗相关研究进展有限,加大了药物干预IPF 发生发展的难度,因而探索针对IPF 的综合疗法具有重要的临床意义。常规IPF 治疗方案中单一应用糖皮质激素或N-乙酰半胱氨酸(Nac)使中老年IPF 患者难以获得较大治疗收益,却往往面临诸多潜在的副作用,如使原有合并症如糖尿病、心脑血管疾病和骨质疏松等恶化,但呼吸科医生在IPF 治疗上仍有可为。小剂量糖皮质激素及Nac 在治疗IPF 方面的临床疗效已得到部分证实,可起到强大的抗炎功能,并能减轻自由基的产生、抑制气道重构[6]。而指南[7]也重新认识并定义了肺康复在治疗IPF 的作用及地位,明确指出肺康复对于IPF 预后及生活质量的改善作用。但目前有关小剂量糖皮质激素及Nac 联合肺康复的综合治疗方案对IPF 患者的受益研究极少,其临床有效性及可行性亟待验证。本研究以72 例IPF 患者为研究对象,探讨小剂量糖皮质激素、Nac 联合有氧抗阻肺康复的综合性疗法对IPF 患者临床疗效及相关炎症介质表达的影响,为今后IPF 的康复综合疗法选择提供新的治疗方案参考。
1 资料与方法
1.1 一般资料选择2017年1月至2018年6月在广东省中西医结合医院住院治疗的IPF 患者72 例,均符合2015年ATS/ERS/JRS/ALAT 联合指南以及《特发性肺纤维化诊断和治疗中国专家共识(2016年版)》制定的IPF 诊断标准,随机分为治疗组、对照组各36 例。治疗组男19 例,女17 例;年龄45 ~76 岁,平均(64.0±7.20)岁;病程4 ~24年,平均(18.64±10.61)年;对照组男21例,女15例;年龄45 ~76 岁,平均(64.0±7.20)岁;病程2 ~21年,平均(16.31±9.58)年。排除标准:(1)有糖皮质激素和Nac 使用禁忌的患者,或属肺康复运动禁忌证;(2)患有严重的心功能不全,肝肾功能障碍;(3)合并有支气管扩张、支气管哮喘以及肺部结核等其他疾病;患有精神类疾病;(4)不愿配合治疗;(5)患有严重的高血压、糖尿病。本研究得到广东省中西医结合医院医学伦理委员会的批准,且患者签署了知情同意书。两组病例的基础情况如表1、2 所示,两组患者在年龄、性别、吸烟史、病程等一般资料上差异均无统计学意义(P>0.05)。
1.2 治疗方案对照组予口服醋酸泼尼松片(浙江仙琚制药股份有限公司,规格:5 mg × 100 s,批号:H33021207),开始以每日0.5 mg/kg 口服,持续12 周;随后开始减量至每日0.25 mg/kg,口服持续8 周;最后减量至每日0.125 mg/kg 口服,隔日一次,持续6 个月);与此同时口服乙酰半胱氨酸胶囊(广东人人康药业有限公司,规格:0.2 g×18 粒,批号:H20000519)200 mg/次,每天3 次,两组均治疗6 个月。治疗组在此基础上,按预约时间,进行每周4 ~5 次、每次持续约120 min、为期6 个月的有氧抗阻肺康复训练,其中包括呼吸训练、肌肉放松训练、有氧训练、抗阻训练及自我教育五个部分内容。

表1 两组性别与吸烟史Tab.1 Comparison of three groups of gender information例
表2 两组年龄、病程比较Tab.2 Comparison of age and course data of the three groups ±s

表2 两组年龄、病程比较Tab.2 Comparison of age and course data of the three groups ±s
组别治疗组对照组t 值P 值例数36 36年龄(岁)64.0±7.20 64.0±7.20 0.02 0.97病程(月)18.64±10.61 16.31±9.58 1.43 0.45
1.2.1 呼吸训练治疗方案嘱患者用鼻子用力吸气,嘴巴慢慢吐气,吸气时间2 s,呼吸时间4 s;吸气的时候嘱患者腹部鼓起,呼气时候嘱其腹部回缩;训练时间:每天3 次,15 min/次。
1.2.2 有氧锻炼(1)运动强度测试:采用症状限制性平板运动测试制定患者最大运动耐受强度,症状限制性运动测试是以患者出现严重的临床症状和体征为终止测试标准;出现下列任意项即可终止测试:(1)极度疲劳;(2)患者气促明显,不能顺利完整的说一句话;(3)外周血氧饱和度降低至85%以下;(4)心率、血压不升高反而下降;(5)血压>200/100 mmHg;(6)心电图示心肌缺血、恶性心率失常等改变。
所有受试者在测试前休息15 min,测静息状态下HR、BP、SpO2、改良Borg 气促评分。以患者6MWT 中平均速度的50%作为平板的起始速度,坡度均为0,每2 min 增加0.5 km/h,同时在每个2 分末记录患者运动后HR、BP、SpO2、改良Borg 气促评分,直到患者出现上述症状之一即停止运动,最后30 s 内患者耐受的平板速度即为患者最大耐受运动量。此时的心率、血压定义为最大耐受HR、BP、SpO2、改良Borg 气促评分。用患者最大耐受运动量状态下与静息状态下HR、BP、SpO2、改良Borg 气促评分差值综合判断患者最大耐受运动量。有氧训练的运动强度按照最大耐受量(程度)的50%逐步增加到患者最大耐受运动量。
1.2.3 抗阻锻炼运动强度制定统一采用1RM 值法,即测试目标肌肉群完成某一标准动作一次最大负荷量称为该目标肌肉群的1RM 值。研究组患者均按照各自50%1RM 值开始训练,按照10%1RM 逐渐增加至80%1RM,并维持;训练方式采用E720 液阻手脚复合训练机,统一行上下肢器械训练;目标肌群:胸大肌、腹直肌、小腿三头肌、股四头肌、股内、外侧肌肉、臀大肌。
1.2.4 自我教育团体授课模式,对患者进行IPF相关知识教育,内容包括规范化治疗、长期氧疗适应证、肺康复运动指导、饮食指导以及急性加重识别与就医指导。每月1次,共6次课程,每次课时在20 min 左右。
1.3 观察项目观察治疗前后患者症状积分和生存质量评价(ATAQ-IPF 评分、mMRC 分级)改变;肺功能指标如FEV1、FVC 变化特点;比较各组气道炎症因子(IL-8、TNF-α)组间变化特点。
1.4 统计学方法运用SPSS 19.0统计软件进行分析,正态分布计量资料以()表示,组间比较采用独立t检验;治疗前后自身比较采用配对t检验,计数资料以率表示,采用χ2检验。统一以P<0.05为差异有统计学意义。
2 结果
2.1 临床疗效比较对照组总有效率为77.8%,治疗组为94.4%,两组对比差异有统计学意义(P<0.05)。详见表3。

表3 三组临床疗效比较Tab.3 Comparison of clinical efficacy of three groups 例(%)
2.2 症状积分比较两组治疗前症状积分比较差异无统计意义(P>0.05)。组间分析发现,治疗组在所有症状积分项目上的改善作用明显优于对照组(P<0.05)。进一步行组内治疗前后比较发现,对照组在咳嗽、喘息、胸闷、气短、哮鸣五个方面较治疗前均有一定改善(P<0.05),咯痰方面较治疗前比较差异无统计学意义。治疗组则全部症状积分方面均较治疗前有显著改善作用(P<0.05),见表4。
表4 治疗前后症状积分比较Tab.4 Comparison of symptom scores before and after treatment ±s,min

表4 治疗前后症状积分比较Tab.4 Comparison of symptom scores before and after treatment ±s,min
注:与对照组比较,△P <0.05;同组自身前后比较,*P <0.05
项目咳嗽咯痰喘息胸闷气短哮鸣对照组治疗前4.22±1.71 4.78±1.38 4.94±1.22 5.06±1.22 2.78±0.42 2.81±0.40治疗后2.38±1.15*4.17±2.10 2.44±1.08*2.45±1.09*1.53±0.56*0.94±0.58*治疗组治疗前4.44±1.44 4.89±1.62 5.00±1.22 5.33±0.96 2.72±0.45 2.86±0.35治疗后1.67±1.01△*4.11±1.90 1.61±1.05△*1.50±1.21△*1.28±0.45△*0.58±0.50△*
2.3 肺功能比较两组治疗前肺功能比较差异无统计学意义(P>0.05)。对照组治疗后肺功能各项指标未见明显改善,治疗组肺功能治疗后较对照组变化显著(P<0.05),且组内前后比较发现,治疗组治疗前后自身比较差异具有统计意义(P<0.05),而对照组前后比较改变不显著(P>0.05)。见表5。
表5 治疗前后肺功能比较Tab.5 Comparison of lung function before and after treatment ±s

表5 治疗前后肺功能比较Tab.5 Comparison of lung function before and after treatment ±s
注:与对照组比较,△P <0.05;同组自身前后比较,*P <0.05
组别对照组组治疗组例数36 36时间治疗前治疗后治疗前治疗后FEV1(L)1.06±0.47 1.12±0.58 1.05±0.42 1.31±0.38△*FVC(L)2.08±0.75 2.06±0.69 1.98±0.69 2.40±0.68△*
2.4 炎症因子变化比较两组治疗前炎症因子IL-8、TNF-α变化比较差异无统计学意义(P>0.05)。对照组治疗后各项炎症因子水平较治疗前有所下降,但差异无统计学意义(P>0.05)。治疗组各项指标前后变化较为显著,且同组治疗前后比较差异均有统计意义(P<0.05)。见表6。
表6 治疗前后炎症因子变化比较Tab.6 Comparison of changes in inflammatory factors before and after treatment ±s

表6 治疗前后炎症因子变化比较Tab.6 Comparison of changes in inflammatory factors before and after treatment ±s
注:与对照组比较,△P <0.05;同组自身前后比较,*P <0.05
组别对照组治疗组时间治疗前治疗后治疗前治疗后TNF-α(ng/mL)1.99±0.61 1.96±0.49 2.01±0.56 1.38±0.31△*IL-8(μg/L)0.39±0.05 0.26±0.05*0.40±0.05 0.19±0.08△*
2.5 生活质量积分评价两组治疗前CAT 评分、mMRC 分级比较差异无统计学意义(P>0.05)。对照组治疗后CAT 评分、mMRC 分级未见明显改善,而治疗组患者CAT 评分、mMRC 分级治疗前后比较差异均有统计学意义(P<0.05)。见表7。
表7 治疗前后生活质量积分比较Tab.7 Comparison of quality of life scores before and after treatment ±s
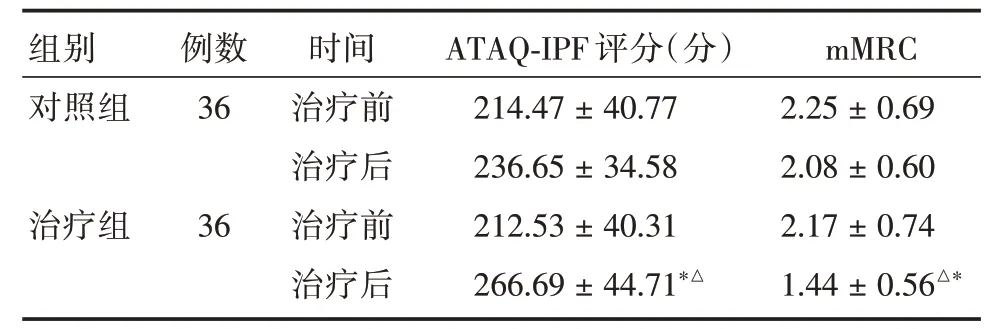
表7 治疗前后生活质量积分比较Tab.7 Comparison of quality of life scores before and after treatment ±s
注:与对照组比较,△P <0.05;同组自身前后比较,*P <0.05
组别对照组治疗组例数36 36时间治疗前治疗后治疗前治疗后ATAQ-IPF 评分(分)214.47±40.77 236.65±34.58 212.53±40.31 266.69±44.71*△mMRC 2.25±0.69 2.08±0.60 2.17±0.74 1.44±0.56△*
3 讨论
Nac 是一种痰液裂解药物,可使患者粘稠的痰液分解裂化,从而易于咳出,还可减轻肺组织的损伤,通过抑制磷脂酶和炎症反应信号通路,发挥强大的抗炎功能,从而改善IPF 急性发作症状[8]。研究[9]显示,Nac 可以有效降低机体的TNF-α、CRP等因子水平,抑制急性发作期患者的呼吸道炎症反应。另外Nac 还可以提高机体还原性谷胱甘肽的水平,减轻自由基的产生及血管通透性,调节氧化/抗氧化平衡,还能抑制TGF-β的活性,减少在肺纤维化中影响深远的成纤维细胞的转化,从而延缓肺纤维的进展[10]。虽然Nac 在肺纤维化治疗中具有强大的抗炎、抗氧化作用,且能一定程度上延缓肺功能下降的速度[11],但在Nac 单药应用治疗并不能降低肺纤维化患者的短期的病死率[10]。
糖皮质激素具有强大的抗炎作用,目前广泛用于慢性阻塞性肺疾病、支气管哮喘、隐源性机化性肺炎等呼吸系统疾病,但是对于治疗肺纤维化的效果不明显,原因有可能是IPF 患者相对COP 等疾病患者,肺组织中糖皮质激素受体-α(GR-α)表达显著降低[12],而且单纯应用糖皮质激素非但不能抑制肺纤维的进展,甚至还带来较多的不良反应[13]。基于目前临床实际治疗IPF 时,NAC 或糖皮质激素单药应用疗效尚无法令人满意的现状,许多研究进一步探讨了糖皮质激素联合NAC 的疗效及安全性评价,研究结论均支持小剂量糖皮质激素联合NAC,相较于NAC 单药治疗,可显著减慢肺功能下降速率,改善生活质量[8,14-15],并且还有更为明显的抗纤维化作用[14]。其机制可能与联合用药能上调微囊蛋白1、降低肿瘤坏死因子-α、转化生长因子-b1 和血小板衍生生长因子的表达有关[16]。
IPF 患者由于存在进行性加重的呼吸困难、低氧血症等症状,运动耐力明显受限;因呼吸困难、低氧血症等使得患者运动减少,导致骨骼肌群萎缩。骨骼肌摄氧量下降,其功能受限又引起通气量不足,进一步加剧低氧血症,使患者的摄氧需求增加,如此恶性循环。同时存在的呼吸肌功能障碍,肌群运动功能受损,营养不良及焦虑抑郁情绪,更加重了患者的呼吸困难,降低了生存质量[17],是导致呼吸衰竭进展的主要因素[18],因而及早有效的阻止这种恶性循环,改善患者疾病状态,提高生活质量,是IPF 肺康复中的重要命题,并提出肺康复主要内容包括[7]:系统评估、呼吸生理治疗,肌肉训练(全身性运动和呼吸肌锻炼),营养支持,精神治疗和教育。研究发现,有氧间歇训练可明显地提高IPF 患者的运动耐力、呼吸功能、腿部力量,明显改善体重、体脂率以及生活质量[19-21],还可能延缓肺功能的下降[20]。有氧训练能对抗肺部炎症以及纤维化的发生进展,其机制可能与(5-羟色胺)5-HT/Akt 信号传导通路的减弱有关[22]。近期指南也明确提出了联合药物疗法的前提下,大部分研究结果提示肺康复治疗能改善患者6 分钟步行距离、呼吸困难评分和生活质量评分,但肺康复治疗的效果持续较短。轻度和重度IPF 患者是否也有效,以及如何持续维持肺康复治疗的有益作用,都需要进一步的研究证据。本研究重点正是紧抓IPF 综合疗法这一重要命题,开展了药物疗法结合有氧抗阻肺康复训练,在采用已知具有明确临床疗效方案的小剂量糖皮质激素联合Nac 药物治疗基础上,配合肺康复疗法,并维持6 个月的长期临床疗效观察,探讨综合方案治疗IFP 患者的有效性及安全性,及其可能的有效机制,旨在为综合性肺康复治疗方案的制定提供依据,促进药物联合肺康复在国内的推广和应用。
本研究结果显示:经小剂量糖皮质激素、Nac联合有氧抗阻肺康复疗法的综合性肺康复疗法治疗后,患者临床疗效、症状积分、生活质量评估、肺功能参数等改善较对照组均有显著改善,且其TNF-α和IL-8 等炎症因子水平显著低于观察组,提示了小剂量糖皮质激素、Nac 联合有氧抗阻肺康复疗法的综合性疗法治疗IPF 可有效改善患者的炎症反应状态和免疫功能,提高生活质量,疗效满意,IPF 患者采用该综合疗法安全性良好,临床具有一定获益,值得进一步研究推广。
