慢性亚硝酸盐胁迫对子二代中华鲟生长、抗氧化及免疫指标的影响
2020-11-10姚金忠张德志唐大明张厚本
管 敏,姚金忠,张德志,唐大明,张厚本
(中国长江三峡集团有限公司中华鲟研究所,三峡工程鱼类资源保护湖北省重点实验室,湖北宜昌 443100)
亚硝酸盐是广泛存在于养殖水体中的一种物质,它是自然环境中细菌硝化作用和脱氮作用过程中一种重要的中间产物[1]。在鱼类的养殖过程中,高蛋白残饵的溶解、高含氮排泄物的排放及硝化作用受阻等均能导致水体中亚硝酸盐的不断累积[2-3]。亚硝酸盐通过被吸收和扩散等方式进入鱼类体内[4],不仅能引起鱼体痉挛、换气过度等一系列的生理反应[5],还能严重降低鱼类血液的载氧能力,导致多个器官受损、病变[6]。此外,亚硝酸盐还能抑制鱼类免疫系统的功能,导致鱼类对病原菌的敏感性增加[7],已成为制约鱼类健康养殖的重要因素之一。
中华鲟(Acipenser sinensis)隶属鲟科,鲟属,是大型溯河产卵洄游性鱼类,属国家一级重点保护动物。20世纪70年代以来,由于受到人类活动的影响,中华鲟的自然种群严重衰退[8-9]。在此背景下,国内多家研究机构开展了大量关于中华鲟物种保护方面的研究工作。但在中华鲟的迁地养殖过程中,经常出现养殖水体中亚硝酸盐含量长期超标的现象,这会对中华鲟造成一定程度的慢性胁迫,致其生长缓慢,爆发病害,甚至死亡,已对中华鲟的健康养殖造成很大影响。目前,有关环境胁迫对中华鲟生理健康影响的研究报道已有不少,主要集中在饥饿胁迫[10-11]、拥挤胁迫[10,12]、温度胁迫[11-13]及慢性氨氮胁迫[14]等方面,但关于慢性亚硝酸盐胁迫对子二代中华鲟抗氧化能力和免疫能力影响的研究尚未见报道。本实验通过研究慢性亚硝酸盐胁迫条件下子二代中华鲟血清、肝脏抗氧化和免疫指标的变化情况,旨在探讨慢性亚硝酸盐胁迫对其代谢水平和生理状况的影响,从而为深入研究中华鲟应激反应的机理提供理论依据,为子二代中华鲟的健康养殖提供参考依据。
1 材料与方法
1.1 实验材料
试验鱼为湖北省宜昌市中华鲟研究所2014年全人工繁殖所得的子二代中华鲟(3+龄)。随机挑选规格一致、体质健康子二代中华鲟30尾,体质量为(2.45±0.14)kg,体长为(82.40±1.60)cm。
1.2 实验设计
实验在5个直径4.0 m、水深0.8 m的实验池中进行,亚硝酸盐浓度设置为0.01 mg·L-1(对照组)、0.20 mg·L-1(低浓度组)、0.40 mg·L-1(中浓度组)、0.80 mg·L-1(中高浓度组)、1.60 mg·L-1(高浓度组),每个浓度组6尾鱼。实验开始前,用120 mg·L-1MS-222将中华鲟进行麻醉后称重,并测其全长、体长,最后将其转至实验池中暂养,3 d后开始实验。暂养和实验期间,溶解氧6.1~7.2 mg·L-1,pH 7.3~7.6,氨氮浓度<0.05 mg·L-1;暂养期间水温(16.5±0.6)℃,实验期间水温16.7~21.8℃。亚硝酸盐浓度用10 g·L-1的NaNO2母液进行调配,实验池水每24 h换一次;每天9∶00投喂一次,投喂量为鱼体质量的1%,摄食完成后及时清除残饵,并观察记录鱼的摄食及活动状态;若出现试验鱼死亡现象,及时记录并采集其体质量、全长和体长等生物学数据;实验持续60 d。
1.3 样品的采集和处理
取样前,用120 mg·L-1MS-222将实验鱼进行麻醉,然后抽血,3 500 r·min-1离心10 min,取上层血清保存于2 mL离心管中,经液氮快速冷冻后,-70℃保存待测。将试验鱼解剖,将内脏团和肝脏称重,然后取肝脏并将其切成小块,置于2 mL离心管中,经液氮快速冷冻后,-70℃保存待测。
1.4 测定指标
1.4.1 生长指标
计算成活率(SR)、增重率(WGR)、特定生长率(SGR)、肝体比(HSI)、肥满度(CF)和脏体比(VSI),计算公式为:


式中,Nf为终末鱼尾数;Ni为初始鱼尾数;Wt为终末体质量(g);W0为初始体质量(g);t为实验天数(d);Wb为每尾鱼体质量(g);L为每尾鱼体长(cm);Wh为肝脏质量(g);We为内脏团质量(g)。
1.4.2 抗氧化指标和免疫指标的测定
抗氧化指标包括超氧化物歧化酶(SOD)活性、过氧化氢酶(CAT)活性、总抗氧化能力(TAOC)活性、谷胱甘肽(GSH)含量、丙二醛(MDA)含量;免疫指标包括溶菌酶(LZM)活性和免疫球蛋白M(IgM)含量。所有指标的测定采用南京建成生物工程研究所研制的试剂盒,具体方法参见其说明书。
1.5 数据统计
实验数据用Spss16.0和Excel 2016软件进行统计分析,利用单因素方差分析(one-way ANOVA)和Duncan’s多重比较检验慢性亚硝酸盐胁迫对各项指标影响的显著性,差异的显著性以P<0.05为标准,结果以平均值±标准差(Mean±SD)表示。
2 结果与分析
2.1 慢性亚硝酸盐胁迫对子二代中华鲟存活及生长性能的影响
实验结果显示,在持续60 d的慢性亚硝酸盐胁迫中,对照组、低浓度组、中浓度组和中高浓度组试验鱼的成活率为100%,但高浓度组试验鱼出现死亡现象,死亡率为33.33%,死亡鱼体特征为体表发白,黏液增多,口裂张开,吻端和肛门充血(图1)。随着亚硝酸盐浓度的升高,子二代中华鲟的增重率和特定生长率呈逐渐降低的趋势,中浓度组、中高浓度组和高浓度组与对照组均存在显著性差异(P<0.05)。在增重率方面,中浓度组、中高浓度组、高浓度组分别是对照组的54.85%、28.19%和12.77%;在特定生长率方面,中浓度组、中高浓度组、高浓度组分别是对照组的55.17%、31.03%和13.79%;此外,亚硝酸盐浓度的升高对试验鱼的肝体比、脏体比和肥满度未产生显著性的影响(P>0.05)。

图1 高浓度组死亡的子二代中华鲟Fig.1 Dead F2 Acipenser sinensis of high concentration group
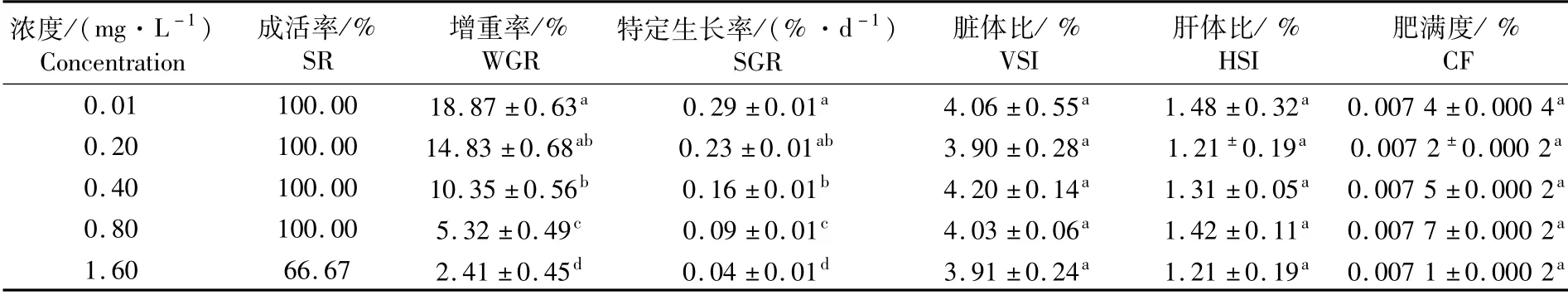
表1 慢性亚硝酸盐胁迫对子二代中华鲟生长指标的影响Tab.1 Effect of chronic nitrite stress on grow th index of F2 Acipenser sinensis
2.2 慢性亚硝酸盐胁迫对子二代中华鲟抗氧化指标的影响
2.2.1 SOD活性
在慢性亚硝酸盐胁迫条件下,各浓度组子二代中华鲟血清和肝脏SOD活力见图2。随着亚硝酸盐浓度的升高,试验鱼血清和肝脏SOD活性呈逐渐降低的趋势。中浓度组、中高浓度组、高浓度组血清SOD活性显著低于对照组(P<0.05),较对照组分别下降21.81%、28.31%和34.06%;中高和高浓度组肝脏SOD活性也显著低于对照组(P<0.05),较对照组分别下降21.07%和23.35%。
2.2.2 CAT活性
子二代中华鲟血清和肝脏CAT活性变化如图3所示。亚硝酸盐浓度越大,试验鱼血清和肝脏的CAT活性越小。对照组血清和肝脏CAT活性分别为1.20 U·mL-1和15.61 U·mg-1prot,其血清CAT活性分别是低浓度组、中浓度组、中高浓度组和高浓度组的1.19、1.40、1.72和2.09倍,其肝脏CAT活性分别是低浓度组、中浓度组、中高浓度组和高浓度组的1.09、1.14、1.16和1.55倍;其中,高浓度组与对照组之间存在显著性差异(P<0.05),其他各组之间差异不显著(P>0.05)。
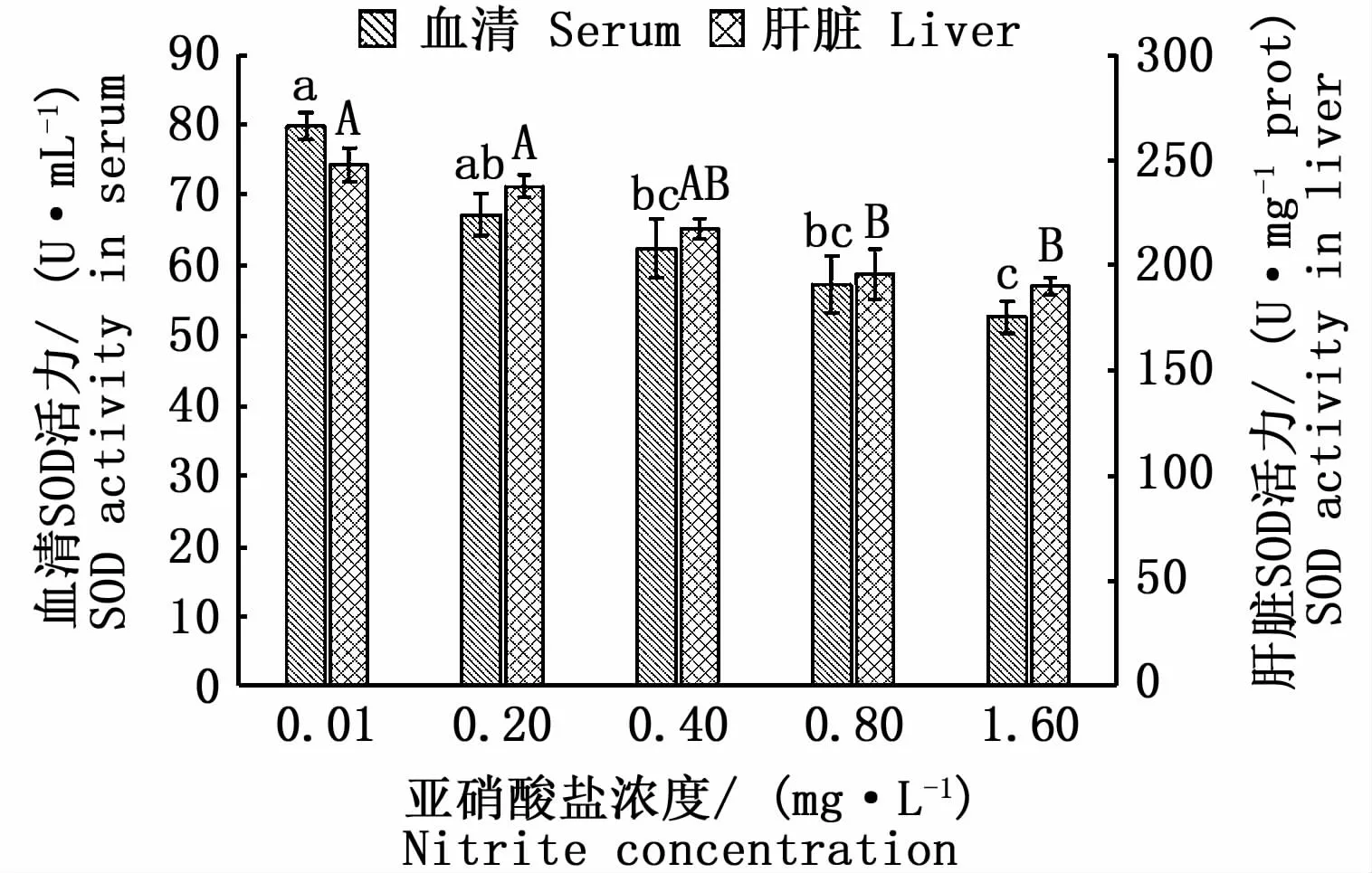
图2 慢性亚硝酸盐胁迫对子二代中华鲟血清、肝脏SOD活力的影响Fig.2 Effect of chronic nitrite stress on SOD activity of F2 Acipenser sinensis
2.2.3 GSH含量
子二代中华鲟血清和肝脏GSH含量变化如图4所示。各组试验鱼血清和肝脏GSH含量由大到小依次为对照组、低浓度组、中浓度组、中高浓度组和高浓度组,其中,中浓度组、中高浓度组、高浓度组血清和肝脏GSH含量及低浓度组肝脏GSH含量均与对照组存在显著差异(P<0.05)。

图3 慢性亚硝酸盐胁迫对子二代中华鲟血清、肝脏CAT活力的影响Fig.3 Effect of chronic nitrite stress on CAT activity of F2 Acipenser sinensis
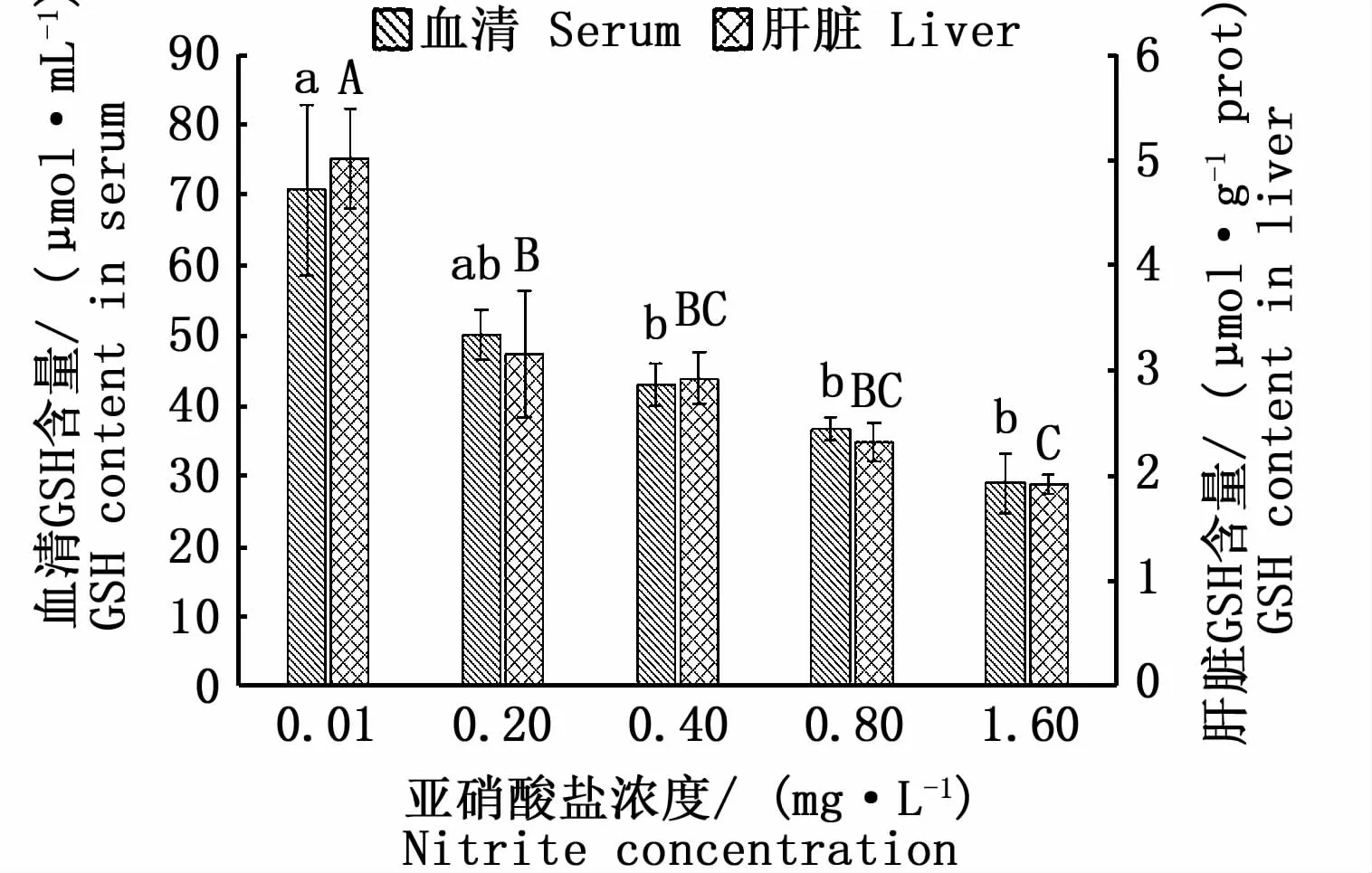
图4 慢性亚硝酸盐胁迫对子二代中华鲟血清、肝脏GSH含量的影响Fig.4 Effect of chronic nitrite stress on GSH content of F2 Acipenser sinensis
2.2.4 T-AOC活力
慢性亚硝酸盐胁迫显著降低了子二代中华鲟血清和肝脏T-AOC活性(图5)。低浓度组、中浓度组、中高浓度和高浓度组血清T-AOC活性较对照组分别降低16.84%、26.83%、39.63%和52.14%,其中,中浓度组、中高浓度组、高浓度组与对照组存在显著性差异(P<0.05);低浓度组、中浓度组、中高浓度组和高浓度组肝脏TAOC活性较对照组分别降低32.09%、46.31%、50.11%和59.69%,低浓度组、中浓度组、中高浓度组、高浓度组与对照组均存在显著性差异(P<0.05)。

图5 慢性亚硝酸盐胁迫对子二代中华鲟血清、肝脏T-AOC活力的影响Fig.5 Effect of chronic nitrite stress on T-AOC activity of F2 Acipenser sinensis
2.2.5 MDA含量
随着亚硝酸盐浓度的增大,子二代中华鲟血清和肝脏MDA含量逐渐增加(图6)。当亚硝酸盐浓度达到1.6 mg·L-1时,子二代中华鲟的血清和肝脏MDA含量分别升高至10.69 nmol·mL-1和11.03 nmol·mg-1prot,分别是对照组血清和肝脏MDA含量的1.99倍和1.56倍(P<0.05)。此外,高浓度组血清MDA含量显著高于低浓度组(P<0.05),中浓度组和中高浓度组肝脏MDA含量与对照组均存在显著性差异(P<0.05)。
2.3 慢性亚硝酸盐胁迫对子二代中华鲟免疫指标的影响
2.3.1 LZM活力
子二代中华鲟血清和肝脏LZM活性随亚硝酸盐浓度升高而显著降低(图7)。与对照组相比,高浓度组试验鱼血清和肝脏LZM活性分别降低30.02%和48.40%,且两组之间存在显著性差异(P<0.05);中浓度组、中高浓度组、高浓度组肝脏LZM活性与对照组、低浓度组均存在显著性差异(P<0.05)。

图6 慢性亚硝酸盐胁迫对子二代中华鲟血清、肝脏MDA含量的影响Fig.6 Effect of chronic nitrite stress on MDA content of F2 Acipenser sinensis

图7 慢性亚硝酸盐胁迫对子二代中华鲟血清、肝脏LZM活力的影响Fig.7 Effect of chronic nitrite stress on LZM activity of F2 Acipenser sinensis
2.3.2 IgM含量
子二代中华鲟血清和肝脏IgM含量变化情况见图8。各组试验鱼血清和肝脏IgM含量依次表现为对照组>低浓度组>中浓度组>中高浓度组>高浓度组,中浓度组、中高浓度组、高浓度组血清IgM含量显著低于对照组(P<0.05),较对照组分别降低22.54%、29.07%和40.91%。中高浓度组和高浓度组肝脏IgM含量显著低于对照组(P<0.05),较对照组分别降低26.26%和41.54%。
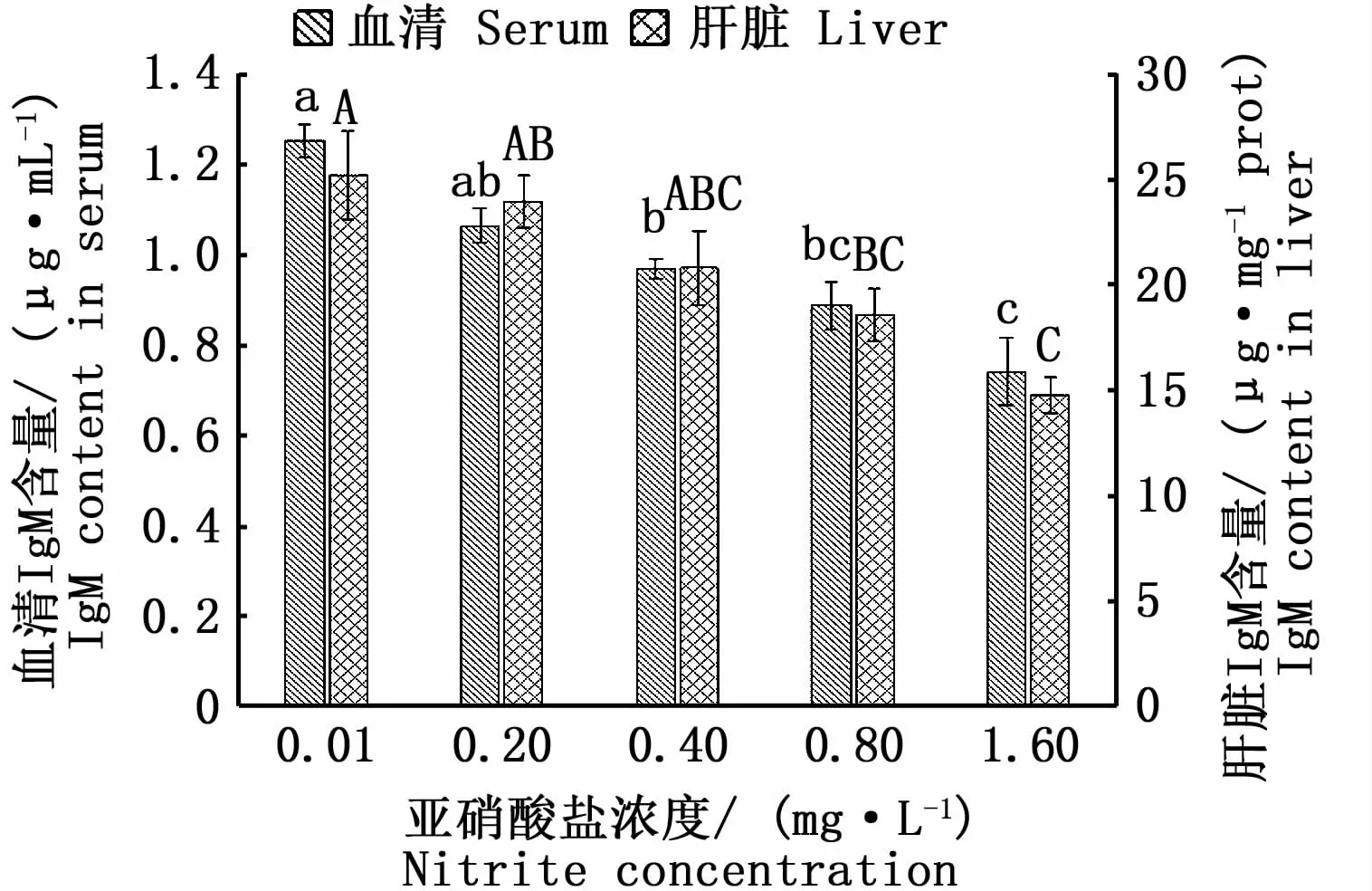
图8 慢性亚硝酸盐胁迫对子二代中华鲟血清和肝脏IgM含量的影响Fig.8 Effect of chronic nitrite stress on IgM content of F2 Acipenser sinensis
3 讨论
3.1 慢性亚硝酸盐胁迫对子二代中华鲟生长性能的影响
养殖水体中亚硝酸盐浓度的高低是评价其水质好坏的重要指标之一。研究发现,水体中亚硝酸盐浓度的升高会对鱼类的行为产生一定影响,如呼吸频率增加、游动变缓、摄食频率下降[15-16],本实验的研究结果与之相同。此外,慢性亚硝酸盐胁迫还造成了子二代中华鲟的死亡,高浓度组试验鱼的成活率仅为66.67%,试验鱼死后其鳃盖和口裂多呈张开状态,原因可能为亚硝酸盐胁迫导致鱼体血液红细胞皱缩、变形、破裂[17],红细胞和血红蛋白的数量下降[18],高铁血红蛋白数量急剧升高,从而导致鱼体死于氧缺乏症[19]。
大量研究表明,慢性亚硝酸盐胁迫对鱼类的生长会产生显著的抑制作用,如斑点叉尾鮰[20](Ietalurus punetaus)、澳 洲 银 鲈[21](Bidyanus bidyanus)、吉富罗非鱼[22](Oreochromis niloticus)等,本研究的实验结果与之相同。本研究中,随着亚硝酸盐浓度的增加,子二代中华鲟的增重率和特定生长率呈逐渐降低的趋势,这可能是由两方面的原因造成的,一是亚硝酸盐胁迫会导致鱼类的食欲下降,降低其摄食率和饲料转化率,从而引起鱼体生长速率下降;二是亚硝酸盐导致鱼体处于应激状态,血液的携氧能力下降,机体组织缺氧,鱼体消耗大量糖类、脂肪、蛋白质来为抵御应激提供能量,减少了用于生长的能量分配[4,16,22-23]。但SIIKAVUOPIA和SATHER[24]将大西洋鳕(Gadusmorhua)置于1.0、2.5、5.0 mg·L-1的亚硝酸盐溶液中胁迫93 d后,发现试验鱼的平均体质量显著低于对照组,但饵料系数、摄食率与对照组之间没有显著性差异,这可能与鱼的种类、规格及胁迫程度有关。
3.2 慢性亚硝酸盐胁迫对子二代中华鲟抗氧化指标的影响
亚硝酸盐胁迫会导致鱼体产生大量自由基(ROS),对重要的组织器官造成损伤[16,25]。生物体内存在可清除过多活性氧ROS的抗氧化防御体系,主要包括抗氧化酶系统和非酶促系统,其中,超氧化物歧化酶(SOD)和过氧化氢酶(CAT)就是抗氧化防御体系中非常重要的功能酶[26],二者相互关联,可联合清除ROS,其活性的下降标志着机体清除ROS的能力下降[27]。本研究中,慢性亚硝酸盐胁迫显著降低了子二代中华鲟肝脏SOD和CAT活性,这与鲫[3](Carassius auratus)、鲤[28](Cyprinus carpio)和红鳍东方鲀[29](Takifugu rubripes)的研究结果相同,其原因可能与亚硝酸盐胁迫导致酶合成途径受阻有关[30]。
谷胱甘肽(GSH)是一种低分子ROS清除剂[31],是清除ROS非常重要的非酶抗氧化物质[32],而丙二醛(MDA)是ROS与脂质发生过氧化反应的产物,它可以反映细胞受ROS攻击的程度,从而间接反映机体抗氧化能力的强弱及组织细胞受损伤的严重程度[31,33]。本研究中,慢性亚硝酸盐胁迫显著降低了子二代中华鲟血清和肝脏的GSH含量,GSH的消耗主要与GSH作为谷胱甘肽过氧化酶(GPX)的底物参与清除过氧化氢的解毒途径有关,还与其直接参与高铁血红蛋白的还原过程有关[34]。此外,子二代中华鲟血清和肝脏MDA含量随亚硝酸盐浓度的升高而显著增加,其原因主要是鱼体抗氧化防御体系不能消除体内过多的ROS,导致其与细胞发生大量脂质过氧化反应,进而使得MDA在鱼体中大量积累。
总抗氧化能力(T-AOC)的大小是衡量机体抗氧化系统功能的综合性指标,它可以反映机体抗氧化防御系统应对外来胁迫的能力[35]。本实验中,随着亚硝酸盐浓度的升高,子二代中华鲟血清和肝脏T-AOC活性显著降低,这与谭树华等[3]和汪家鑫等[29]的研究结果一致。然而也有研究得出不同结论,吴宁[34]研究发现持续14 d的亚硝酸盐胁迫导致团头鲂(Megalobrama amblycephala)抗氧化酶活性显著升高,这主要是由于鱼类对亚硝酸盐胁迫的生理响应与胁迫时间、暴露浓度及溶氧水平等密切相关[3,15,34]。
3.3 慢性亚硝酸盐胁迫对子二代中华鲟免疫指标的影响
溶菌酶(LZM)和免疫球蛋白M(IgM)是鱼体非常重要的免疫因子,前者可以破坏革兰氏阳性菌细胞壁中的肽聚糖,从而瓦解细菌细胞[36];后者具有强大的抗感染作用。葛红星等[37]研究认为,亚硝酸盐慢性胁迫显著降低了凡纳滨对虾(Litopenaeus vannamei)的免疫力,增加了其对副溶血弧菌的易感性;孟顺龙等[38]、陈家长等[39]研究发现亚硝酸盐可显著降低罗非鱼(GIFTOreochromis niloticus)的溶菌酶活性,导致其机体免疫力下降,对海豚链球菌的易感性增加,且死亡率和暴露时间呈显著正相关;葛立安等[40]也发现,在受到0.32 mg·L-1亚硝酸盐胁迫15 d后,异育银鲫(Carassius auratus gibelio)血清溶菌酶活性、巨噬细胞吞噬活性等显著下降,本研究的结果与之基本一致。本研究中,随着亚硝酸盐胁迫浓度的升高,子二代中华鲟血清和肝脏LZM活性及IgM含量均表现为逐渐降低的趋势。这表明慢性亚硝酸盐胁迫降低了鱼体溶菌酶的活性及IgM的合成,对鱼体的免疫功能产生了显著的抑制作用,降低了鱼体的免疫力,其原因可能为鱼类受环境胁迫作用时,大量免疫抑制因子会在外围淋巴组织中产生,并逐渐被释放到血液中,从而影响巨噬、淋巴细胞的含量及活性,进而抑制免疫应答[41]。
4 小结
本研究发现,持续60 d的慢性亚硝酸盐胁迫导致子二代中华鲟的特定生长率和增重率显著下降,肝脏SOD活性、CAT活性、T-AOC活性、LZM活性、GSH含量及IgM含量显著下降,MDA含量显著升高,这表明慢性亚硝酸盐胁迫对中华鲟的生长、抗氧化能力和免疫能力产生了显著的不利影响。当亚硝酸盐浓度为0.2 mg·L-1时,中华鲟的增重率、特定生长率与对照组相比均无显著性变化,其全部血清抗氧化、免疫指标及肝脏SOD活性、CAT活性、LZM活性、MDA含量、IgM含量等指标与对照组相比也均未出现显著性变化;而当亚硝酸盐浓度>0.2 mg·L-1时,中华鲟的增重率、特定生长率均显著低于对照组,其血清SOD活性、T-AOC活性、GSH含量、IgM含量及肝脏T-AOC活性、LZM活性、GSH含量、MDA含量等指标也均显著低于对照组,这表明当亚硝酸盐浓度≤0.2 mg·L-1时,亚硝酸盐胁迫对中华鲟生长、抗氧化及免疫指标基本无实质影响,但当亚硝酸盐浓度>0.2 mg·L-1时,亚硝酸盐胁迫已对中华鲟血清、肝脏的抗氧化及免疫指标造成了显著的不利影响。所以,在中华鲟的日常养殖过程中,养殖水体中亚硝酸盐浓度应至少≤0.2 mg·L-1,以避免其对中华鲟造成损伤。
