长蛸oct-GnRH基因的cDNA 克隆及组织表达分析
2020-11-10朱之发王亚美陈四清杨珍珍李凤辉
朱之发,边 力,王亚美,陈四清,杨珍珍,李凤辉
(1.中国水产科学研究院黄海水产研究所,山东青岛 266071;2.上海海洋大学水产与生命学院,上海 201306;3.中国水产科学研究院东海水产研究所,上海 200090;4.青岛海洋科学与技术试点国家实验室,海洋渔业科学与食物产出过程功能实验室,山东青岛 266071)
在海洋资源逐年下降的情况下,开发新的海洋物种养殖尤为重要。开展新物种养殖首要任务是实现人工繁育,需了解该物种的繁殖特点,从而掌握繁殖的时间和环境条件。促性腺激素释放激素(GnRH)是由下丘脑分泌的十肽激素,是动物生殖过程中的关键激素之一。1971年,BABA等[1]和AMOSS等[2]首先从下丘脑分离出GnRH。在脊椎动物中,GnRH是下丘脑-垂体-性腺生殖轴(HPG)的关键神经肽,是生殖功能调节的核心。哺乳动物GnRH最初是从猪和羊的大脑中分离出[1,3],在非哺乳脊椎动物中,又分离出13种GnRH分子形式[4-6]。无脊椎动物中的GnRH最初是使用哺乳动物和鸡的GnRH抗血清,通过异源免疫组化技术获得的[7-11]。尽管在无脊椎动物中缺乏GnRH的分子特征,但在章鱼(头足纲八腕目)神经系统检测到鸡的GnRH-I免疫反应[10-11]。目前已从真蛸的中枢神经系统中分离出具有脊椎动物GnRHs结构的神经肽,克隆到编码受体蛋白的cDNA,命名为oct-GnRH,属于GnRH神经肽家族[12]。但对于长蛸oct-GnRH基因克隆及其特异性表达尚未见相关报道。
长蛸俗称大蛸、长腿蛸等,属于八腕目(Octopoda),蛸科(Octopodidae),蛸属,分布于韩国、中国、日本和俄罗斯库页岛沿海水域[13-14],喜穴居,肉质鲜嫩,蛋白质丰富且营养均衡[15],可食用部分占身体的90%以上,可加工成干制品,食用方式多样[8],是我国沿海重要的经济蛸类[16]。长蛸作为重要的经济物种,近年来我国开始对其进行人工养殖研究,但目前对于长蛸的繁育机制尚未完全了解,处于探究阶段,导致长蛸的工厂化养殖与苗种繁育较为困难。GnRH是控制章鱼生殖的关键神经肽[12],因此开展GnRH基因和表达的研究,可为长蛸人工养殖与苗种繁育提供理论支持。本研究运用cDNA末端快速扩增和实时荧光定量PCR技术,获得oct-GnRH基因cDNA的序列,分析GnRH基因在长蛸体内各器官的表达水平,旨在完善长蛸的分子与生殖生物学信息,为研究长蛸脑部结构功能及生殖相关神经肽的分泌特征提供数据支持,为实现长蛸工厂化繁育提供参考。
1 材料与方法
1.1 组织样品制备
取性成熟长蛸,观察其右边第3条腕,确定其性别,雄性长蛸和雌性长蛸各取3尾,体质量为152~189 g,解剖后分别取食道上神经团、食道下神经团、视叶区、吸盘、腕肌肉、轴神经索、视网膜、心脏、肾脏、肝胰脏、鳃、前唾液腺、后唾液腺、卵巢、缠卵腺、精巢、精颊囊、前列腺、食道、胃、胃盲囊、肠、胴部肌肉、皮肤,立即放入含有RNA保存液的2.0 mL离心管中,液氮速冻后,将样品保存于-80℃超低温冰箱,待用。
1.2 试剂与试剂盒
PremixTaqTM(TaKaRaTaqTMVersion 2.0)、大肠杆菌(Escherichia coli)DH5α菌株感受态细胞、pMDTM18-T Vector试剂盒、RACE试剂盒(SMARTTMRACE cDNA Amplification RACE)、反转录试剂盒(PrimeScriptTMRT reagent Kit with gDNA Eraser)、DNA凝胶回收试剂盒(TaKaRa MiniBEST Agarose Gel DNA Extraction Kit Ver.4.0)和SYBR®Premix ExTaqTM购于宝生物工程(大连)有限公司。
1.3 总RNA提取及cDNA合成
本研究采用Trizol法分别提取雌雄长蛸各组织的总RNA,取2μL总RNA用于1.0%(W/V)琼脂糖凝胶电泳检测所提取RNA的完整性,取1 μL总RNA用于紫外分光光度计(NanoDrop 2 000 Thermo Scientific,USA)检测所提取RNA的纯度及浓度。利用反转录试剂盒合成第一链cDNA,利用RACE试剂盒分别合成5′与3′RACE cDNA模板,所有操作根据试剂盒说明书进行。
1.4 GnRH基因核心序列克隆
根据长蛸已知的GnRH保守序列和NCBI GenBank中真蛸GnRH基因(GenBank登录号:AB037165),通过Primer 5.0设计引物GnRH F1和GnRH R1(表1),以食道下神经团组织的cDNA为模板扩增核心序列。PCR反应体系(20 μL)为:PremixTaqTM10μL、GnRH F1(10 μmol·L-1)0.5μL、GnRH R1(10μmol·L-1)0.5μL、cDNA(1μg·μL-1)1μL及ddH2O 8 μL。PCR反应条件:94℃5 min;94℃30 s,58℃30 s,72℃60 s,35个循环;72℃10 min。扩增产物经1.0%(W/V)琼脂糖凝胶电泳检测,在DUT-48超薄型紫外切胶仪中切胶,经DNA凝胶回收试剂盒回收纯化,克隆到pMD18-T Vector中,转化到DH5α感受态细胞中过夜培养。挑取阳性单克隆,经菌落PCR鉴定,筛选目的菌液送至华大基因公司测序。
1.5 GnRH基因全长克隆
根据测序所得核心序列设计特异性引物3′RACE 1、5′RACE 1、3′RACE 2与5′RACE 2,通过巢式PCR进行3′和5′端RACE扩增。3′端扩增:以3′RACE cDNA为模板,分别加入接头引物UPM与引物3′RACE 1组合、接头引物NUP与引物3′RACE 2组合扩增3′端基因序列;5′端扩增:分别加入接头引物UPM与引物5′RACE 1组合、接头引物NUP与引物5′RACE 2组合扩增5′端基因序列。
PCR反应体系(20μL):PremixTaqTM10μL、3′或5′特异性引物0.5μL、UPM或NUP 0.5μL、RACE-cDNA 1μL及ddH2O 8μL。PCR反应条件:94℃5min;94℃30 s,60℃30 s,72℃60 s,35个循环;72℃10 min。将PCR产物进行检测、胶回收、纯化、连接与转化培养。挑取阳性单克隆,经菌落PCR鉴定后送至华大基因公司测序。
1.6 GnRH基因序列分析
使用软件Contig Express软件对GnRH基因的测序结果进行拼接、验证,利用ORF Finder(http://www.ncbi.nlm.nih.gov/projects/gorf/orfig.cgi)预测GnRH基因的开放阅读框。利用ExPASy(https://web.expasy.org/protparam/)、SMART(http://smart.emblheidelberg.de/)、Signal 4.1(http://www.cbs.dtu.dk/services/SignalP/)和NCBI(http://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)在线生物学软件分析GnRH编码蛋白的基本物理性质、信号肽、跨膜结构及结构域。用NCBI搜索同源蛋白序列,并使用软件DNAMAN对其进行蛋白序列的多重比较,利 用MEGA5.2[12]软 件,采 用 邻 接 法(neighbor-joining)构建系统进化树。
1.7 实时荧光定量PCR
根据GnRH基因的核心序列,通过Primer5.0设计荧光定量特异性引物GnRH F/R,β-actin F/R作为内参,以长蛸不同组织的cDNA为模板,使用Mastercycler epgradient S realplex4实时荧光定量PCR仪(Eppendorf,德国),采用2-ΔΔCt的计算方法分析GnRH基因的相对表达量。20μL反应体系:SYBR®Premix ExTaqTM(2x)10μL、ROX Reference Dye II(50x)0.4μL、GnRH F(10μmol·L-1)0.4μL、GnRH F(10μmol·L-1)0.4 μL、cDNA(50ng·μL-1)2μL及ddH2O 6.8μL,反应程序:95℃5 min;95℃15 s,60℃30 s,40个循环;95℃15 s;60℃60 s;95℃15 s。
数据处理为GnRH基因相对表达量的平均值±标准差(Mean±SD),生物学重复n=3。使用SPSS22.0软件对实时荧光定量PCR结果进行单因素方差分析(one-way ANOVA)和Duncan多重比较,P<0.05表示差异显著,并用Excel2010软件作图。
2 结果与分析
2.1 oct-GnRH基因序列分析
长蛸oct-GnRH基因全长853 bp,命名为oct-GnRH,开放阅读框(ORF)长270 bp,编码89个氨基酸。5′-UTR和3′-UTR分别长153 bp和430 bp。经过ExPASy、SMART、Signal4.1和NCBI在线生物学软件分析,推断oct-GnRH的89个氨基酸分子量为9 989.51Da,理论等电点为7.77,7个负电荷残基,8个正电残基,1个跨膜结构处于13~32位编码20个氨基酸,1个信号肽处于1~31位编码31个氨基酸,2个结构域分别为7~86位编码80个氨基酸的BEN结构域和45~77位编码33个氨基酸的Pox-A3L结构域(图1)。
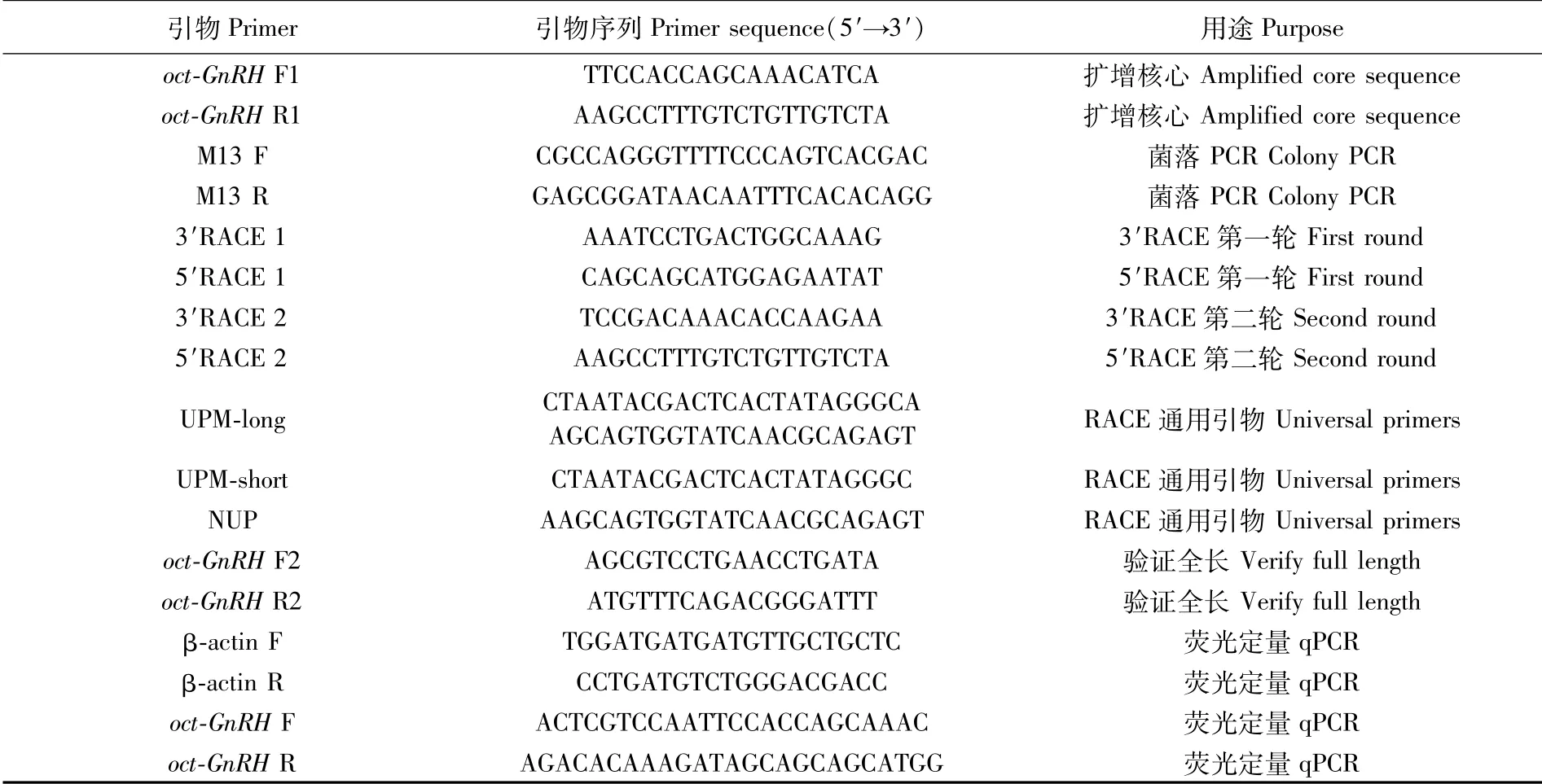
表1 GnRH基因的克隆及表达分析所用引物Tab.1 Primers used in cloning and characterizing the GnRH gene
2.2 氨基酸序列种间比对
在NCBI中,将本研究的长蛸oct-GnRH氨基酸序列与其他物种的GnRH基因编码的氨基酸序列进行比对,结果显示,该氨基酸序列与真蛸(Octopus valgaris)相似度最高(96.63%),其次是曼氏无针乌贼(Sepiella japonica)(74.16%)和剑尖枪乌贼(Uroteuthis edulis)(70.79%)。其他物种相似度较低:菲律宾帘蛤(Ruditapes philippinarum)(44.83%)、法螺(Charonia tritonis)(34.25%)、网纹野蛞蝓(Deroceras reticulatum)(31.03%)、澳大利亚绿边鲍鱼(Haliotis laevigata)(45.28%)、皱纹盘鲍(Haliotis discus hannai)(45.28%)、虾 夷 扇 贝(Mizuhopecten yessoensis)(40.32%)、鸭 嘴 海 豆 芽(Lingula anatina)(31.88%)、海蛞蝓(Aplysia californica)(31.36%)、耳鲍(Haliotis asinina)(35.23%)。利用DNAMAN软件对不同物种的氨基酸序列(表2)进行比对,结果显示(图2),包括长蛸在内的头足类均含有保守的BEN结构域和Pox-A3L结构域。

图1 长蛸oct-GnRH基因cDNA序列及其编码的氨基酸序列Fig.1 Nucleotide sequence and deduced am ino acid sequences of oct-GnRH gene of Octopusm inor

图2 长蛸oct-GnRH氨基酸序列的物种间比对Fig.2 M u ltip le alignments of oct-GnRH am ino acid sequences of Octopusm inor between species
2.3 系统进化树
利用MEGA 5.2软件对oct-GnRH基因编码的氨基酸序列进行系统进化分析。所选物种(表2)包括真蛸、曼氏无针乌贼、剑尖枪乌贼、菲律宾帘蛤、法螺、网纹野蛞蝓、澳大利亚绿边鲍鱼、皱纹盘鲍、虾夷扇贝、海蛞蝓、耳鲍、鸭嘴海豆芽。结果显示(图3),长蛸与同为蛸属的真蛸进化上关系最近,其次是同为头足纲乌贼目的曼氏无针乌贼与剑尖枪乌贼,随后是软体动物门中的腹足纲与瓣鳃纲等;腕足动物门无铰纲无穴目海豆芽科的鸭嘴海豆芽与长蛸的进化关系最远。
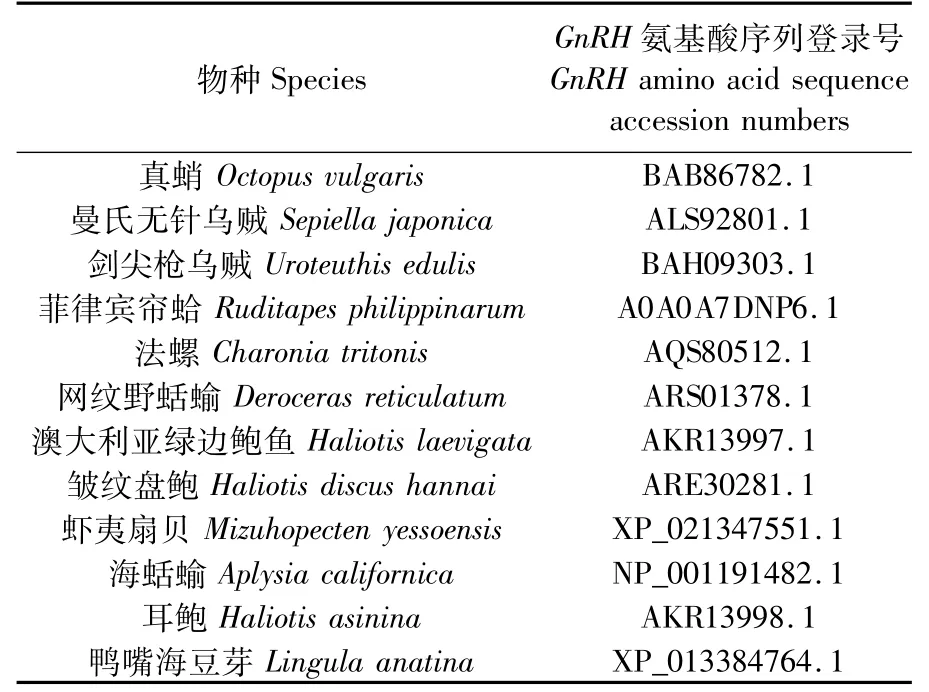
表2 物种GnRH氨基酸序列登录号Tab.2 Sequence ID of species GnRH am ino acid sequence
2.4 长蛸GnRH基因组织特异性表达
利用β-actin和oct-GnRH正反引物在聚合酶链式反应(PCR)下检测oct-GnRH基因在长蛸24个组织中是否表达。结果表明,食道上神经团、食道下神经团、视叶、腕肌肉、轴神经索、肾脏、肝胰脏、后唾液腺、卵巢、缠卵腺、精巢、精颊囊、前列腺、食道、胃、胃盲囊、肠和胴部肌肉18个组织中有oct-GnRH基因的表达,吸盘、视网膜、心脏、鳃、前唾液腺和皮肤6个组织中无GnRH基因的表达。运用实时荧光定量PCR(qRT-PCR)技术检测oct-GnRH基因在长蛸18个组织(有oct-GnRH基因表达)的表达水平。图4~图6显示,在长蛸的雌雄个体中oct-GnRH基因在食道上神经团和食道下神经团表达量较高,其中食道下神经团表达量最高,雌性个体的表达量要显著高于雄性个体。在剩余组织中,雄性的视叶、腕肌肉、轴神经索、肝胰脏、精巢和雌性的视叶、腕肌肉和轴神经索含量较高,剩余组织表达量较低。表明oct-GnRH主要的表达位置为神经系统,中枢神经系统表达量最高,腕部肌肉和肝胰脏的表达量较高。腕部肌肉中oct-GnRH的表达量较高原因与腕部含有大量的神经节有关[17],肝胰脏中oct-GnRH的表达量较高可能与肝胰脏的体积大且是主要的代谢器官有关。
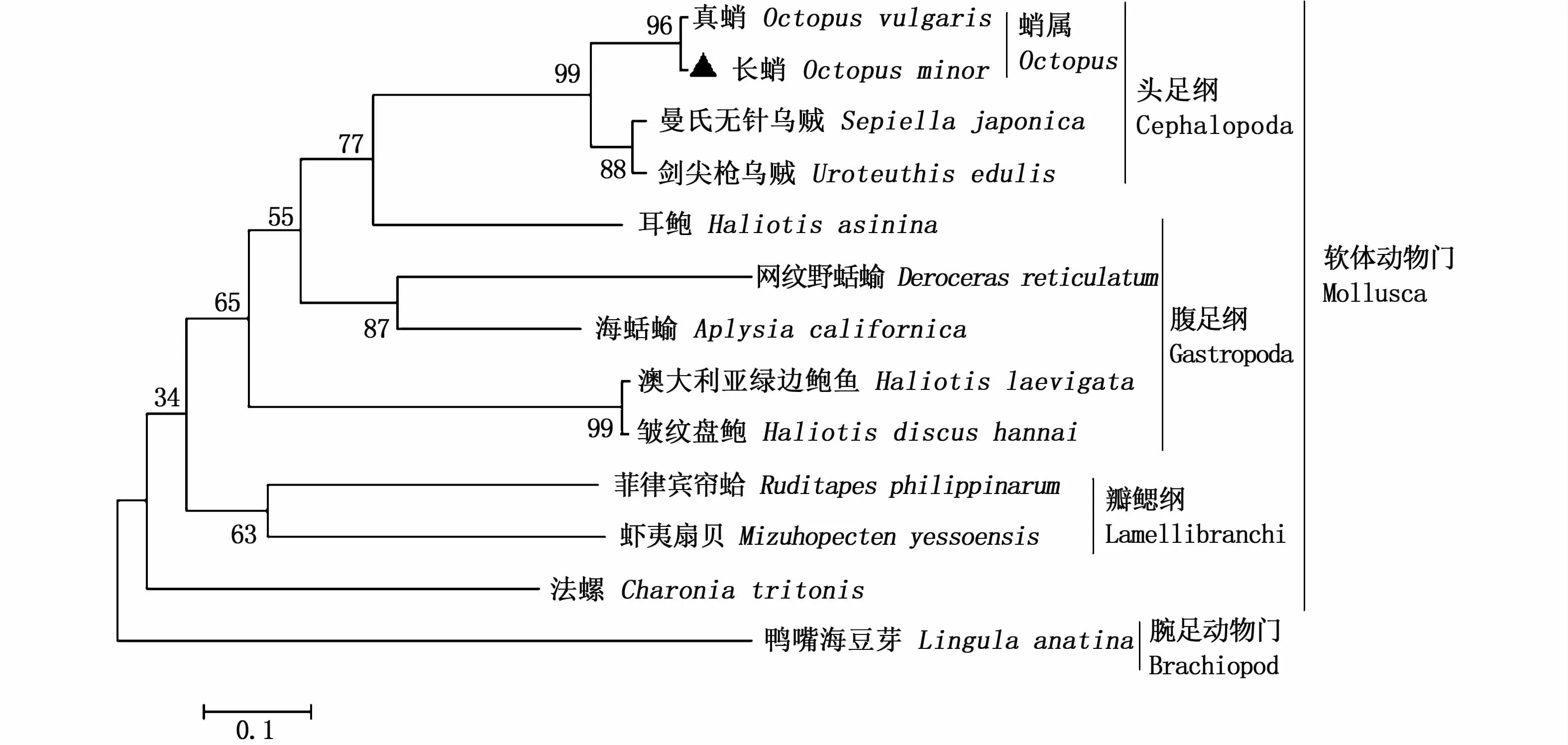
图3 长蛸与其他物种基于GnRH氨基酸序列的系统进化树Fig.3 Phylogenetic tree of GnRH am ino acid sequences from Octopusm inor and other vertebrates
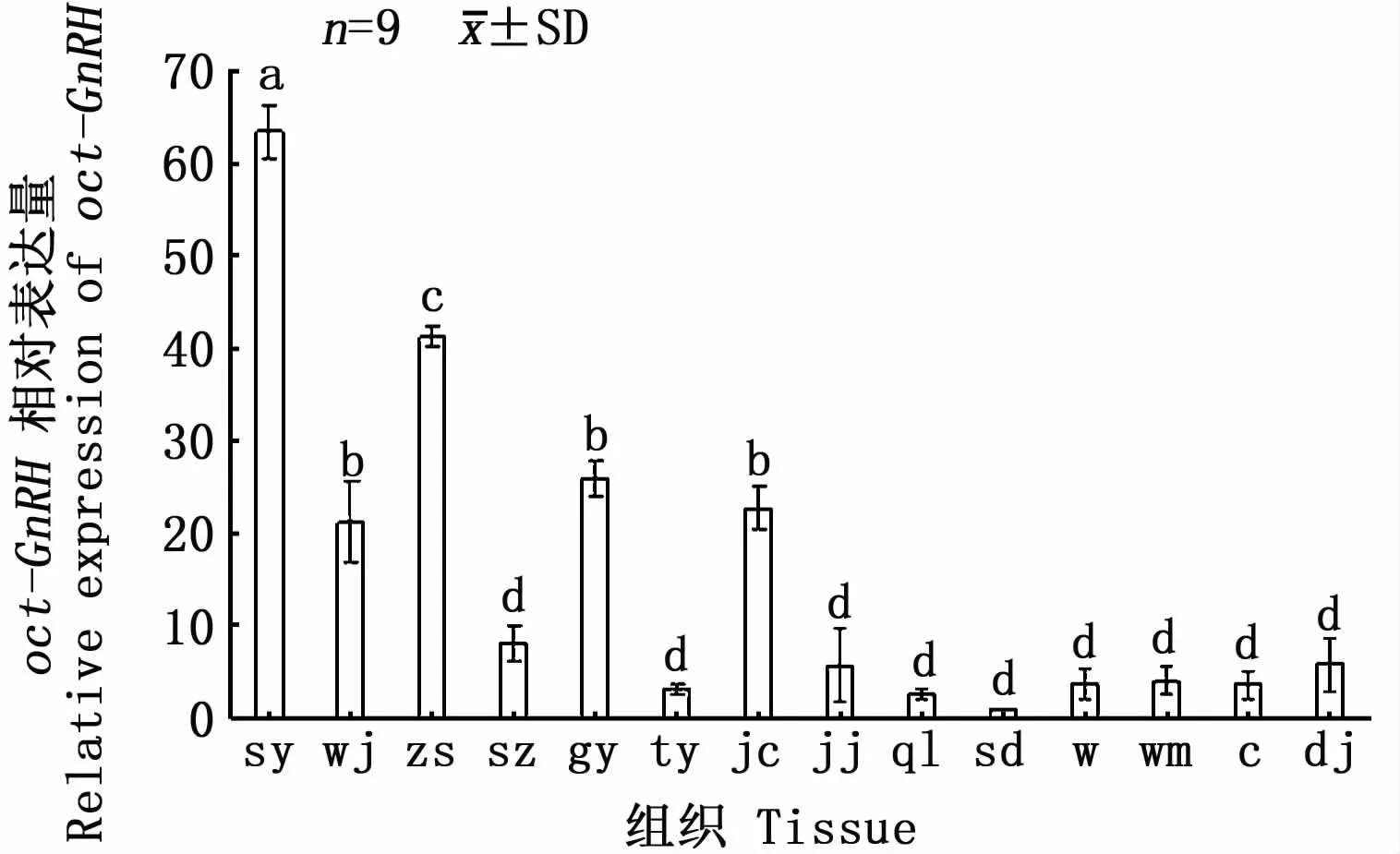
图4 oct-GnRH基因在雄性长蛸组织器官中的相对表达量Fig.4 Relative exp ression of oct-GnRH gene in tissues ofmale Octopusminor
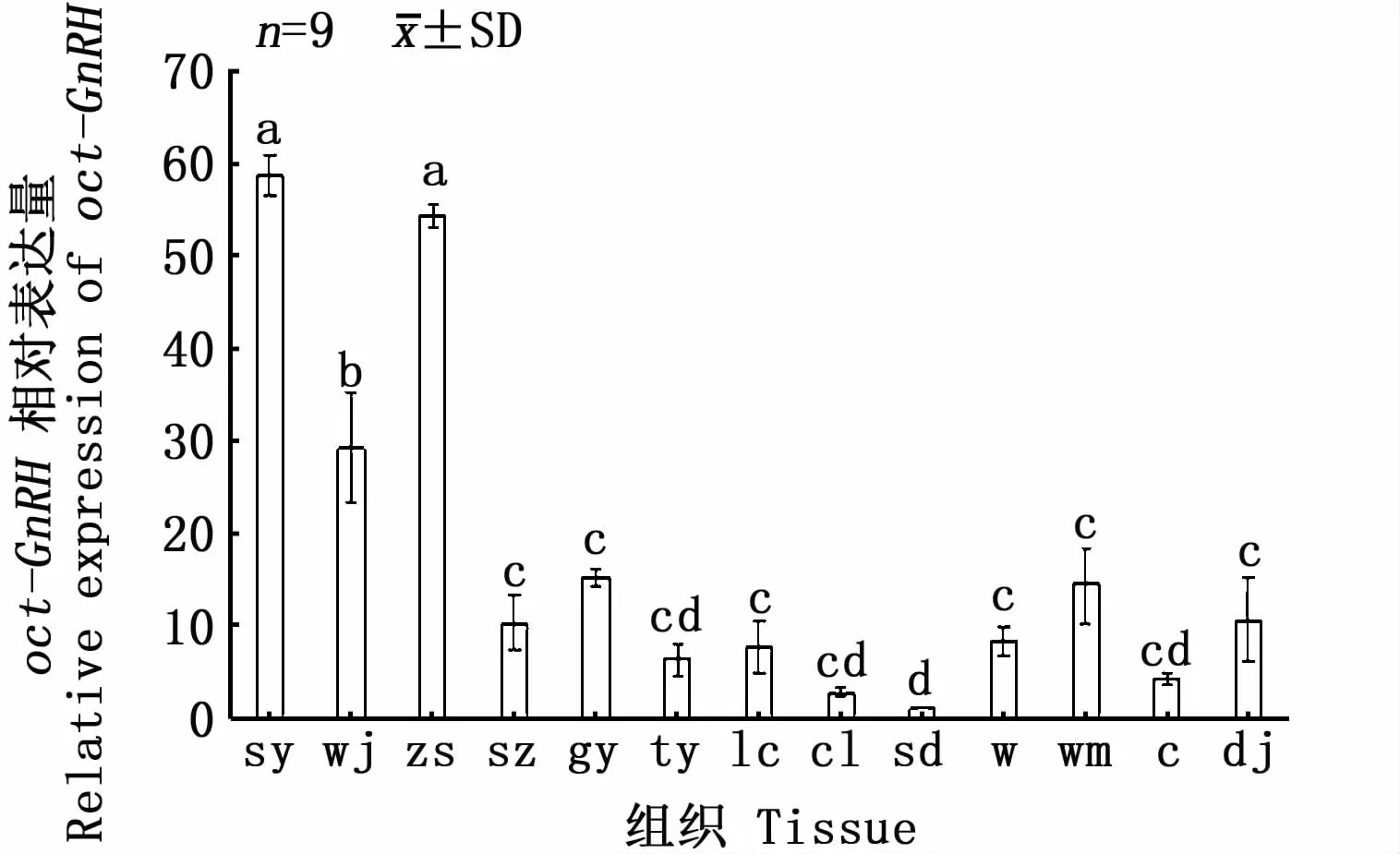
图5 oct-GnRH基因在雌性长蛸组织器官中的相对表达量Fig.5 Relative expression of oct-GnRH gene in tissues of female Octopusm inor
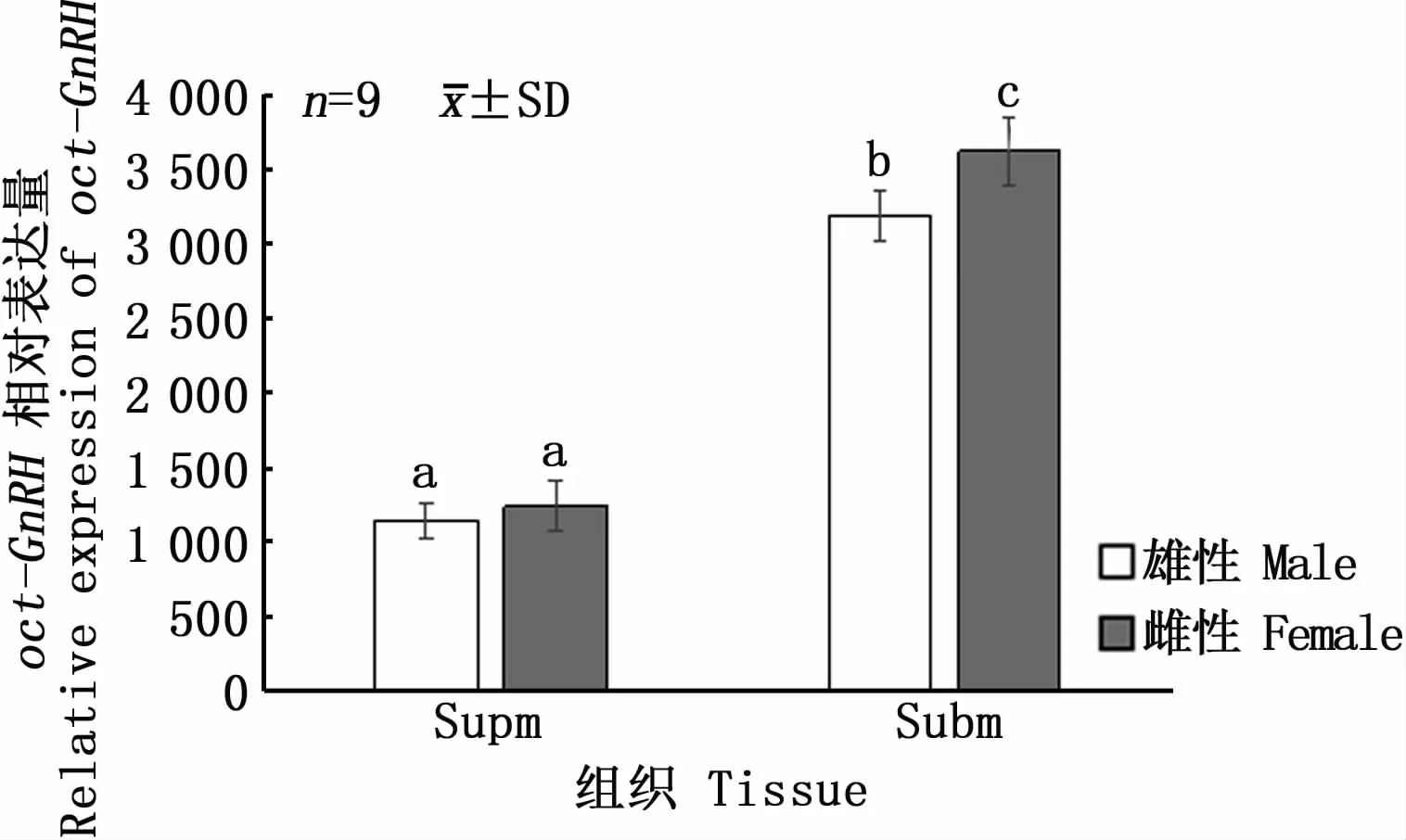
图6 oct-GnRH基因在雌雄长蛸食道上神经团与食道下神经团中的相对表达量Fig.6 Relative expression of oct-GnRH gene in the supraesophagealmass and subesophagealmass of Octopusminor
3 讨论
某些章鱼(头足纲八腕目)体内的十二肽GnRH(oct-GnRH)是促性腺激素释放激素神经肽家族的成员[18],脊椎动物的GnRH是十肽结构,oct-GnRH氨基酸结构中多了-Asn2-Tyr3-残基[12]。oct-GnRH前体蛋白的结构与脊椎动物的GnRH相似,由信号肽、肽激素序列、-Gly-Lys-Arg序列和GnRH相关蛋白(GAP)序列组成[12]。近几年对多种无脊椎动物的GnRH同源基因研究表明oct-GnRH神经肽的存在[19-20]。在软体动物中,头足纲3个物种[12,21-22]、瓣鳃纲2个物种[23-24]和腹足纲2个物种[19,25]中已发现oct-GnRH。秀丽隐杆线虫(Caenorhabditis elegans)中存在具有GnRH和昆虫脂肪代谢激素结构的肽(GnRH-AKH)[26],推测有GnRH神经肽超家族的存在[20]。GnRH在脊椎动物的大脑中分布广泛,参与多种生理功能(行为、代谢和免疫)的调控[27]。oct-GnRH在章鱼脑内神经纤维中被大量检测到,表明oct-GnRH对中枢神经系统的神经传递和神经调节起作用,包括中枢神经系统控制进食顺序[28]、触觉和视觉记忆系统[29]、其他器官系统和行为[30]。
本研究首次获得长蛸的oct-GnRH基因,cDNA全长为853 bp,开放阅读框为270 bp,5′非编码区为153 bp,3′非编码区430 bp。长蛸oct-GnRH编码的89个氨基酸分子量为9 989.51Da,理论等电点为7.77,7个负电荷残基,8个正电残基,1个跨膜结构处于13~32位编码20个氨基酸,1个信号肽处于1~31位编码31个氨基酸,2个结构域分别为7~86位编码80个氨基酸的BEN结构域和45~77位编码33个氨基酸的Pox-A3L结构域。从剑尖枪乌贼的中枢神经系统(CNS)克隆的cDNA的开放阅读框在核苷酸序列上与长蛸的oct-GnRH相似,约为80.5%[26]。曼氏无针乌贼和剑尖枪乌贼GnRH的氨基酸序列与长蛸的oct-GnRH相同。本研究中长蛸的oct-GnRH基因编码的氨基酸序列与真蛸相似度最高(96.63%),其次是曼氏无针乌贼(74.16%)和剑尖枪乌贼(70.79%),都含有BEN结构域和Pox-A3L结构域,表明头足类的oct-GnRH具有高度相似性。
长蛸oct-GnRH基因的实时荧光定量PCR结果表明,oct-GnRH基因的表达量在雌雄个体食道上神经团和食道下神经团中差异较小,oct-GnRH基因主要表达位置为神经系统,中枢神经系统表达量最高,其次是腕部肌肉和肝胰脏的表达量较高。而软体动物中对GnRH相关功能研究较少,主要对脊椎动物GnRH亚型进行研究[20,31-36]。目前,已经在少数物种上进行了基于同源GnRH的生理学研究。在真蛸中,oct-GnRH刺激输卵管收缩和性腺类固醇合成,在生殖过程中起作用[37-38]。然 而,在加利 福尼 亚 海兔(Aplysia californica)中,同源的GnRH能调节多种中枢神经元的活性并抑制袋状细胞放电,但对生殖无影响[39-40]。将oct-GnRH注 射 到 加 州 双 斑 蛸(Octopus bimaculoides)幼体的中枢神经系统附近的血窦中,会导致运动异常(爬行摇晃和腕部扭曲)及外套膜、心脏和色素体的过度活跃,表明oct-GnRH参与神经叶的神经传递与调节。在真蛸的脑亚脚叶、嗅叶、视腺和视腺神经中检测到oct-GnRH,表明oct-GnRH参与控制视腺的活动:生殖细胞的增殖、性腺的成熟和卵黄蛋白的合成[41]。oct-GnRH在日本鹌鹑(Coturnix coturnix)的垂体前叶细胞中显示出促黄体生成激素的活性[12]。oct-GnRH促进卵巢和精巢中雄性激素、孕酮和17β-雌二醇(E2)的基础类固醇合成[38],活性与GnRH在脊椎动物生殖系统中的活性相似[42],oct-GnRH存在于含有精子的组织中[37],表明oct-GnRH可能通过孕酮合成促进精子的预活化。oct-GnRH存在于视叶丛状层中,表明oct-GnRH参与视觉输入对视神经的调控[37]。本研究结果也显示,oct-GnRH主要表达于神经系统及神经纤维所控制的部分组织,与多种生理功能相关。
oct-GnRH可能是脑脚亚叶或嗅叶-视腺-性腺轴中的关键肽,作用类似于脊椎动物体内在下丘脑-垂体-性腺-性腺轴的GnRH[37]。视腺中的oct-GnRH或未发现的促性腺激素可能释放到血液中并作用于性腺,通过oct-GnRH的受体调节性类固醇来诱导性成熟和产卵[38,43]。除了促进生殖作用外,oct-GnRH是一种具有多种功能的肽,并具有许多重要的生理作用,包括进食、记忆、运动和自主功能[37]。因此,从分子层面研究长蛸的oct-GnRH的结构、表达特点及在生殖发育中的作用,可为了解长蛸生殖发育中的神经网络与神经肽调节机制提供直接数据,最重要的是为实现长蛸的工厂化养殖与苗种繁育技术的探索提供理论支持和数据参考。
