石蒜碱通过ERK信号通路诱导胃癌SGC-7901细胞凋亡及自噬
2020-11-10张淑静马俊英杨丹丹
张淑静,马俊英,杨丹丹
漯河医学高等专科学校,漯河 462002
胃癌(GC)是消化系统最常见的恶性肿瘤,是第四大最常见癌症和第二大肿瘤死亡主要原因。由于胃癌非典型症状和其他原因,导致对早期的筛查关注不足,大多数患者确诊时病情已经进入中晚期或远处转移。目前化学疗法在延长患者的生存时间和改善生活质量方面起着重要作用[1],然而,各种化学治疗剂并不能有效地使所有肿瘤细胞最小化,这也预示预后不良。因此,迫切需要寻求新颖的具有较高疗效、较少副作用的药物,可更好的改善胃癌患者预后。
自噬是一种高度保守的自降解现象,广泛存在于真核细胞中,可维持细胞稳态和蛋白质再利用。细胞自消化会降解其自身在生理和病理条件下变异的和功能失调的细胞质和细胞器[2],并通过去除错误折叠的蛋白质、受损的细胞器进行质量控制,从而抑制异常突变和癌症,可以减少癌细胞的不稳定性和损伤,从而防止肿瘤的发生[3]。细胞外信号调节激酶(ERK)是一类丝/苏氨酸蛋白激酶,是丝裂原激活的蛋白激酶(MAPK)家族的一员,包括ERK1和ERK2,MAPK参与介导细胞存活,而ERK磷酸化在细胞增殖和死亡中的作用是有争议的。据报道,ERK的磷酸化增加导致更多的细胞存活[4],而其他研究表明,ERK的活化可能导致DNA损伤并促进内质网应激诱导的细胞凋亡。目前,ERK已显示在自噬调节中起重要作用[5],但是,尚未确定ERK在自噬启动或成熟中的确切作用。越来越多的证据表明,通过溶酶体功能破坏引起的自噬受损可能是由ERK激活引起的,从而增加细胞死亡[6]。
石蒜碱(lycorine)是从石蒜鳞茎中提取的一种异喹啉类生物碱,具有抗炎、抗病毒、抗疟疾、保护心血管以及诱导肿瘤细胞凋亡等作用,对癌细胞具有直接杀伤作用,且毒性较低[7]。已有文献报道,石蒜碱在体外可以抑制HepG-2细胞增殖,并诱导其自噬,但对胃癌的研究较少[8]。本研究重点分析石蒜碱对胃癌增殖、凋亡及自噬的影响,并分析其机制,为胃癌的研究以及石蒜碱的开发提供依据。
1 材料与方法
1.1 细胞株
人胃癌SGC-7901细胞株购自南京科佰生物科技有限公司(编号CBP60500)。
1.2 药物及试剂
石蒜碱(成都曼思特生物科技有限公司,HPLC≧98%),采用含有0.1% DMSO的DMEM配置成不同浓度;CCK-8(南京建成生物研究所);Hoechst 33258(上海碧云天生物技术有限公司);Annexin V-FITC/PI细胞凋亡试剂盒(美国BD公司);3-甲基腺嘌呤(3-MA)自噬抑制剂、MDC 染液(美国Sigma公司);兔抗人caspase-3(激活性)、Bcl-2、Bax、Beclin-1、LC3 II、p-ERK2抗体(上海碧云天生物技术有限公司);兔抗人Atg-3、Atg-7抗体、HRP标记的羊抗兔IgG二抗(美国,Abcam公司)。
1.3 仪器
CKX41-C31B倒置荧光显微镜(奥林巴斯(中国)有限公司);MK3酶标仪(赛默飞)。
1.4 方法
1.4.1 细胞培养
胃癌SGC-7901采用含有10%胎牛血清、100 U/mL青霉素和100 U/mL链霉素的DMEM高葡萄糖培养基,并在37 ℃,5%CO2和95%湿度的培养箱中培养,将细胞进行3代传代,然后用于实验。
1.4.2 CCK-8法检测细胞活力
消化,离心并重悬对数生长期的细胞,以1×105个/mL接种在96孔板(100 μL/孔)中,细胞贴壁后吸出培养基,加入含有不同浓度的石蒜碱(0.31、0.63、1.25、2.5、5、10、20 μM)的新鲜完全培养基,每组设置3个复孔,实验重复3次。另设细胞对照组(除不加药物外,余处理同给药组)和空白对照组(除不加DMSO、药物及细胞,余处理同给药组)孵育24、48和72 h后,避光加入10 μL CCK-8试剂,于培养箱中孵育1 h,采用酶标仪于波长490 nm下检测OD值,计算细胞活力。细胞增殖抑制率=(细胞对照组OD值-给药组OD值)/(细胞对照组OD值-空白对照组OD值)×100%。
1.4.3 Hoechst 33258染色
调整对数生长期细胞浓度,以5×105个/mL接种在6孔板中,每孔加入2 mL培养基。 细胞贴壁后,吸出培养基,并加入含有不同浓度的石蒜碱的(1.25、2.5、5 μM)的新鲜培养基,对照组加入2 mL含0.1%DMSO的培养基,根据实验所需的时间培养24 h。然后,弃去培养基,将处理的细胞用4%多聚甲醛固定10 min,PBS洗涤3次,在室温下于Hoechst 33258孵育液孵育10 min,PBS缓冲液洗涤。荧光显微镜观察细胞并照相。
1.4.4 流式细胞仪检测胃癌SGC-7901凋亡
调整对数生长期细胞浓度,以5×105个/mL接种在6孔板中,每孔加入2 mL培养基。细胞贴壁后,吸出培养基,并加入含有不同浓度的石蒜碱(1.25、2.5、5 μM)的新鲜培养基,对照组加入2 mL含0.1%DMSO的培养基,培养24 h,收集细胞培养基,以1 500 rpm离心3 min,收集细胞。按照Annexin V-FITC/PI细胞凋亡检测试剂盒说明处理细胞,流式细胞仪检测细胞凋亡情况。
1.4.5 Western blot法
调整对数生长期细胞浓度,以5×105个/mL接种在6孔板中,每孔加入2 mL培养基。细胞贴壁后,吸出培养基,加入不同浓度的石蒜碱(1.25、2.5、5 μM),另外设置不给药的对照组,每组设置3个复孔,实验重复3次,处理24 h,RIPA裂解缓冲液裂解SGC-7901细胞,BCA比色测定法测定细胞裂解液中蛋白质含量,十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离蛋白,将分离的蛋白质转移至聚偏二氟乙烯膜(PVDF)膜上,用5%脱脂奶封闭2 h,加入抗Bax、Bcl-2、cleaved caspase-3和β-actin的一抗,于4 ℃孵育过夜。将膜与辣根过氧化物酶(HRP)偶联的二抗(1∶1 000)孵育50 min。通过增强化学发光法(ECL)检测印迹中的阳性条带,以β-actin为内参分析各蛋白相对表达水平。
1.4.6 MDC染色法检测人胃癌SGC-7901自噬泡的形成
将SGC-7901细胞接种于24孔板,细胞贴壁后,吸出培养基,给药组加入不同浓度的石蒜碱(1.25、2.5、5 μM),对照组加入等体积含0.1% DMSO的培养基,处理24 h,然后采用MDC(50 μM)孵育10 min。通过荧光显微镜(激发355 nm,阻断滤光片波长512 nm)观察拍照。Western blot法检测Beclin-1、LC3 II、Atg-3、Atg-7、p-ERK2蛋白表达。
1.4.7 3-MA对石蒜碱诱导胃癌SGC-7901自噬的影响
实验分为4组,对照组(含0.1%DMSO的培养基)、石蒜碱组(5 μM)、3-MA(5 μM)组、石蒜碱组(5 μM)+3-MA(5 μM)组,处理24 h后,CCK-8 法检测细胞增殖;流式细胞仪检测细胞凋亡;Western blot法检测cleaved caspase-3、LC3 II、p-ERK2蛋白表达。
1.3 统计学处理
采用SPSS19.0软件进行统计学分析,抑制率比较采用重复测量方差分析,其余采用单因素方差分析,组间比较采用LSD法,P<0.05为有统计学差异。
2 结果
2.1 石蒜碱对SGC-7901增殖的抑制作用
采用CCK-8方法测定发现,石蒜碱对SGC-7901细胞具有明显的增殖抑制作用(F=4.247,P<0.05),呈浓度依赖性和时间依赖性。分组与时间存在交互作用(F=2.782,P<0.05)。其中处理24 h的IC50为 8.89 μM,因此后续实验选择5、2.5、1.25 μM进行实验(见图1)。结构完整,荧光着色比较分布均匀。而石蒜碱处理。

图1 石蒜碱对SGC-7901增殖的抑制作用Fig.1 The inhibitory effect of lycorine on the proliferation of SGC-7901 cells
2.2 石蒜碱对SGC-7901细胞凋亡形态的影响
图2显示,Hoechest 33258 染色后,对照组细胞组细胞产生皱缩、形态不规则,细胞核呈致密浓染亮蓝色小点。
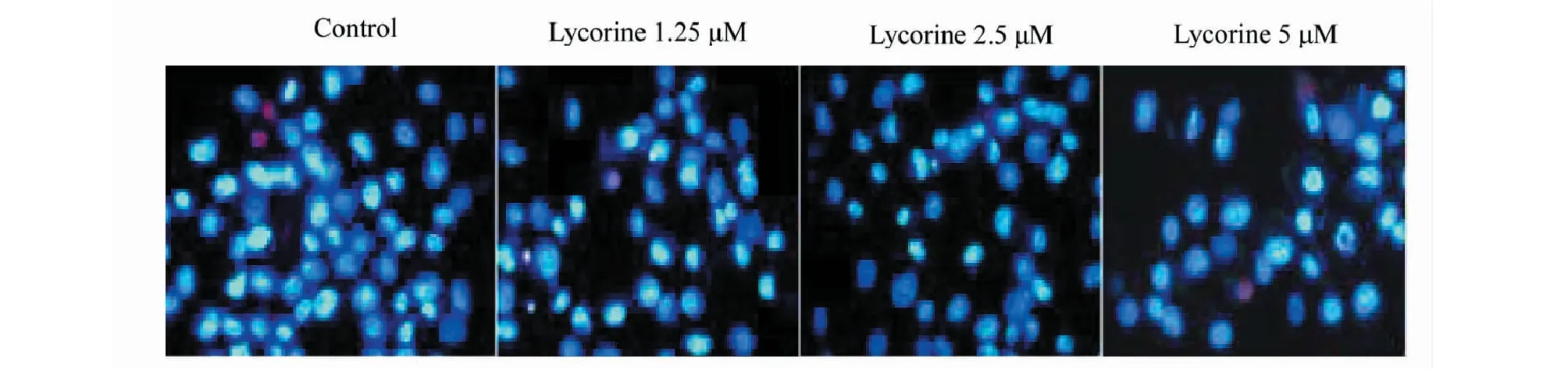
图2 石蒜碱对SGC-7901细胞凋亡形态的影响(×200)Fig.2 The effect of lycorine on the apoptotic morphology of SGC-7901 cells (×200)
2.3 石蒜碱对SGC-7901细胞凋亡的影响
与对照组比较,1.25、2.5、5 μM石蒜碱能明显增加SGC-7901细胞凋亡率,差异有统计学意义(P<0.01)(见图3)。

图3 石蒜碱对SGC-7901细胞凋亡的影响Fig.3 The effect of lycorine on SGC-7901 cell apoptosis注:与对照组比较,**P<0.01。Note:Compared with the control group,**P<0.01.
2.4 石蒜碱对SGC-7901细胞凋亡相关蛋白的影响
与对照组比较,1.25、2.5、5 μM石蒜碱能降低Bcl-2蛋白水平,增加Bax、cleaved caspase-3蛋白水平,差异均有统计学意义(P<0.01)。
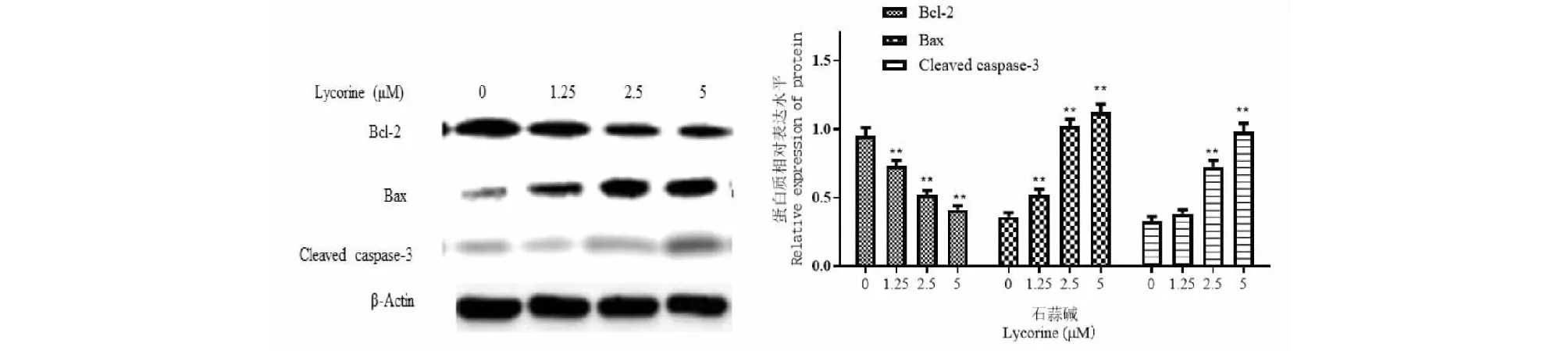
图4 石蒜碱对SGC-7901细胞凋亡相关蛋白的影响Fig.4 The effect of lycorine on apoptosis-related proteins in SGC-7901 cells注:与对照组比较,**P<0.01。Note:Compared with the control group,**P<0.01.
2.5 石蒜碱对SGC-7901细胞自噬泡形成的影响
与对照组比较,1.25、2.5、5 μM石蒜碱处理SGC-7901细胞后,细胞周围分布大量荧光颗粒。

图5 石蒜碱对SGC-7901自噬泡形成的影响Fig.5 The effect of lycorine on the formation of SGC-7901 autophagic vesicles

图6 石蒜碱对SGC-7901细胞自噬相关蛋白水平的影响Fig.6 The effect of lycorine on autophagy-related protein levels in SGC-7901 cells注:与对照组比较,*P<0.05,**P<0.01。Note:Compared with the control group,*P<0.05,**P<0.01.
2.6 石蒜碱对SGC-7901细胞自噬相关蛋白水平的影响
与对照组比较,1.25、2.5、5 μM石蒜碱能增加Beclin-1、LC3 II蛋白 水平,差异均有统计学意义(P<0.05)。
2.7 石蒜碱对SGC-7901细胞自噬小体的形成的影响
与对照组比较,1.25、2.5、5 μM石蒜碱能增加自噬小体相关蛋白Atg-3、Atg-7水平,差异有统计学意义(P<0.01),说明石蒜碱可以通过自噬小体的形成诱导自噬。见图7。
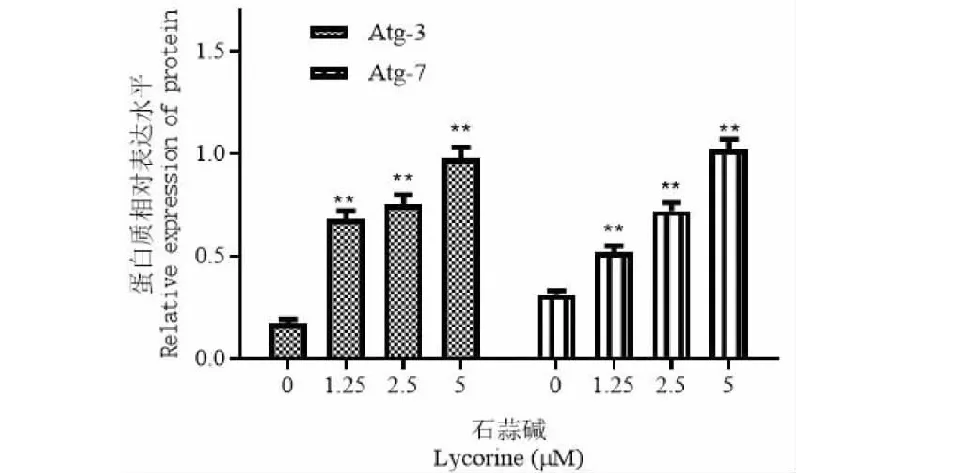
图7 石蒜碱对SGC-7901细胞自噬小体的形成的影响Fig.7 The effect of lycorine on the formation of autophagosomes in SGC-7901 cells注:与对照组比较,**P<0.01。Note:Compared with the control group,**P<0.01.
2.8 石蒜碱对SGC-7901细胞ERK信号通路相关蛋白的影响
与对照组比较,1.25、2.5、5 μM石蒜碱能增加p-ERK2蛋白水平,差异有统计学意义(P<0.01)。

图8 石蒜碱对SGC-7901细胞ERK信号通路相关蛋白的影响Fig.8 The effect of Lycorine on ERK signaling pathway related proteins in SGC-7901 cells注:与对照组比较,**P<0.01。Note:Compared with the control group,**P<0.01.
2.9 3-MA对石蒜碱诱导SGC-7901细胞自噬的影响
与对照组比较,石蒜碱组、3-MA+石蒜碱组细胞活力明显降低,差异有统计学意义(P<0.01),与石蒜碱组比较,3-MA+石蒜碱组细胞活力明显增加,差异有统计学意义(P<0.05);与对照组比较,石蒜碱组、3-MA+石蒜碱组细胞凋亡率明显增加,差异有统计学意义(P<0.01),与石蒜碱组比较,3-MA+石蒜碱组细胞凋亡率明显下降,差异有统计学意义(P<0.05);与对照组比较,3-MA+石蒜碱组cleaved caspase-3、LC3II、p-ERK2蛋白水平明显增加,差异有统计学意义(P<0.05);与石蒜碱组比较,3-MA+石蒜碱组cleaved caspase-3、LC3II、p-ERK2蛋白水平明显下调,差异有统计学意义(P<0.05);见图9。

图9 3-MA对石蒜碱诱导SGC-7901细胞自噬的影响Fig.9 The effect of 3-MA on the autophagy induced by lycorine in SGC-7901 cells注:与对照组比较,**P<0.01;与石蒜碱组比较,#P<0.05,##P<0.01。Note:Compared with the control group,**P<0.01;Compared with the lycorine group,#P<0.05,##P<0.01.
3 讨论
抗肿瘤药物在自然界普遍存在,本课题组的研究已经证实石蒜碱能抑制胃癌SGC-7901的增殖。而国内外的研究显示,石蒜碱能抑制各种肿瘤细胞增殖,促进肿瘤细胞凋亡,抗肿瘤机制是通过诱导细胞周期停滞和抗增殖来介导[9]。本研究通过CCK-8 法分析了石蒜碱对SGC-7901增殖的影响,结果表明石蒜碱能显著抑制SGC-7901细胞的增殖。应用Hoechst 33258染色和流式细胞仪显示石蒜碱能有效的促进SGC-7901细胞凋亡。Western blot检测显示石蒜碱能降低Bcl-2蛋白水平,增加Bax蛋白水平,并通过激活cleaved caspase-3,促进细胞凋亡,这也提示石蒜碱能通过线粒体途径诱导胃癌细胞凋亡。
自噬是高度保守的自降解现象,在真核细胞中广泛存在。细胞通过在生理和病理条件下降解自身的细胞质和细胞器来自消化[10]。为了验证石蒜碱对SGC-7901细胞自噬的影响,采用MDC 染色法检测人胃癌SGC-7901自噬泡的形成,发现石蒜碱干预24h后,细胞出现酸性的自噬小泡,Western blot检测结果表明Beclin-1、LC3 II等自噬相关蛋白水平明显增加,提示石蒜碱能诱导SGC-7901自噬。另外石蒜碱处理SGC-7901后,能显著增加Atg-7和Atg-3的蛋白水平,这些发现表明石蒜碱能通过自噬小体的形成诱导胃癌细胞自噬。
自噬是通过溶酶体降解细胞器和细胞质蛋白的进化保守途径,在许多疾病中起着重要作用,例如清除功能障碍的线粒体和蛋白聚集体、受损的蛋白和细胞器。自噬在调节癌细胞存活方面具有双重作用,在不同的实验环境中即可以促进也可以抑制肿瘤的生长和发展[11]。本研究显示,石蒜碱能诱导SGC-7901细胞凋亡,也能诱导SGC-7901细胞自噬,那么本研究中的自噬和凋亡存在什么联系?本研究后续的研究显示,当SGC-7901细胞同时给予自噬抑制剂3-MA和5 μM石蒜碱时,与单独给予5 μM石蒜碱相比,细胞活力明显增加,细胞凋亡率明显下降,说明抑制SGC-7901细胞自噬,可减弱石蒜碱对SGC-7901细胞的增殖的抑制和诱导细胞凋亡,提示石蒜碱可以通过增加胃癌SGC-7901细胞自噬促进细胞凋亡。
ERK通路参与多种癌症类型的发生、发展和进展,被认为是重要的治疗靶点,能有效的调控自噬和细胞凋亡[12]。本研究证实,石蒜碱可以诱导SGC-7901细胞自噬,3-MA可以下调LC3II蛋白水平抑制SGC-7901细胞自噬,并进一步减弱石蒜碱对SGC-7901细胞增殖的抑制作用和细胞凋亡的影响。为了验证石蒜碱诱导SGC-7901细胞自噬凋亡的机制,本研究通过Western blot法检测了ERK信号通路的关键蛋白水平,结果显示石蒜碱能激活ERK,促进其磷酸化,说明石蒜碱是通过ERK信号通路导胃癌细胞自噬和凋亡。
总之,石蒜碱能通过调控ERK信号通路,诱导胃癌SGC-7901细胞自噬以及凋亡,是石蒜碱体外发挥抑制胃癌细胞增殖效应的重要途径,并为进一步阐释石蒜碱抗肿瘤分子机制提供了依据,同时也揭示了石蒜碱抗肿瘤的药效物质基础,为石蒜碱的临床应用与转化提供参考。
