重楼皂苷G通过CIP2A/PP2A信号通路抑制淋巴瘤细胞生长并促进凋亡及自噬的机制研究
2020-11-10刘雪文向雨晨刘洋洋
刘雪文,向雨晨,刘洋洋,司 渊,4,刘 莹,3,4*,郭 阳,3,4*
1湖北医药学院 基础医学院;2湖北医药学院 武当特色中药研究湖北省重点实验室;3湖北医药学院 胚胎干细胞湖北省重点实验室;4湖北医药学院 生物医药研究院,十堰 442000
恶性淋巴瘤是一种具有较高异质性的肿瘤,发生在淋巴结中。由于淋巴系统遍布全身,淋巴瘤是一种全身性疾病,可影响体内几乎所有组织和器官[1]。2018年,全球约有589 530例新淋巴瘤病例和274 891例与淋巴瘤相关的死亡[2]。几乎90%的淋巴瘤病例是B细胞起源的,但是淋巴瘤也可以来源于T细胞或自然杀伤细胞[3]。目前,化学疗法,放射疗法,外周血干细胞移植,利妥昔单抗和靶向疗法均被用于治疗淋巴瘤。然而,仍有一些更具侵略性的淋巴瘤类型具有较低的存活率[4]。因此,发现新的有效治疗方法对于提高淋巴瘤患者的生存期是必要的。
蛋白磷酸酶2A(protein phosphatase 2A,PP2A)的癌性抑制因子(cancerous inhibitor of protein phosphatase 2A,CIP2A)是一种癌基因,可抑制PP2A的磷酸酶活性,进而阻遏PP2A对下游分子(包括Akt、ERK等)的去磷酸化,从而维持Akt、ERK等信号的组成性活化,而促进各种恶性肿瘤的肿瘤发生、化疗耐药、凋亡及自噬抗性、及预后不良[5-7]。我们先前曾报道,在急性髓细胞性白血病和多发性骨髓瘤中,CIP2A的异常高表达促进预后不良[8,9]。2013年,Lilja等[10]报道了CIP2A在B细胞淋巴瘤中的表达上调。CIP2A在淋巴瘤中的分子生物学功能和潜在机制尚不完全清楚。因此,迫切需要进行深入研究以探索CIP2A作为淋巴瘤治疗靶点的可能性。
从中草药中提取的天然产物仍然是肿瘤药物发现的重要资源。延龄草(TrilliumtschonoskiiMaxim)属于百合科,是中国的传统中草药[11]。广泛分布在中国的西南、西北、华中等地,是武当及神农架地区四大神药之一,具有镇痛、止血、解毒等传统功效[12]。延龄草的主要活性成分之一,polyphyllin G(PPG,图1)是一种甾体皂苷。本文旨在探讨PPG在人淋巴瘤细胞中的作用及其机制。
图1 重楼皂苷G结构图Fig.1 The structure of polyphyllin G
1 材料
1.1 细胞
Raji细胞株购自ATCC公司。细胞在含有10%胎牛血清(Hyclone)和抗生素的RPMI1640培养基(Hyclone)中培养,并在37 °C,5% CO2的孵箱中孵育。
1.2 药物及试剂
经HPLC测定纯度高达95%的PPG(上海诗丹德标准技术服务有限公司)。PPG溶于二甲基亚砜至30 mmol/L并在-20 °C冰箱中存储。细胞凋亡检测试剂盒(碧云天生物技术有限公司,产品编号:C1062M)。冈田酸(Sigma-Aldrich,产品编号:O9381);caspase-3抗体(货号#9662)、PARP抗体(货号#9542)、LC3抗体(货号#12741)均购自Cell Signaling Technology;phospho-Akt抗体(Ser473,货号sc-7985)、Akt抗体(货号sc-8312)均购自Santa Cruz Biotechnology;GAPDH抗体(Abmart,货号M20006);HRP-兔二抗及鼠二抗(EarthOx公司,货号 E030120-01、E030110-01);Dylight 488-兔二抗(Abbkine,货号#A23410)。PP2A免疫沉淀磷酸酶检测试剂盒(Upstate)。
2 方法
2.1 CCK-8实验
细胞(1×104)被接种到96孔板,预培养4 h,然后用PPG(浓度分别为2、3、4、6、8、10 μmol/L)共孵育处理24 h或48 h。采用CCK-8试剂盒(日本同仁)检测细胞毒性,酶标仪检测在450 nm处的吸光度。抑制率=1-(实验组A值-空白组A值)/(对照组A值-空白组A值)×100%。
2.2 台盼蓝细胞计数实验
把细胞密度约2.0×105cells/mL的细胞悬液加入12孔板,每孔加入1.980 mL,孵育24 h,每孔加入20 μL已配好100倍工作浓度的药物,分别培养12、24、48 h后台盼蓝染色,每组细胞平行计数8次,取平均数绘制生长曲线。
2.3 DAPI染色检测细胞凋亡
通过使用细胞离心涂片机将细胞接种在载玻片上,并用4%多聚甲醛固定。在含0.2%的Triton X-100的PBS中透化后,在含3% BSA的PBS中室温封闭,用PBS漂洗3×5 min,DAPI染色(购自碧云天,货号C1005)后用盖玻片封片。356 nm紫外光为激发光,在荧光显微镜下观察DAPI染色后细胞的凋亡形态并拍照。
2.4 Annexin V-FITC/PI 双染法检测细胞凋亡实验
细胞(1.5×105)被接种于6孔板,预培养4 h,然后用PPI共孵育处理24 h。收集上清液及用不含EDTA的胰酶消化细胞并收集,1 000 rpm,离心1 min,弃上清,用PBS轻轻重悬细胞洗涤两次并计数。加入100 μL已稀释好的1× Annexin V-FITC结合液,轻轻重悬。加入5 μL Annexin V-FITC,轻轻混匀。再加入10 μL的PI染色液,轻轻混匀,置于冰浴中避光孵育15 min。用流式细胞仪检测细胞凋亡率。
2.5 蛋白免疫印迹实验(Western blot)
收集处理后的细胞,RIPA裂解液冰浴裂解20 min后,12 000 rpm,4 °C离心10 min,取上清蛋白裂解液BCA法测定蛋白浓度,加入对应体积的SDS震荡均匀,99 °C煮5 min使蛋白变性。SDS-PAGE电泳后,用PVDF膜进行转膜,经5%脱脂牛奶封闭,一抗4 °C孵育过夜后,用辣根过氧化物酶标记的二抗室温孵育1.5 h,胶片显影。
2.6 免疫荧光
通过使用细胞离心涂片机将细胞接种在载玻片上,并用4%多聚甲醛固定。在含0.2%的Triton X-100的PBS中透化后,在含3% BSA的PBS中室温封闭,用PBS漂洗3×5 min,加入LC3一抗,4 °C过夜。再用PBS漂洗3×5 min,Dylight 488-兔二抗室温避光孵育1.5 h。激光共聚焦显微镜下观察细胞自噬体形成并拍照。
2.7 PP2A活性测定
按照PP2A免疫沉淀磷酸酶检测试剂盒说明书来测定磷酸盐的释放量作为磷酸酶活性的指标。100 μg的细胞分离蛋白与4 μg的抗PP2A单克隆抗体共同孵育过夜,将40 μL蛋白质A琼脂糖珠加入上述混合物中,4 °C孵育2 h。收集珠子,分别用700 μL预冷TBS洗涤3次,500 μL丝氨酸/苏氨酸检测缓冲液洗涤1次。在检测缓冲液中用750 mmol/L的磷酸肽与珠子共孵育,30 °C不断搅拌10 min。向混合物中加入100 μL的碱式碳酸铜磷酸盐检测溶液,通过酶标仪测定其在650 nm处吸光度。
2.8 统计分析

3 结果
3.1 PPG对Raji细胞的增殖具有显著的抑制作用
通过CCK-8法检测PPG对Raji细胞增殖的影响。结果发现PPG处理24、48 h后,细胞的生长受到不同程度的抑制,PPG对Raji细胞增殖具有显著的抑制作用,并且呈一定的时间和浓度依赖性(图2A),PPG处理后Raji细胞的24 h IC50值为5.75 μmol/L。台盼蓝拒染法检测发现,PPG在3.5 μmol/L到4.5 μmol/L剂量时能显著抑制Raji细胞的增殖(图1B)。总之,PPG对淋巴瘤Raji细胞的增殖具有显著的抑制作用。
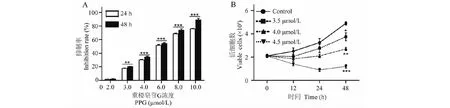
图2 PPG对Raji细胞增殖的影响Fig.2 Inhibitory effects of PPG on Raji cells注:(A)CCK-8法检测PPG对Raji细胞的增殖抑制作用;(B)台盼蓝拒染法检测PPG对Raji细胞的细胞活性作用。与空白对照组比较,*P <0.05,**P <0.01,***P <0.001。Note:(A) The inhibitory effects of PPG on Raji cells analyzed by CCK-8 assay;(B) Inhibitory effects of PPG on cell viability of Raji cells assayed by trypan blue exclusion assay.Compared with control group,*P <0.05,**P <0.01,***P <0.001.
3.2 PPG诱导Raji细胞发生凋亡及自噬
AnnexinV/FITC-PI双标法流式细胞术检测结果显示,不同浓度PPG作用Raji细胞24 h后,随着PPG浓度的增加,Raji细胞凋亡率逐渐增加(图3A-B)。同时,DAPI染色检测发现PPG处理后Raji细胞核发生皱缩,(图3C)表明发生了凋亡。进一步,我们通过Western blot检测凋亡相关蛋白表达(图3D),结果发现随着PPG药物剂量的增加,caspase-8、caspase-3及PARP切割显著增加,表明PPI能够通过活化caspase而诱导Raji细胞发生凋亡。为了检测自噬是否也参与了PPG诱导的细胞死亡,我们检测了PPG后Raji细胞中自噬相关因子LC3、Beclin 1的表达水平。结果发现在PPG处理组细胞中LC3-II和Beclin1表达显著上调,这表明PPG促进Raji细胞自噬的发生(图3E)。当自噬启动时,LC3蛋白C末端被切割并且产生 LC3-II蛋白,然后在自噬体中转移。为了进一步检测自噬体是否形成,我们通过免疫荧光检测内源LC3,结果发现对照组细胞呈弥漫性荧光染色,PPG处理的Raji细胞呈现出斑点状荧光染色(图3F),说明LC3在自噬体中发生了再分配。另外,PPG处理导致p62的下调(图3E),这表明自噬体与溶酶体发生了融合。总之,以上结果表明,PPI能在淋巴瘤Raji细胞中诱导caspase依赖的细胞凋亡和自噬。
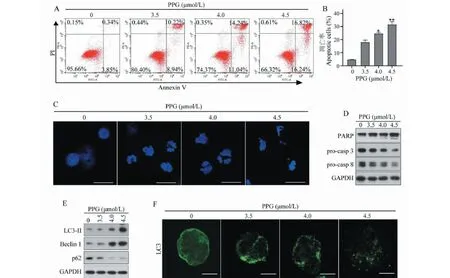
图3 PPG诱导Raji发生凋亡及自噬Fig.3 PPG induces apoptosis and autophagy in Raji cells注:(A、B)不同剂量PPG处理Raji细胞24 h,通过AV/PI染色和流式细胞术检测细胞凋亡;(C)用不同剂量的PPG处理Raji细胞并24 h,通过DAPI染色,荧光显微镜检测细胞核形态变化;(D、E)不同剂量PPG处理Raji细胞24 h,通过Western blot检测相关蛋白的表达情况;(F)不同剂量PPG处理Raji细胞24 h,免疫荧光检测LC3自噬体形成情况。与0 μmol/L PPG组比较,*P <0.05,**P <0.01。Note:(A,B) Raji cells were treated with different doses of PPG for 24 h,and apoptosis was detected by AV/PI staining and flow cytometry;(C) Raji cells were treated with different doses of PPG for 24 h.DAPI staining and fluorescence microscopy were used to detect changes in nuclear morphology;(D,E) Raji cells were treated with different doses of PPG for 24 h,and the expression of apoptosis-related proteins was detected by western blot;(F) Raji cells were treated with different doses of PPG for 24 h,and immunofluorescence was used to detect the formation of LC3 autophagosomes.Compared with 0 μmol/L PPG group,*P <0.05, **P <0.01
3.3 PPG下调Raji细胞中CIP2A表达而重激活PP2A活性
用浓度递增的PPG处理Raji细胞 24 h后,通过Western blot 法检测凋亡及自噬上游相关信号通路蛋白的表达变化。结果显示,PPG下调了CIP2A的蛋白表达(图4A)。CIP2A是蛋白磷酸酶PP2A的内源性抑制剂,同时,肿瘤明星信号分子Akt的去磷酸化受到PP2A的广泛调节[13]。因此,我们进一步检测PPG对CIP2A的下调是否可以恢复PP2A活性。结果发现,PP2A活性在用PPG处理的Raji细胞中显著上调(图4B)。此外,PPG亦能够下调PP2A下游Akt磷酸化(pAkt)(图4C),表明Akt活性下降。总之,以上这些结果表明PPI可能是通过影响下调CIP2A而重激活PP2A的磷酸酶活性。

图4 PPG下调CIP2A而重激活PP2AFig.4 PPG down-regulates CIP2A and reactivates PP2A注:(A)PPG处理Raji细胞24 h后,Western blot检测相关蛋白的表达;(B)PPG处理Raji细胞24 h后,PP2A磷酸酶活性试剂盒测定分析PPG处理后的Raji细胞中PP2A的活性;(C)PPG处理Raji细胞24 h后,Western blot检测相关蛋白的表达。与0 μmol/L PPG组比较,*P <0.05。Note:(A) Raji cells were treated with PPG for 24 h,the expression of related proteins was detected by Western blot;(B) Raji cells were treated with PPG for 24 h,PP2A phosphatase activity kit was used to measure and analyze the activity of PP2A;(C) Raji cells were treated with PPG for 24 h,the expression of related proteins was detected by Western blot.Compared with 0 μmol/L PPG group,*P <0.05.
3.4 重激活PP2A活性是PPG诱导凋亡及自噬的关键环节
为了检测PPG诱导的Raji细胞凋亡及自噬是否是由PP2A重激活引起,我们通过PP2A抑制剂冈田酸(okadaic acid,OA)与PPG共处理检测细胞凋亡及自噬相关因子。数据表明OA显著逆转了由PPG诱导的细胞增殖抑制、细胞凋亡及自噬(图5A和5B)。总之,这些结果表明PP2A的重激活是PPG通过抑制CIP2A来促进细胞凋亡及自噬的关键环节。因此,我们得出以下结论,PPG在一定程度上是通过抑制CIP2A/PP2A/Akt信号轴来抑制淋巴瘤细胞增殖并诱导凋亡及自噬。

图5 重激活PP2A活性是PPG诱导凋亡及自噬的关键环节Fig.5 Reactivation of PP2A activity is a key step in PPG-induced apoptosis and autophagy注:(A)PPG(4.5 μmol/L)和/或OA(20 nmol/L)处理Raji细胞24 h后,CCK-8法检测细胞生长;(B)PPG(4.5 μmol/L)和/或OA(20 nmol/L)处理Raji细胞24 h后,Western blot检测相关蛋白表达。OA、PPG共处理组与PPG组相比,*P <0.05.Note:(A) After 24 h treatment of Raji cells with PPG (4.5 μmol/L) and/or OA (20 nmol/L),CCK-8 was used to detect cell growth;(B) After 24 h treatment of Raji cells with PPG (4.5 μmol/L) and/or OA (20 nmol/L),Western blot was used to detect the expression of related proteins.OA,PPG co-treated group compared with PPG group,*P <0.05.
4 讨论
天然中草药来源的小分子化合物一直是肿瘤药物发现的重要资源。PPG是一种生物活性甾体皂苷,已被证明在某些肿瘤类型存在治疗效果[14,15],而其在淋巴瘤中的治疗作用尚无报导。本研究揭示了一种新的PPG抗癌机制,即通过抑制CIP2A/PP2A/Akt信号轴抑制淋巴瘤细胞生长及诱导凋亡。
凋亡途径的异常在血液恶性肿瘤的发生发展中起关键作用,诱导细胞凋亡亦是肿瘤治疗的重要策略[16,17]。流式细胞术证明PPG能有效诱导Raji细胞凋亡(图3A)。细胞凋亡伴随着多种形态学变化,例如核皱缩及形成凋亡小体。通过DAPI染色发现,PPG处理后的Raji细胞的细胞核发生明显的皱缩(图3C)。Caspase-3以及PARP蛋白的水解(图3D),表明PPG可诱导Raji细胞发生caspase介导的凋亡。自噬是II类程序性细胞死亡。自噬过程中,LC3II对自噬体的形成至关重要,而Beclin1是促进自噬体形成的关键因子[18]。我们的结果表明,PPG通过上调LC3II和 Beclin1 表达水平而激活自噬(图3E)。进一步,免疫荧光检测发现PPG促进自噬体形成(图3F)。另外,PPG能够下调p62表达(图3E),这表明PPG可能通过促进自噬体与溶酶体融合而引起p62降解。以上表明PPG促进淋巴瘤细胞凋亡及自噬的发生。某些情况下,自噬抑制凋亡,是细胞的存活途径;但自噬本身也会诱发细胞死亡,或与凋亡共同作用及在凋亡缺陷的情况下作为备份机制诱导细胞死亡[19]。而PPG则可能引发两种通路的关联调控。
CIP2A的过表达通常与多种人类肿瘤相关,而抑制CIP2A亦是肿瘤靶向治疗的新策略[20]。在本研究中,我们发现PPG能够在蛋白水平上引起Raji细胞中CIP2A的显著下调(图4A)。进一步调查其下游分子PP2A的活性,发现PPG通过下调CIP2A重激活了Raji细胞中的PP2A磷酸酶活性,从而促进Akt的去磷酸化(图4B和4C)。因此,PPG可能通过下调CIP2A而重新激活PP2A,进而抑制其下游重要癌性信号分子Akt的活性。Akt是参与众多肿瘤细胞增殖、分化、凋亡、自噬及多药耐药的关键信号节点[21]。由此,我们提出PPG可能通过CIP2A/PP2A/Akt信号轴抑制淋巴瘤细胞生长并促进凋亡、自噬。进一步PP2A抑制剂OA可以拮抗PPG对淋巴瘤细胞凋亡、自噬的活化作用(图5)。这些结果证实了PP2A的重激活在PPG下调CIP2A抑制淋巴瘤通路中起关键作用。
总之,本课题的研究结果为进一步深入探讨PPG对CIP2A/PP2A/Akt信号转导通路的作用机制,以及PPG的抗淋巴瘤作用提供了研究基础。
