柚皮素通过下调RhoA/ROCK信号通路改善糖尿病肾病小鼠肾纤维化
2020-11-10谢发江冉茂霞李家富
谢发江,冉茂霞,冯 健,李 燕,李家富,邓 莉
1达州市中心医院心血管内科;2达州市中心医院肾病内科,达州 635000;3西南医科大学附属医院心血管内科;4西南医科大学附属医院风湿免疫科,泸州 646000
糖尿病肾病(diabetic nephropathy,DN)是糖尿病最常见的微血管并发症,也是终末期肾病(end stage renal disease,ESRD)最常见的病因[1]。DN目前发病机制复杂,涉及肾脏血流动力学改变、缺血、氧化应激、炎症激活、肾素-血管紧张素-醛固酮系统(RAAS)激活等方面导致肾脏纤维化,最终累及肾脏功能。及时阻断肾脏纤维化,能够有效防止DN进展为ESRD[2]。
RhoA/ROCK信号通路的过度激活介导多种疾病包括DN在内的纤维化过程,并且法舒地尔为代表的ROCK阻断剂,已经显示了良好的抗DN肾纤维化作用[3]。柚皮素(naringenin,NRG)是从柑橘类植物中提纯出的一种具有抗心律失常、抗动脉粥样硬化、抗炎、抗纤维化、抗病毒、抗肿瘤等多种药效的黄酮类化合物,被广泛用于体内外研究[4]。而关于柚皮素在DN中作用,目前研究较少,因此本研究通过复制DN小鼠模型,予柚皮素处理后观察DN肾纤维化的进展,同时我们设立法舒地尔作为阳性对照组,以期进一步探讨柚皮素对RhoA/ROCK信号通路的影响。
1 材料与方法
1.1 实验材料、药品与试剂
1.1.1 动物
健康雄性SPF级6~8周龄C57BL/6小鼠32只,体重20±1.5 g,购自成都达硕实验动物有限公司。动物许可证号:SCXK(川)2015-030。实验期间进食普通饲料,自由饮水,12 h光照维持昼夜循环,室温控制在25±1 ℃。
1.1.2 药物及试剂
STZ购自美国Sigma公司(货号S8050);柚皮素标准品购自上海思域化工科技有限公司(批号JD8051003);盐酸法舒地尔注射液购自天津红日药业股份有限公司(批准文号:国药准字H20040356);抗RhoA(货号ab187027)、ROCK1(货号ab45171)、ROCK2(货号ab71598)、层粘连蛋白(laminin,LN)(货号ab11575)、纤连蛋白(fibronectin,FN)(货号ab2413)、GAPDH(货号ab37168)抗体均购自英国Abcam公司;抗MYPT1(货号2643)、p-MYPT1 Thr853(货号4563)抗体均购自美国CST公司;抗I型胶原蛋白(type-I collagen,Col1)(货号AF7001)、III型胶原蛋白(type-III collagen,Col3)(货号AF0136)抗体均购自美国Affbiotech公司;BCA蛋白浓度测定试剂盒(货号AS1086)购自武汉阿斯本生物技术有限公司。
1.1.3 主要仪器
BX53型光学显微镜(日本OLYMPUS公司);RM2016转轮式切片机(德国LEICA公司);BMJ-Ⅲ型包埋机、TSJ-Ⅱ型全自动封闭式组织脱水机、PHY-Ⅲ型病理组织漂烘仪,均为常州市中威电子仪器有限公司;DYY-6C型电泳仪(北京市六一仪器厂);LiDE110型扫描仪(日本Canon公司);Advia 2400型全自动生化分析仪(德国Siemens公司)。
1.2 实验方法
1.2.1 分组、模型复制及给药方法
C57BL/6小鼠适应性喂养1周,按随机数表法分成正常组(NS组)、模型组(DN组)、柚皮素组(D+N组)、法舒地尔组(D+H组),每组8只。DN组、D+N组、D+H组小鼠禁食12 h后腹腔注射1% STZ 80 mg/(kg·d),NS组、DN组予等体积柠檬酸钠缓冲液腹腔注射,连续5天,每天1次,2周后断尾取血测得随机血糖大于16.7 mmol/L建立1型糖尿病小鼠模型,继续喂养4周测定24 h尿蛋白定量(24-hour urinary protein quantity,24 h Upro)大于造模前2倍则视为DN模型复制成功,成模后D+N组予生理盐水配制的柚皮素50 mg/(kg·d)混悬液灌胃[5],D+H组予生理盐水稀释的盐酸法舒地尔注射液40 mg/(kg·d)腹腔注射[3],NS组、DN组等予体积生理盐水灌胃,连续12周。代谢笼收集小鼠24 h尿液,测定24 h Upro,腹腔注射1%戊巴比妥钠麻醉后留取血清测定血肌酐(serum creatinine,Scr),处死小鼠,取肾脏组织将其纵向对半切开,部分用4%多聚甲醛固定后制作成厚4 μm石蜡切片,部分冻存于-80 ℃冰箱,用于Western blot检测。
1.2.2 24 h Upro及Scr的测定
将血液及尿液标本,离心,取上清液,采用全自动生化分析仪检测24 h Upro及Scr。
1.2.3 肾脏组织病理学观察
分别选取各组石蜡切片,脱蜡后行HE及Masson染色,于光镜下观察拍照。
1.2.4 免疫组化观察肾脏组织中RhoA、ROCK1、ROCK2、Col1、Col3的水平
选取各组切片脱蜡后浸入柠檬酸盐缓冲液并予高火加热至沸腾后断电5 min,再加热1次,冷却后予PBS洗5 min(2次,进行抗原修复。滴加山羊血清室温封闭20 min。分别加入抗RhoA(1∶100)、ROCK1(1∶150)、ROCK2(1∶150)、Col1(1∶200)、Col3(1∶100)抗体,4 ℃孵育过夜,滴加 II 抗后继续37 ℃孵育30 min,PBS洗5 min×3次,DAB显色后苏木素复染,封片观察。在100倍镜下随机选取5个不同视野200倍放大,Image-Pro Plus 6.0图像分析软件测定该视野平均光密度(mean density,MD),MD=全部图像的光密度(integrated optical density,IOD)/面积(area),将5张图像MD的平均数视为每例样本的MD,再进行统计分析。
1.2.5 Western blot测定RhoA、ROCK1、ROCK2、p-MYPT1、LN、FN的蛋白水平
取冻存肾脏组织37 ℃水浴解冻后,按质量体积比1∶10加入RIPA 裂解液,研磨组织后于碎冰上裂解30 min,取裂解液,4 ℃、12 000 rpm离心5 min,收集上清液,按试剂盒说明书测定蛋白浓度。根据所需样本体积,以4∶1比例加入5×loding buffer,混匀后沸水浴95 ℃ 5 min使蛋白变性。配制8%、10%分离胶和5%浓缩胶,按蛋白量50 μg上样,进行电泳分离,转PVDF膜,经5% BSA液室温封闭1.5 h后,根据抗体说明书加入稀释后的I抗,4 ℃孵育过夜,TBST洗膜 5 min×3次,加入II抗(1∶10 000)中,室温孵育2 h,TBST洗膜 10 min(4次,ECL(A∶B=1∶1)显色,胶片扫描存档,AlphaEaseFC软件进行条带分析。
1.3 统计学处理方法
2 结果
2.1 12周末各组小鼠24 h Upro、Scr、血糖、体重变化
与NS组相比,DN组24 h Upro、Scr升高(P<0.05);与DN组相比,D+N组、D+H组24 h Upro、Scr降低(P<0.05),血糖、体重差异无统计学意义(P>0.05);D+N组与D+H组24 h Upro、Scr、血糖、体重的差异无统计学显著性(P>0.05)(见图1)。
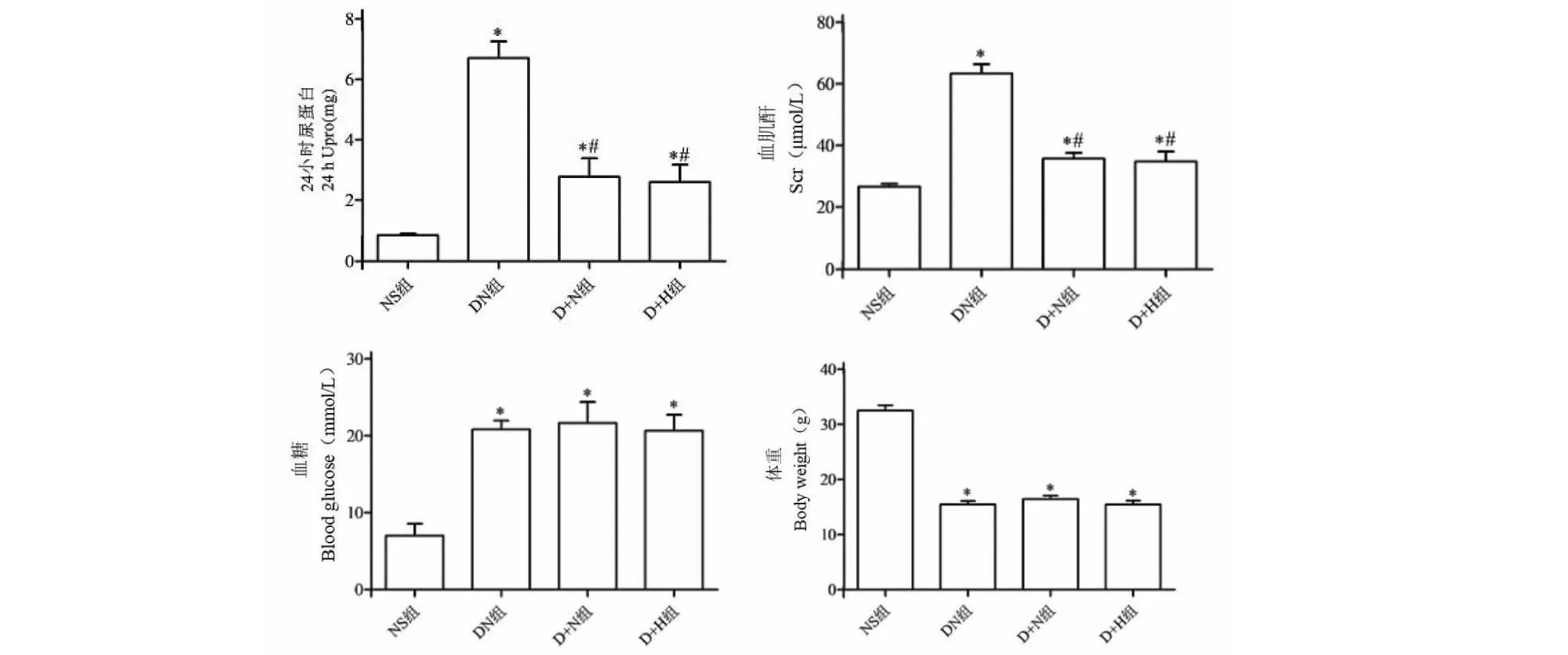
图1 12周末各组小鼠24 h Upro、Scr、血糖、体重的变化Fig.1 The 24 h Upro,Scr,blood glucose and body weight of the mice were detected at the end of 12 注:与正常组比较,*P<0.05;与模型组比较,#P<0.05。Note:*P<0.05 vs NS group;#P<0.05 vs DN group.
2.2 肾脏组织病理学观察
各组小鼠肾脏HE及Masson染色观察NS组肾小球、肾小管及系膜结构排列整齐,轮廓清楚,间质可见少许胶原纤维;DN组肾小球肥大,肾小管上皮细胞结构排列紊乱并且不同程度变性及坏死,系膜基质增多,间质可见大量胶原纤维;D+N组、D+H组肾小球、肾小管及系膜结构排列较整齐,轮廓大致清晰,间质可见少量胶原纤维。肾脏胶原容积分数比较,DN组较NS组的水平明显升高(P<0.05);与DN组比较,D+N组、D+H组的水平明显降低(P<0.05);D+N组与D+H组的水平差异无统计学显著性(P>0.05)(见图2)。

图2 各组小鼠肾脏组织HE及MASSON染色Fig.2 The representative images of HE and Masson staining in each group under light microscope (×200) 注:与正常组比较,*P<0.05;与模型组比较,#P<0.05。Note:*P<0.05 vs NS group;#P<0.05 vs DN group.
2.3 免疫组化观察肾脏组织中RhoA、ROCK1、ROCK2、Col1、Col3的水平
棕黄色颗粒为阳性反应。与NS组相比,DN组RhoA、ROCK1、ROCK2、Col1、Col3的水平升高(P<0.05);与DN组比较,D+N组、D+H组RhoA、ROCK1、ROCK2、Col1、Col3的水平降低(P<0.05);D+N组与D+H组RhoA、ROCK1、ROCK2、Col1、Col3的水平差异无统计学显著性(P>0.05,见图3)。

图3 免疫组化观察小鼠肾脏组织RhoA、ROCK1、ROCK2、Col1、Col3蛋白水平变化Fig.3 Immunohistochemical identification of protein expression of RhoA,ROCK1,ROCK2,Col1 and Col3 in different group(×200) 注:与正常组比较,*P<0.05;与模型组比较,#P<0.05。Note:*P<0.05 vs NS group;#P<0.05 vs DN group.
2.4 Western blot测定RhoA、ROCK1、ROCK2、p-MYPT1 Thr853、LN、FN的蛋白水平
与NS组相比,DN组RhoA、ROCK1、ROCK2、p-MYPT1 Thr853、LN、FN的水平升高(P<0.05);与DN组相比,D+N组、D+H组RhoA、ROCK1、ROCK2、p-MYPT1 Thr853、LN、FN的水平降低(P<0.05);D+N组与D+H组RhoA、ROCK1、ROCK2、p-MYPT1 Thr853、LN、FN的水平差异无统计学显著性(P>0.05,见图4)。

图4 各组小鼠肾脏组织RhoA、ROCK1、ROCK2、p-MYPT1 Thr853、LN、FN蛋白水平变化Fig.4 The protein levels of RhoA,ROCK1,ROCK2,p-MYPT1 Thr853,LN and FN in different groups determined by Western blot 注:与正常组比较,*P<0.05;与模型组比较,#P<0.05。Note:*P<0.05 vs NS group;#P<0.05 vs DN group.
3 结论
DN肾病早期病理改变以肾小球硬化、肾小动脉损害、肾小管退行性变为主,并逐渐出现肾脏纤维化,晚期出现大量蛋白尿及肾衰竭[6]。柚皮素为黄酮类化合物代表性药物之一,文利等[5]发现柚皮素可能通过下调TGF-β1/smad信号通路减轻DN大鼠肾脏纤维化,保护肾脏功能。Ning等[7]进一步研究发现柚皮素上调let-7a的表达,后者负调节转化生长因子-β1受体1(transforming growth factor-β1 receptor 1,TGFBR1)进而抑制TGF-β1/smad 信号通路进而治疗DN。此外,柚皮素还可能通过下调氧化应激水平,抑制炎症因子的表达及细胞凋亡等途径延缓DN进展,保护肾脏功能[8]。本研究中,通过采用STZ腹腔注射建立1型糖尿病小鼠模型后继续喂养4周以24 h Upro大于造模前2倍视为DN模型复制成功,成模后予柚皮素50 mg/(kg·d)灌胃12周,并设置法舒地尔40 mg/(kg·d)腹腔注射作为阳性对照组,检测模型组小鼠血糖升高,体重减少,肾脏组织结果显示Col1、Col3、LN、FN表达增加,病理切片也可见明显肾纤维化,并伴有明显蛋白尿及肾功能下降,而柚皮素和法舒地尔分别干预后Col1、Col3、LN、FN表达减少,肾纤维化减轻,蛋白尿及肾功能得到改善,血糖及体重较模型组无明显变化,说明了柚皮素、法舒地尔能够改善DN肾纤维化,且不影响体重及血糖。
RhoA为小分子三磷酸鸟苷(guanosinetriphosphate,GTP)结合蛋白中Ras超家族的一员。酪氨酸激酶和G蛋白偶联受体能够募集并激活RhoA的鸟苷酸交换因子(guanine nucleotide exchange factors,GEF),从而使RhoA由GDP结合的非活化状态转换为GTP结合的活性状态,RhoA扮演分子开关的角色实现两种状态之间的转换,作用于其下游信号分子产生生物学效应[9]。Rho相关蛋白激酶(rho-associated protein kinase,ROCK)是第一个被发现的同时也是目前功能研究最为明确的RhoA下游效应分子。ROCK的相对分子质量约为160 kDa,属于丝氨酸/苏氨酸蛋白激酶家族系统。ROCK存在两种亚型:ROCK1和ROCK2,二者基本结构包括3个主要的结构域:N端的具有催化作用的激酶域、中间包含Rho 结合域(rho binding domain,RBD)的卷曲螺旋结构区、C端富含半胱氨酸(cysteine-rich domain,CRD)的PH结构域。ROCK1和ROCK2 65%氨基酸序列是一致的,激酶域的同源性可达92%[10]。ROCK 在大多数组织中都有表达,但不同组织中存在异质性,ROCK1主要表达于肝、睾丸、脾、肾和肺等,ROCK2主要表达于大脑、骨骼肌、心脏等[11]。RhoA/ROCK组成的信号通路通过与下游底物肌球蛋白轻链(myosin light chain,MLC)、MYPT-1、CPI-17、ERM等相互作用参与细胞增殖、粘附、迁移、凋亡等生理活动的调节[12]。在病理状态下,RhoA/ROCK信号通路上调多种促纤维化因子的分泌,如血小板源性生长因子(platelet-derived growth factor,PDGF)、血管紧张素Ⅱ(angiotensin II,AngII)、内皮素-1(endothelin,ET-1)、单核细胞趋化因子-1(monocyte chemotactic factor,MCP-1)、白细胞介素-6(interleukin,IL-6)、转化生长因子-β1(transforming growth factor-β1,TGF-β1)、结缔组织生长因子(connective tissue growth factor,CTGF)等的表达[13]。ROCK也可诱导核转录因子kappa B(nuclear factor kappa B,NF-κB)的活化,而后者的激活又可上调肿瘤坏死因子(tumor necrosis factor,TNF-ɑ)、IL-1β等促纤维化因子的分泌[14]。法舒地尔是目前第一个也是唯一批准上市可用于临床的ROCK抑制剂,因其强大的扩血管作用,而被广泛应用于蛛网膜下腔出血、缺血性心脏疾病等血管痉挛疾病,其能够有效结合ATP依赖的激酶结构域阻断ROCK进而抑制RhoA/ROCK信号通路的信号转导[15]。在DN领域,法舒地尔亦被广泛研究,并且通过影响以下多种途径改善DN:(1)抑制NF-κB、FN、TGF-β的活化,减弱炎症反应,缓解肾小球硬化[16];(2)促进足突细胞的形成[17],恢复异常的收缩运动,减少肾小球滤过膜通透性及蛋白尿形成[18];(3)抑制肾小管上皮细胞间质转化(epithelial-mesenchymal transition,EMT)过程,减弱肾间质纤维化[19];(4)扩张肾脏血管网,改善肾脏血流动力学,减少肾脏损伤[20]。本研究中,与正常组相比,模型组小鼠肾脏组织中RhoA、ROCK1、ROCK2的表达显著升高,MYPT1 Thr853磷酸化程度增加,ROCK活性增高;法舒地尔组与模型组相比肾脏组织中RhoA、ROCK1、ROCK2的表达显著下降,MYPT1 Thr853磷酸化程度减低,ROCK活性减弱,并伴有尿蛋白减少和肾功能改善;与法舒地尔组相似,柚皮素组与模型组相比较,肾脏组织中RhoA、ROCK1、ROCK2的表达显著下降,MYPT1 Thr853磷酸化程度减低,ROCK活性减弱,并伴有尿蛋白减少和肾功能改善,而法舒地尔组与柚皮素组二者各指标差异未见统计学显著性,该实验结果表明RhoA/ROCK信号通路参与DN小鼠肾纤维化的形成,柚皮素改善DN小鼠肾纤维化可能与下调RhoA/ROCK信号通路有关。
综上所述,动物实验研究提示柚皮素能够显著降低DN小鼠肾纤维化程度,其机制可能与下调RhoA/ROCK信号通路有关,但其具体机制及作用位点有待细胞分子水平的进一步深入研究。
