纳米氧化铁的制备及其相变研究
2020-11-09杨信成薛永强
杨信成,薛永强
(1.湖南安淳高新技术有限公司,湖南 长沙 410006;2.太原理工大学 应用化学系,山西 太原 030024)
纳米氧化铁具有良好的耐候性、耐光性、磁性和对紫外线具有良好的吸收和屏蔽效应,可广泛应用于闪光涂料、油墨、塑料、皮革、汽车面漆、电子、高磁记录材料、催化剂以及生物医学工程等方面[1]。现在制备纳米氧化铁的方法很多,但是大部分是制备出Fe3O4超微粒,然后500 ℃煅烧后得到α-Fe2O3[2-4]。而由Fe3O4制备γ-Fe2O3过程中的热处理鲜有报道,这主要是Fe3O4转变为γ-Fe2O3的煅烧温度和煅烧时间很难确定。同时关于煅烧温度和煅烧时间对样品成分影响的研究更是很少。
共沉淀法制备Fe3O4,不仅设备简单、反应条件温和、原料价格低廉、工艺流程短,而且易于工业化生产,且反应过程中成核容易控制、产物纯净度高[5]。为此本文应用共沉淀法制备纳米Fe3O4,然后研究由纳米Fe3O4煅烧得到γ-Fe2O3纳米微粒的煅烧温度和煅烧时间,同时考察纳米氧化铁的相变行为。
1 实验部分
1.1 主要仪器和试剂
仪器:干燥箱,箱式电炉(马弗炉),离心机,X-射线衍射仪,红外光谱仪。
试剂:FeCl3·6H2O,FeCl2·4H2O、浓氨水、十二烷基苯磺酸钠,均为分析纯;实验用水为去离子水。
1.2 纳米γ-氧化铁的制备
称取等比当量的FeCl3·6H2O 和FeCl2·4H2O,用去离子水溶解后倒入三口烧瓶中,置于水浴中加热,且快速搅拌,待温度稳定后,加入一定量的浓氨水,反应1 h,保温0.5 h。用去离子水水洗4~5 次,使其为中性,离心。将所得固体物质放入干燥箱于100 ℃干燥24 h 左右,研磨,即可得到Fe3O4超微粒。将其放入马弗炉中煅烧一定的时间和温度就可以得到γ-Fe2O3纳米微粒。试验方案见表1。

表1 试验方案
1.3 表征手段
1.3.1 X 射线衍射(XRD)
采用XRD-6000 型X 射线衍射仪对微粒进行衍射分析。测试条件:Cu 靶,石墨片滤波,管压40 kV,电流30 mA,步宽为0.020,以8 °/min 的速度从20°扫描到70°。实验中应用此法考察纳米微粒的晶型和晶粒大小,其中晶粒的平均粒径采用谢乐(scherrer)方程:DC=0.089λ/(Bcosθ),其中,B为衍射峰的半峰宽,单位为弧度,θ为Bragg 角,λ为衍射线的波长。
1.3.2 IR 表征
对于Fe304和γ-Fe2O3而言,它们的XRD 谱图基本一样,很难由此区别开来。曾经也有应用热重方法来区别,但是要求样品非常的干燥,这是很难达到的。为此,本文测定样品的红外谱图以鉴别Fe304是否转化为γ-Fe2O3。郭淑云[6]等曾经报道Fe304的红外光谱图中580 cm-1处的吸收峰为其特征峰。γ-Fe2O3的红外光谱图中,695 cm-1和440 cm-1处的吸收峰为其特征峰。α-Fe2O3的红外光谱图中555 cm-1和480 cm-1处的两个吸收峰为α- Fe2O3的特征吸收峰。
1.3.3 TG/DTA 表征
应用TG/DTA 研究了γ-Fe2O3的相变行为。条件:氧气条件下,升温速率为10 ℃·min-1,温度范围为90~600 ℃。
2 结果与讨论
2.1 煅烧温度和煅烧时间对氧化铁成分的影响
通过XRD 和IR 表征研究了煅烧温度和煅烧时间对氧化铁成分的影响。
2.1.1 煅烧温度对样品成分的影响
分别将制得的样品在马弗炉中不同温度下煅烧40 min,然后在空气中退火。分别测定它们的XRD谱图,如图1所示。
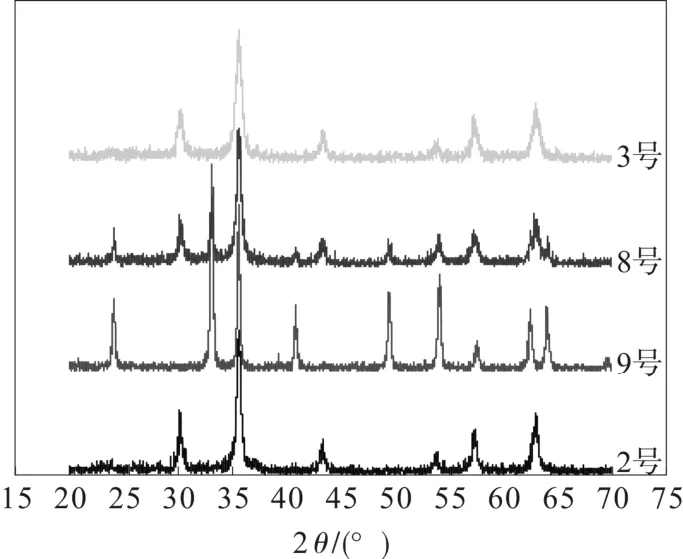
图1 不同煅烧温度下样品的XRD 谱图
从图1 可以看出,400 ℃煅烧后,XRD 谱图在33°出现明显的衍射峰,而这正是α-Fe2O3的特征峰,说明此时已有部分的样品发生晶型转变。而500 ℃煅烧后,其为α-Fe2O3的PDF 卡片的标准谱图是一样的,说明样品已经全部发生晶型转变。可以看出当温度小于300 ℃可能是γ-Fe2O3或者是Fe3O4,而其相变温度可能在300 ℃和400 ℃之间。
为了区别γ- Fe2O3和Fe3O4,测定样品1、样品3、样品5 的IR 谱图,如图2所示。
从图2 可以看出,1 号样品在580 cm-1处有明显的吸收峰,这可能是Fe3O4的特征吸收峰,也有可能是水的特征吸收峰。但是从3 号样品的图谱可以看出,在695 cm-1和440 cm-1处有明显的吸收峰,说明样品为γ-Fe2O3,对比1 号样品的图谱,此处的吸收峰并不明显。再看5 号样品的图谱,其在580 cm-1处的吸收峰不明显,说明300 ℃煅烧2.5 h,Fe3O4已经完全转化为γ- Fe2O3。
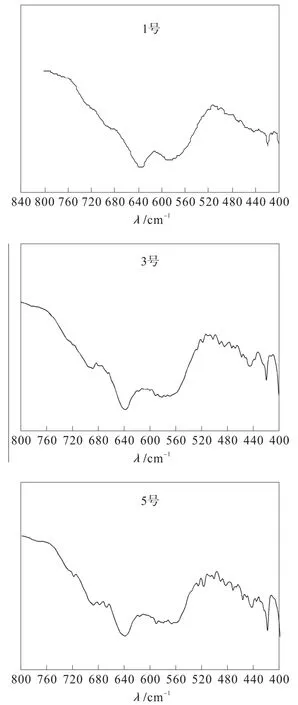
图2 不同样品的IR 谱图
2.1.2 煅烧时间对样品成分的影响
为了研究一定温度下的煅烧时间对样品的影响,选定300 ℃下,分别煅烧40、90、150 min,然后在空气条件下退火,其XRD 谱图如图3所示。
从图3 可以看出,随着煅烧时间的延长,其晶型未发生转变。和图2 比较可以看出,300 ℃煅烧2.5 h 后,580 cm-1处的吸收峰已经不是很明显。且4 号样的XRD 谱图明显在27°出现了γ-Fe2O3的特征峰,说明300 ℃煅烧2.5 h 能使Fe3O4完全转变为γ- Fe2O3。
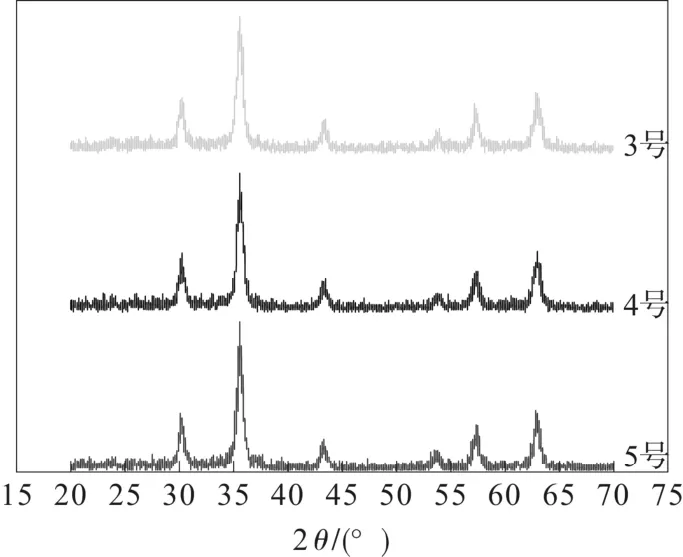
图3 300 ℃下不同煅烧时间的样品的XRD 谱图
2.2 煅烧时间和煅烧温度对样品粒径的影响
为了研究煅烧温度和煅烧时间对粒径的影响,不同的试验方案如表2所示,各样品的XRD 谱图如图4所示。

表2 不同煅烧时间和煅烧温度下的样品
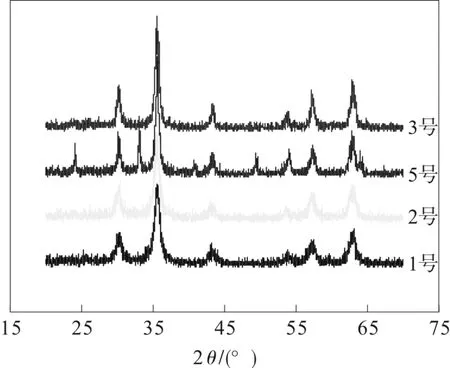
图4 不同样品的XRD 谱图
从表2 可以知道,1 号是样品1 经过200 ℃煅烧30 min 后得到,2 号是未经煅烧的样品1,计算得到它们的粒径基本一样。同样样品2 经过相同的处理,粒径基本也没有改变。而200 ℃煅烧后有部分的Fe3O4转变为γ- Fe2O3。这说明Fe3O4的氧化过程中,粒径没有发生明显的变化,也就是说煅烧温度对粒径基本没有影响。同时从3 号和4 号也可以看出,随着煅烧时间的增加,粒径也基本没有变化。从图4 中不难知道,在400 ℃后样品已发生晶型转变。
可以推断,只有发生晶型转变后,其粒径才有可能发生大的变化。
2.3 纳米γ-Fe2O3微粒的结构相变
图5 是Fe3O4在空气条件下的DTA 曲线图,不难看出,在200 ℃到300 ℃之间有放热峰的出现,可以推测为Fe3O4转化为γ-Fe2O3的一个氧化过程,且氧化过程缓慢。在415 ℃左右有一个较小的放热峰,这是γ-Fe2O3的结构逐渐的从fcc 调整为hcp。而在450 ℃开始有大量的放热现象,这是γ-Fe2O3发生晶型相变,且相变顺序为γ-Fe2O3→α-Fe2O3。
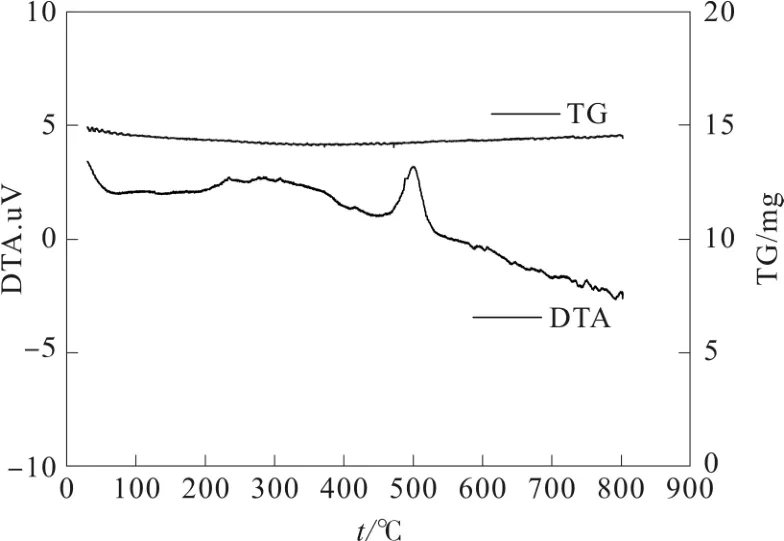
图5 Fe3O4的TG/DTA 图
3 结论
1)通过XRD 和IR 表征证实,制备得到的Fe3O4在300 ℃煅烧2.5 h 后,其完全转化为γ-Fe2O3。而在400 ℃煅烧40 min 后,已有部分的纳米γ-Fe2O3颗粒转化为α-Fe2O3。
2)在纳米氧化铁未发生相变之前,煅烧温度和煅烧时间基本对粒径没有影响,但是如果一旦发生相变,则其粒径会明显变化。
3)由DTA 曲线可以看出,在415 ℃有一个小的放热峰,说明γ-Fe2O3结构由hcp 向fcp 转变。而从450 ℃开始,有一个大的放热峰,这是氧化铁发生相变引起的,且相变顺序为γ-Fe2O3→α-Fe2O3。
