经肋间肌穿刺法测定肺动脉高压小鼠模型右心室压力
2020-11-09魏瑞奇朴春梅张文美朱光发
魏瑞奇,朴春梅,张文美,朱光发*
(1.首都医科大学附属北京安贞医院呼吸与危重症医学科,北京 100029;2.首都医科大学附属北京安贞医院北京市心肺血管疾病研究所,北京 100029)
肺动脉高压(pulmonary hypertension,PH)是一种进行性加重的致命性疾病,其主要特征是肺血管重构和肺血管阻力进行性增高,最终引起右心功能衰竭甚至死亡[1]。 PH 的发生发展过程与肺血管结构和功能异常密切相关,肺血管床内膜损伤、中层肥厚、外膜增殖、纤维化导致肺动脉管腔进行性狭窄、闭塞,肺血管阻力不断升高,但PH 的发病机制尚未完全阐明[2]。 因此,利用实验动物建立PH 动物模型在PH 机制研究中必不可少,常用的PH 动物模型实验动物主要是大鼠和小鼠,其中小鼠由于便于饲养,繁殖能力强,背景清晰,同时目前用于PH 基础研究的基因工程动物主要是小鼠来源[3],因此小鼠PH 模型制备和应用极其重要。
评估PH 动物模型最主要的指标就是血流动力学的测定,因此建立一个快速、准确的评估肺血管及右心室血流动力学状态的方法,是目前该领域亟待解决的问题。 研究表明,在没有肺动脉瓣疾病的情况下,右心室收缩压可用来评估肺动脉收缩压的高低[4],目前常用测定方法有主要有经颈外静脉右心导管术[5-6]、经颈外静脉导丝引导右心导管法[7]、呼吸机辅助开胸直视下穿刺法[8]、开腹经膈肌穿刺右心室法[9]、经胸壁右心室盲穿法[10]等,这些方法主要应用于大鼠。 小鼠的测定方法主要有开胸法[11]、右心导管法等[12-13]。 相较大鼠而言,小鼠重量仅为大鼠的1/10,血管细,心脏小,右心导管操作困难,成本高且耗时,成功率低[11]。 呼吸机辅助的开胸直视穿刺检测需要连接呼吸机和气管插管,且暴露胸腔所造成的人为气胸改变了小鼠生理状态下的心脏所处的密闭环境,可能对测定结果产生不可预测的影响。 最近高阳等[14]PH 模型小鼠采用闭胸右心室穿刺法检测小鼠右心室收缩压,但未描述具体操作方法和步骤。 本研究旨在采用一种经肋间肌穿刺法测定肺动脉高压小鼠模型右心室压力的实验方法,保持动物胸腔密闭无需呼吸机辅助呼吸,使操作便捷高效,介绍如下。
1 材料和方法
1.1 实验动物
SPF 级C57BL/6 J 小鼠23 只,8~10 周龄,体重(20 ± 3)g,购自北京唯尚立拓科技有限公司[SCXK(京) 2016-0009],低氧组11 只,对照组12 只饲养于北京市心肺血管疾病研究所实验动物中心SPF级屏障系统内(湿度40%~70%,温度16℃~26℃)[SYXK (京) 2016-0027]。 本研究实验方案经北京安贞医院伦理委员会批准,实验过程符合实验动物伦理学要求的3R 原则(减少、替代、优化),并给予人道关怀。
1.2 主要试剂与仪器
动物低氧舱(加拿大Optoprobe Research 公司)、Power Lab4/30 多导生理仪(ML866,澳大利亚埃德仪器国际贸易有限公司)、Lab Chart 软件、冷光源(MODEL C-F1230,日本Nikon 公司)、电子天平(JA2003,上海舜宇恒平科学仪器有限公司)、压力换能器探头及三通管、0.6 mm×25 mm 一次性输液器针头(S2D2S,江西科伦医疗器械制造有限公司)、10 mL 及1 mL 注射器、1%戊巴比妥钠(美国Sigma公司)、0.9%生理盐水、酒精喷壶、自制小鼠固定板、医用胶带、眼科镊、眼科剪、医用棉球等。
1.3 实验方法
1.3.1 制备肺动脉高压小鼠模型
23 只小鼠进行完全随机分组,对照组12 只,低氧组11 只。 低氧组小鼠在密闭的低氧舱里饲养4周,诱导形成肺动脉高压,其中低氧舱内24 h 持续泵入空气和氮气的常压混合气体,通过氧气监测控制系统监测,保证低氧舱内氧浓度控制在(10±0.5)%,CO2浓度低于0.5%。 对照组小鼠在正常空气中饲养4 周,其它条件相同。
1.3.2 测定右心室压力的步骤
(1)称重、麻醉及固定:称重记录,根据小鼠体重,按照10 μL/g 剂量给小鼠腹腔注射1%的戊巴比妥钠溶液(0.9%生理盐水配制)进行麻醉,待小鼠肌张力消失、刺激无反应时将其四肢用胶带固定于自制的泡沫塑料鼠板上(图1-1),注意避免使小鼠四肢过度拉伸,以防止对胸腔压力产生影响。
(2)实验仪器调试:多导生理仪连接电脑、压力换能器探头及三通管,三通管的另外两头接输液器针头和装有肝素生理盐水的10 mL 注射器,反复调整将肝素生理盐水充满整个通道,不要留有气泡,打开Lab Chart 软件的RVP 模块,压力基线调零。
(3)剪开胸前皮肤:小鼠切口部位用75%酒精消毒(图1-2),用镊子将小鼠剑突下的皮肤提起,剪开一小口,沿胸骨正中线将小口直到颈部的皮肤剪开(图1-3、图1-4),并在左侧肋缘下剪一斜行的切口,提起两侧的皮肤切口,轻轻向两侧撕开,注意动作轻柔,防止皮下血管破裂出血。 此时可以看到小鼠左侧胸大肌清晰的暴露出来,大致呈一直角三角形(图1-5)。
(4)钝性分离胸肌:用眼科镊将小鼠胸大肌从下缘游离端紧贴胸骨左缘钝性分离(图1-6),分离后镊子垂直提起胸大肌可见其下覆盖的胸小肌,右手持镊轻提提胸小肌内侧缘,左手再拿一镊子钝性分离胸小肌,并且将胸小肌从下至上撑开(图1-7)。
(5)暴露左胸壁肋间隙:将钝性分离好的胸大肌用剪刀沿胸骨附着处剪开并上翻,若有少量渗血,可用棉球擦去,以保持术中视野清晰,同理胸小肌也沿肋弓外下缘剪开并上翻,即可暴露看到小鼠左胸肋骨及肋间隙(图1-8)。
(6)判断心脏位置:透过灯光可见第三、四肋间小鼠心脏快速的搏动,可大致判断出心脏的轮廓,搏动最明显处为心尖,通常位于第四肋间隙,心尖偏右上方处搏动较心尖处稍弱的部位就是右心室。术者左手大拇指在剑突下向上推挤心脏,同时中指向右轻推胸壁,使心脏紧贴左胸前壁并固定(图1-9),同时右手持针快速穿刺。
(7)右室穿刺点的确定:通过(6)确定右心室搏动位置后,选择左侧第四肋肋角内侧大约1 mm 左右的肋下缘作为进针点,先将针头垂直于胸壁的方向持针,然后进针方向各向下、向左(以小鼠的体位作为参照方向)倾斜大约15°角后进行穿刺,穿刺深度大约10 mm,可事先用马克笔在针头上做好标记。穿过右心室壁时可有明显的突破感。 针头成功进入右心室后,可见针管中有回血,随着心脏的搏动有节律的回吸,同时持针的右手可明显感受到心室有力的搏动(图1-10)。 松开挤压小鼠胸壁的左手,右手固定穿刺针,在Lab Chart 软件界面可以看到右心室搏动的压力曲线趋于稳定,记录一段稳定的右心室压力波形后拔出针头。
(8)开胸验证穿刺点位置:迅速从剑突下向两侧剪开胸廓下的肌肉和组织,剪破膈肌,沿胸骨正中线剪开胸骨,将游离的两侧胸壁向两侧拉开,镊子剥开心包膜,暴露心脏,用棉球擦去表面积血,仔细观察可在右心室壁表面看到一个正在渗血的穿刺点(图1-11、图1-12),验证了步骤(7)的针头成功刺入右心室,得到的波形图为右心室压力变化曲线。
(9)实验数据记录及数据分析:Lab Chart 软件上记录整个过程压力的变化。 选择一段平稳的波型(如图2、图3),鼠标右键选中该段波形,点击添加到数据板,在数据板中则可查看该段波形的平均右心室收缩压。
1.3.3 右心室肥厚指数的测定
分离小鼠心脏,剪去心耳和大血管,生理盐水洗去心腔内残血,再沿室间隔剪下右心室,用滤纸吸去其水分,用电子天平分别称量右心室(RV)、左心室+室间隔(LV+S)的质量,最后计算右心室肥厚指数[RVHI=RV/(LV + S)× 100%],作为右室肥大的指标。
1.3.4 肺组织的处理
摘下两肺,分离出左肺,用0.9%的氯化钠注射液冲洗干净,固定于4% (体积分数) 多聚甲醛溶液中24 h,然后依次进行梯度乙醇脱水,石蜡包埋,做4 μm /张的连续切片,进行苏木素-伊红染色(HE 染色)和α-平滑肌肌动蛋白免疫组化染色(a-SMA 染色),最后在光镜下(200 ×)观察比较肺小动脉形态学变化。
1.4 统计学方法
使用SPSS 22.0 统计学软件对数据进行分析,实验数据以平均数±标准差(¯x±s)来表示,两组数据采用两独立样本t 检验,以P<0.05 为差异有统计学意义。

图1 实验操作步骤图Figure 1 Experimental procedure diagram
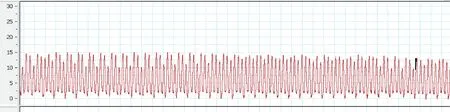
图2 正常小鼠的右室压力曲线图Figure 2 The RVSP curve of normal mouse
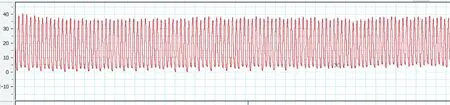
图3 肺动脉高压小鼠的右室压力曲线图Figure 3 The RVSP curve of pulmonary hypertension mouse
2 结果
2.1 造模4 周后小鼠的一般情况
低氧组小鼠较对照组活动量明显减少,呼吸急促,毛发无光泽,口唇发紫,进食饮水量也明显减少,胸壁肌肉发红发紫。 与对照组相比,低氧组小鼠体重明 显 降低,[(18.24 ± 2.36) 比(22.62 ±2.87)],差异有显著性(P<0.05),结果见表1。
2.2 右室压力曲线
从小鼠固定到测出右心室压力曲线,整个过程可在3~4 min 内完成,低氧组11 只小鼠的RVSP 全部测出,对照组12 只小鼠中,有1 只测定失败,穿刺成功率达95.65%(22/23)。 在推挤胸廓固定心脏穿刺成功的几秒内,压力峰值较高且波动较大,术者松手后,峰值略有下降并逐渐平稳,选取该段平稳的压力曲线得到RVSP 值(图2、图3):稳定后的压力波形为规则的单峰锯齿状,随着呼吸节律的变化有轻微的波动,低氧组小鼠的RVSP 明显高于对照组[(30.48±2.95) mmHg 比(17.50±3.40) mmHg],差异有显著性(P<0.05),结果见表1、图4a。
2.3 右室肥厚指数及肺小动脉病理改变
低氧组小鼠RVHI 也显著高于对照组[(35.31±3.78)%比(23.14±4.29)%],差异有显著性(P<0.05),结果见表1、图4b。 HE 染色显示低氧组小鼠肺小动脉管壁明显比对照组增厚,a-SMA 免疫组化染色显示管壁增厚部分为平滑肌细胞,说明低氧组小鼠组织学水平也呈现出肺动脉高压的病理变化,肺小动脉重构(图5)。

表1 小鼠体重、RVSP、RVHI 的比较( ¯x ±s)Table 1 Body weight, right ventricular systolic pressure, and the index of right ventricular hypertrophy of the two groups
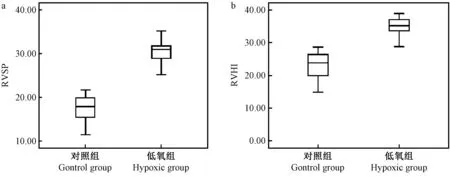
图4 对照组和低氧组右心室收缩压和肥厚指数的比较Figure 4 Comparison of RVSP and RVHI between the control group and the hypoxic group
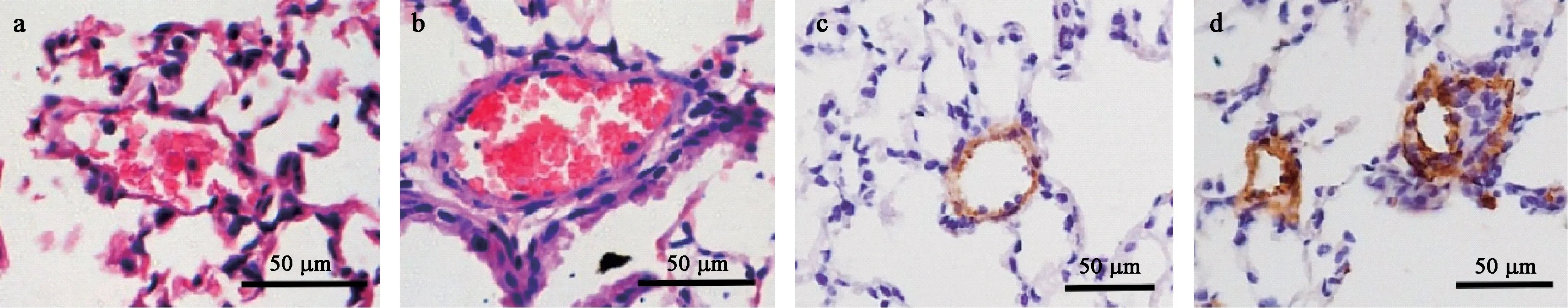
图5 肺小动脉的病理改变(× 200)Figure 5 Pathological changes of pulmonary arteriole
3 讨论
随着基因工程小鼠制备技术的发展和成熟,加之小鼠品系繁殖力强,繁殖周期短,饲养成本较低,基因背景较清楚[15],因此小鼠模型在肺血管疾病研究中的应用越来越多,右心室压力测定是评估小鼠血流动力学的一种重要手段,有研究指出,右室流出道无狭窄及肺动脉瓣无病变时,肺动脉收缩压与右心室收缩压基本一致,通过测量右室收缩压可间接反映肺动脉收缩压[5,13]。 探求一种简便快捷并易于普及的小鼠右心室血流动力学的测定方法有着非常重要的意义。
目前国内测定大鼠和小鼠右室及肺动脉压力方法主要有经颈外静脉V 形切口右心导管法,经导丝引导的右心导管法、开胸直视下穿刺右心室法或开腹经膈肌穿刺右心室法,其中报道最多的是右心导管法,由于是盲插,普遍面临着导管在静脉交汇处无法顺利通过、误入下腔静脉、在右心房或右心室内打卷,刺破壁薄的静脉引起胸腔内出血、导管前段刺激右心室引起心律失常等,导致检测指标不准确或失败[5,7-9,11]。 而对于导丝引导下的穿刺法虽然一定程度上减少了导管直接操作的盲目性,但需要X 线定位,增加实验者放射线暴露[7]。 另外对于导管的选择,要么价格昂贵(Millar 导管,3.5 万人民币),要么自制过程复杂(PE 导管)且易损耗[12],不利于实验的进行。 开胸直视下穿刺右心室法需气管插管和呼吸机通气辅助,操作较为繁琐,而且人为打开胸腔可能会影响心脏外周压力,同样开腹经膈肌穿刺也有着同样的缺点,使得检测指标不能反映正常心脏解剖条件下的血流动力学。 小鼠体型小、体重轻、血管壁薄及心脏体积小,进行上述操作问题更加突出,右心室血流动力学测定一直是肺动脉高压小鼠模型评估中的一大难题,本实验采用的经肋间肌穿刺法测定小鼠右心室压力的实验方法,较好地解决了这些难题。
实验中通过分离小鼠胸部皮肤和浅层肌肉暴露肋间隙,观察心脏的轮廓并判断右心室的位置,从而进行准确的穿刺,由于操作简便快捷和无需进行插管和呼吸机辅助通气,大大缩短了测定压力曲线所需要的时间,从胸部消毒开始到测出压力平均需要3~4 min,同时也因胸腔密闭,减少了开胸对肺循环心脏血流动力学的影响,因而操作简便快捷,结果真实可靠。 另外,使用材料主要有一次性输液器针头和手术器械及自制固定板,来源方便,能够重复利用,不需要自行制备右心PE 导管,成本低廉。
操作步骤和技巧是取得实验成功的关键。 我们总结出以下几点操作细节:①要钝性分离胸大肌、胸小肌以暴露肋间隙,避免损伤肋间肌及胸膜引起气胸;②透过肋间隙观察心脏时,左手手指一定要轻轻推挤胸壁,使心脏紧贴左胸前壁固定,这样才能准确判断右心室的位置;③穿刺时一定要掌握好进针角度和深度,进针角度为持针手偏向小鼠头侧和左侧各15°左右,深10 mm 左右,事先做好标记,应注意一次性进针,进针后若波形未立即出现,可能是针尖口刚好贴着心肌壁,可轻微调整进针深度。 右心室穿刺成功后测压应选取动物胸腔不受挤压、RVSP 曲线稳定的那一部分作为实验数据;④保证整个测压系统密闭性和通畅性,管内不能留有气泡,以免影响压力传导,每完成一次操作,要及时地推注注射器内的肝素生理盐水,防止针头内出现血凝块,针头变钝时应及时更换。
本实验中的肺动脉高压小鼠模型为持续性低氧诱发,慢性缺氧引发肺动脉高压的特征性变化是肺血管发生重塑,肺血管细胞尤其是平滑肌细胞发生慢性增殖,各级肺血管管壁明显增厚,肺循环外周阻力增加,肺动脉压进行性升高,最终导致右心室增大,发展为右心衰竭[9]。 本实验结果显示低氧组动物RVSP 和RVHI 显著升高,病理示低氧组小鼠肺小动脉管壁明显较对照组增厚和平滑肌细胞增殖,与国内外其它实验测得的数据相近[12-13]。 综上所述,本文详细介绍了一种经肋间肌穿刺法测定肺动脉高压小鼠模型右心室压力的实验方法,保持动物胸腔密闭无需呼吸机辅助,且操作简单、方便快捷、成功率高,值得推广应用。
