香菇抗氧成分分析及其对运动机体影响*
2020-11-08谢庆团
谢庆团,何 英
(北京体育大学武术学院,北京 100084)
香菇(Lentinus edodes) 起源于中国,是我国重要的食用菌和栽培菌,其产量仅次于双孢蘑菇(Agaricus bisporus),是世界第二大食用菌[1]。香菇属担子菌纲(Basidaiomycetes) 伞菌目(Agaricales) 口蘑科 (Tricholomatacete) 香菇属 (Lentinus)[2]。我国拥有丰富的森林资源,是世界上第一个栽培食用菌的国家,最早的食用菌栽培历史已有800多年[2]。
香菇不仅具有丰富的营养价值和重要的经济价值,而且还具有多种药用和保健价值,如可增强机体免疫力、抗肿瘤、降血糖、降血脂、抗氧化、抗病毒等[1]。近年来,香菇的多种医疗保健功能及其作用机理已成为医药、食品等领域的研究热点。部分学者研究了香菇的体外抗氧化作用,有文献以香菇为原料,经水萃取和乙醇沉淀,获得了具有高抗氧化活性的复合物成分Le-II[3-4]。通过DPPH自由基清除试验,发现Le-II有更好的自由基清除能力。
为进一步开发利用香菇资源提供数据和科学依据,以香菇子实体为研究对象,通过试验探究香菇的抗氧化作用及其机理。
1 材料与方法
1.1 试验材料
香菇子实体干品,购于山东七河生物科技股份有限公司。40只ICR清洁小鼠,雌雄各半,体重约为(20±2) g,江苏医学院实验动物中心提供(动物合格证编号:SYXK(SU) 2013-0036)。
1.2 主要试剂和仪器
1.2.1 主要试剂
生理盐水、苦味酸、浓硫酸和其他常规分析试剂;蛋白质定量、总抗氧化能力、超氧化物歧化酶、谷胱甘肽过氧化物酶、单胺氧化酶测定试剂盒和过氧化物酶测定试剂盒。本次检测试剂采用深圳华大基因股份有限公司产品,按说明书操作。
1.2.2 主要仪器设备
Al104电子天平、BS210S精密天平、电动恒温鼓风干燥箱、冷冻离心机、台式低速离心机、组织匀浆器、数显恒温水浴锅、Mul 9000超纯水制备系统、JH-722S可见分光光度计、Elx800酶标记、医用注射器、小鼠专用灌胃针头、小鼠群养笼具。
1.3 试验方法
1.3.1 原料预处理
取香菇样品于60℃的烤箱中干燥,超细粉碎机粉碎后过300目筛,将香菇粉保存于密封袋4℃冰箱中备用。
1.3.2 动物饲养及分组
整个测试过程保持室温为(25±1)℃,相对湿度为50%,暗室照亮12 h。适应性喂养3 d后,将40只小鼠随机分为4组:空白(生理盐水) 对照组、试验低剂量组、中剂量组和高剂量组,每组10只。在各组中用5%苦味酸溶液0.5 mL~1.0 mL用于饲喂标准小鼠。所有小鼠均饲喂碱性饲料,并饲喂白开水4周。每天观察并记录各组小鼠的体重,饲料消耗和饮水消耗。
1.3.3 灌胃剂量设计
空白对照组的小鼠每天喂食盐水,每只小鼠的日剂量为0.2 mL·100-1g-1。香菇的低剂量组、中剂量组和高剂量组小鼠的每日摄入香菇粉重量为0.8 g·100-1g-1、1.6 g·200-1g-1和 2.5 g·300-1g-1。
1.3.4 饲料消耗量的测定
为了观察连续饲喂4周对小鼠的摄食状况的影响,分别在第1天、第14天和第38天测量并记录每组小鼠的饲料消耗。在管饲结束时,在第1天、第14天和第28天称重每组小鼠饲料重量,并于24 h后,称量每组小鼠剩余饲料量,忽略饲料的浪费。每只小鼠饲料消耗(W,g)的公式如下。
式中:M为饲料重量(g);m为24 h后剩余饲料重量(g);n为每组小鼠数量[5]。
1.3.5 小鼠体重的测定
为了观察连续饲喂4周对小鼠生长和发育的影响,在第1天、第14天和第28天称重并记录每组小鼠的体重,并计算在测量区段内小鼠体重的增加水平。
1.3.6 体内生理生化指标测定
1) 脏器指数的测定
每组10只小鼠通过管饲喂养4周。最后1次灌胃1 h后,解剖各组小鼠,取全脑,心脏和肝脏,用冷生理盐水洗涤,用滤纸干燥,称重并记录数据,其器官指数(A,%)公式为:
式中:Q为小鼠器官重量(g);G为小鼠体重(g)。
2) 各指标数据测定
在最后1次灌胃后1 h,从每组的10只小鼠的眼睛中收集血液。将血液冷冻并以3 000 r·min-1离心15 min。分离每组小鼠的血清样品,并于-20℃下保存以备使用。同时,从全脑和肝脏、心脏组织中分别用冷生理盐水制成10%的脑匀浆、10%的肝匀浆和10%的心脏匀浆,将其保存于-20℃下。根据测试试剂盒说明测量血清,全脑和肝脏中的总抗氧化能力、超氧化物歧化酶(SOD) 活性、丙二醛(MDA) 活性、谷胱甘肽过氧化物酶含量(GSHPx)、全脑中单胺氧化酶含量(MAO) 和心脏中过氧化物酶(POD) 含量。
1.4 数据处理
通过PASW statistics 18软件区分所有试验数据;ANOVA用于显着性分析,LSD用于多种比较的一种方法。P<0.05为显着差异,P<0.01为显着差异。
2 结果分析
2.1 灌胃不同剂量香菇对小鼠体重的影响
试验中不同剂量的香菇粉对小鼠体重的影响见表1。

表1 灌胃不同剂量香菇对小鼠体重的影响Tab.1 Effects of different doses of Lentinus edodes on body weight of mice
从表1可以看出,随着饲养天数的增加,各组小鼠的体重逐渐增加,而在第1天、第14天和第28天的测量数据中,小鼠的体重未有显著差异。与对照组相比,香菇粉低剂量组、中剂量组和高剂量组小鼠在试验过程中的体重增加不明显(P>0.05),说明小鼠的体重和生长与食用香菇粉无明显关系。同时,在整个喂养过程中,各组小鼠活跃、食欲良好、皮毛光滑有光泽,无明显脱毛现象。
2.2 灌胃不同剂量香菇对小鼠脏器指数的影响
器官指数可以在一定程度上反映食物和药物对小鼠器官的影响,从而初步分析食物和药物的毒性和安全性,灌胃不同剂量香菇对小鼠脏器指数的影响见表2。

表2 灌胃不同剂量香菇对小鼠全脑指数的影响Tab.2 Effects of different doses of Lentinus edodes on the whole brain,liver and heart index of mice
表2显示了不同剂量的香菇对小鼠全脑活力的影响。从表2中可以看出,连续4周不同剂量香菇连续给药4周后,小鼠的全脑MAO与对照组相比无显著差异(P>0.05),表明香菇的食用对小鼠的脑未产生影响。
2.3 小鼠血清、全脑及肝脏中总抗氧化能力
T-AOC可以全面反映非酶和酶防御系统的抗氧化能力,而不是单一的抗氧化酶活性,因此更能全面地反映人体的抗氧化能力[6]。灌胃不同剂量香菇对小鼠血清、全脑及肝脏中总抗氧化能力的影响,见表3。

表3 小鼠血清、全脑及肝脏中总抗氧化能力的影响Tab.3 Effects of total antioxidant capacity in serum,whole brain and liver of mice
从表3中可以看出,香菇粉的低剂量组、中剂量组和高剂量组与对照组相比,血清、全脑和肝脏中的T-AOC含量都有增加的趋势。不同剂量组血清和肝脏中的T-AOC含量明显升高,具统计学意义(P<0.01)。表明香菇具有提高血清、脑和肝总抗氧化的能力。
2.4 小鼠血清、全脑及肝脏中超氧化物歧化酶活力
SOD是体内主要的抗氧化酶之一,可以有效清除氧自由基并保护细胞免受氧化的损伤,其活性直接反映清除氧自由基的能力。不同剂量的香菇对小鼠血清、脑和肝中SOD活性的影响见表4。

表4 小鼠血清、全脑及肝脏中超氧化物歧化酶活力的影响Tab.4 Effects of the activities of SOD in serum,whole brain and liver of mice
由表4可知,香菇的低剂量组、中剂量组和高剂量组与对照组相比,血清、全脑和肝脏的SOD活性均有增加的趋势。就血清SOD活性而言,香菇不同剂量组与对照组相比,可显著提高血清SOD活性(P<0.01)。对于脑SOD活性,仅有香菇高剂量组才显现出明显差异性(P<0.05),低剂量和中剂量组无显著影响。对肝脏SOD活性的影响中,除低剂量组外,中剂量组(P<0.05) 和高剂量组(P<0.01) 对肝脏中SOD活性有显著影响。结果表明,香菇对提高血清和肝脏中SOD的活性有较强的作用,对改善脑SOD的活性有较明显作用。
2.5 小鼠血清、全脑及肝脏中丙二醛含量
MDA是一种脂质过氧化物,是由氧自由基攻击生物膜和脂肪酸形成。MDA和SOD均是与体内氧化作用密切相关的活性物质。SOD活性的水平直接反映了人体清除氧自由基的能力,而MDA的水平间接反映了自由基对人体细胞的攻击作用,因此通常配合使用测量,结果见图5。
由表5可知,香菇的低剂量组、中剂量组和高剂量组与对照组相比,具有降低血清、全脑和肝脏中MDA含量的趋势。对于血清和脑中的MDA含量,与对照组相比,香菇中剂量组显著降低血清和脑MDA含量(P<0.05),而香菇高剂量组可更显著降低血清和脑中MDA含量(P<0.01);对于肝MDA,中剂量组和高剂量组可显着降低肝MDA含量(P<0.01)。结果表明香菇可以降低血清、脑和肝脏中的丙二醛含量,并有效减少体内产生的脂质过氧化物产生。

表5 小鼠血清、全脑及肝脏中丙二醛含量的影响Tab.5 Effects of malondialdehyde content in serum,whole brain and liver of mice
2.6 小鼠血清、全脑及肝脏中谷胱甘肽过氧化物酶活力
GSH-Px是人体中重要的抗氧化酶,广泛存在于各种组织和器官中。可以阻止过氧化物对人体造成的自由基破坏,并催化氧化产物过氧化氨的分解,从而保护细胞膜免受过氧化的破坏[7]。不同剂量的香菇对小鼠血清、全脑和肝脏中GSH-Px活性的影响见表6。
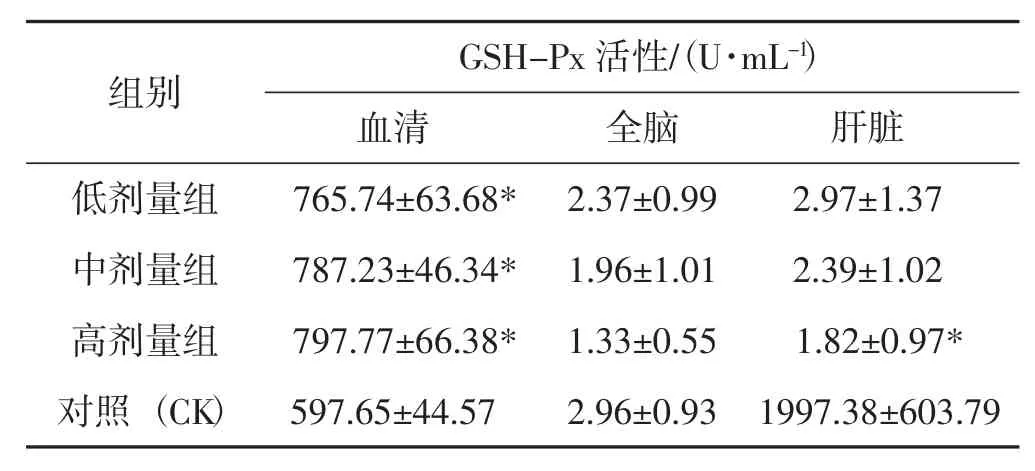
表6 小鼠血清、全脑及肝脏中谷胱甘肽过氧化物酶活力的影响Tab.6 Effects of glutathione peroxidase activity in serum,whole brain and liver of mice
从表6可以看出,香菇的低剂量组、中剂量组和高剂量组与对照组相比,可提高血清和肝脏中GSH-Px活性,对脑GSH-Px活性无显著影响。香菇不同剂量组与对照组相比,可显着增加血清GSH-Px活性(P<0.01);只有香菇高剂量组才能显著提高肝脏GSH-Px活性(P<0.05)。结果表明香菇对改善血清和肝脏中的GSH-Px活性具有很好的作用。
2.7 小鼠全脑单胺氧化酶活力及心脏过氧化物酶活力
MAO在体内分布广泛。以脑、肝脏、肾等组织中含量最多。研究发现MAO活性随年龄的增长而迅速增加,可能与衰老密切相关。POD可以将过氧化氢转化为无害的水和氧气,从而消除过氧化氢对人体的伤害。不同剂量香菇对小鼠全脑单胺氧化酶活力及心脏过氧化物酶活性的影响见表7。

表7 小鼠全脑单胺氧化酶活力及心脏过氧化物酶活性的影响Tab.7 The effects of monoamine oxidase activity in the whole brain and cardiac peroxidase activity of mice
从表7可以看出,与对照组相比,香菇的低剂量组、中剂量组和高剂量组均可降低全脑MAO活性,增加心脏POD活性。中剂量组和高剂量组可显著降低全脑的MAO活性(P<0.05),分别降低28.7%和26.5%。高剂量香菇可在正常脑衰老过程中抑制过高的MAO活性。除低剂量组外,中剂量组可显着增加小鼠心脏的活动(P<0.05),高剂量组可显著增加小鼠心脏瓣膜的活动(P<0.01)。结果表明香菇可催化有害物质过氧化氢的分解,从而减少自由基和脂质过氧化物的形成,并可有效减少心脏氧化活动。
3 讨论
通过测量血清、全脑、肝脏、心脏和其他组织的总抗氧化能力以及抗氧化酶和代谢产物等多种生化指标[8-9],研究香菇对小鼠抗氧化能力的影响。结果显示香菇可改善各种抗氧化酶的活性,消除体内产生的过量自由基,催化有害物质的分解,有效防止或减少自由基引起的氧化损伤,从而起到抗氧化作用[10]。综上所述,香菇具有良好的抗氧化作用,可为新型保健食品的开发提供科学依据。
