一种基于RNA-seq验证的人肾癌细胞和正常细胞原代培养方法
2020-11-06周晓光王浩舟李彦生
周晓光 王浩舟 李彦生
[摘要] 目的 建立更加快速便捷的肾脏肿瘤及正常肾小管上皮细胞原代培养方法。 方法 选取2019年1—3月首都医科大学附属北京朝阳医院行肾癌根治性切除术和肾部分切除术后患者新鲜的肾透明细胞癌组织和肾脏皮质组织。采用机械分解,胶原酶消化和细胞连续筛分提纯的方法提纯肿瘤和正常原代细胞。分别通过转录组测序(RNA-seq)技术鉴定两种原代细胞的遗传背景,免疫细胞化学鉴定细胞标志物的表达,透射电镜观察原代细胞的超微结构。最后采用裸鼠荷瘤模型鉴定肿瘤细胞的成瘤特性。 结果 共计分离纯化3株人近端肾小管上皮原代细胞,8株肾透明细胞癌原代细胞。RNA-seq显示测序结果符合两类细胞的遗传学背景,免疫细胞化学可鉴定出近端肾小管上皮细胞标志蛋白的表达。透射电镜可观察到两类细胞特异性超微结构。裸鼠荷瘤模型证实了肾癌原代细胞的成瘤特性。 结论 成功建立并确定一种快速便捷的肾癌细胞和肾小管上皮细胞原代培养的流程和方法。
[关键词] 原代细胞培养;肾细胞癌;近端肾小管上皮细胞;转录组测序
[中图分类号] R737.11 [文献标识码] A [文章编号] 1673-7210(2020)09(b)-0004-05
[Abstract] Objective To establish a more rapid and convenient method for primary culture of renal tumor and normal renal tubular epithelial cells. Methods Fresh clear renal cell carcinoma tissue and renal cortical tissue from patients undergoing radical nephrectomy and partial nephrectomy in Beijing Chaoyang Hospital, Capital Medical University from January to March 2019 were selected. The tumor and normal primary cells were purified by mechanical segmentation, collagenase digestion and continuous cell screening and purification. The genetic background of the two primary cells was identified by transcriptomic sequencing (RNA-seq) technique, the expression of cell markers was identified by immunocytochemistry, and the ultrastructure of the primary cells was observed by transmission electron microscopy. Finally, the tumorigenesis characteristics of tumor cells were identified by the model of nude mice bearing tumors. Results A total of three human proximal tubular epithelial primary cells and eight renal clear cell carcinoma primary cells were isolated and purified. RNA-seq showed that the sequencing results were consistent with the genetic background of the two types of cells, and immunocytochemistry could identify the expression of marker proteins in the proximal renal tubular epithelial cells. Two kinds of cell specific ultrastructure could be observed by transmission electron microscope. The tumor bearing model of nude mice confirmed the tumorigenic properties of primary renal cell carcinoma cells. Conclusion A rapid and convenient processes and methods for primary culture of renal carcinoma cells and renal tubular epithelial cells is successfully established.
[Key words] Primary cells culture; Renal cell carcinoma; Human proximal tubular epithelial cells; Transcriptomic sequencing
腎细胞癌(renal cell carcinoma,RCC)是泌尿生殖系统第二大肿瘤。进展期肾癌的治疗主要集中在靶向治疗和免疫治疗两个方面,治疗方法有限[1]。寻求更加有效的肾癌治疗方法是临床和科研工作者面临的一个重大挑战。精准治疗在RCC的治疗过程中越来越受到重视。由于RCC肿瘤异质性的存在[2],商业化的肾癌细胞系虽可用作开发新的治疗方法的疾病模型,但在基因组和转录水平上并不能准确地反映原发肾癌的遗传特性。RCC的主要细胞亚型为肾透明细胞癌(ccRCC)。全基因组分析显示ccRCC细胞系的基因拷贝数改变和ccRCC组织存在较大差异[3]。又有研究发现两者的基因转录普差异更为显著[4]。越来越多的文献报道了原代细胞培养在肿瘤研究中的重要性[5-7]。更为重要的是,由于缺乏与肿瘤细胞相匹配的正常对照细胞,进一步限制了抗肿瘤药物筛选、药理毒性研究等科研工作的开展。本研究描述了一种快速便捷的人肾癌细胞(human renal tumour cells,HRTC)和人近端肾小管上皮细胞(human proximal tubular epithelial cells,HPTEC)原代培养的标准化流程和方法,并用转录组测序(RNA-seq)的方法对培养物的遗传学背景加以确认。为RCC个性化药物治疗方法的发展提供了重要实验基础。
1 材料与方法
1.1 主要试剂和材料
原代HRTC培养于含10%胎牛血清的IMDM(Gibco,12440053)培养基中。原代HPTEC培养于肾脏上皮细胞生长专用培养基(PromoCell,c-26030)中。细胞培养用青霉素/链霉素溶液,0.05%胰蛋白酶EDTA溶液,不含CaCl2和MgCl2的HBSS缓冲液均购自于Gibco,Ⅱ型胶原酶购自于worthington(LS004176-1GM)。碱性磷酸酶试剂盒购自于南京建成生物工程研究所(D001-1-1)。Pan-Cytokeratin(CK)抗体(ZM-0069)、α-SMA抗体(ZM-0003)、Vimentin抗体(ZM-0260)、PAX8抗体(ZM-0468)和S-P偶联免疫组织化学试剂盒(SP-9000)购自于北京中山金桥生物技术有限公司。100、70、40 μm细胞筛购自于BD FalconTM。
1.2 HRTC和HPTEC的分离、培养、冻存
1.2.1 HRTC和HPTEC的分离 选取首都医科大学附属北京朝阳医院(以下简称“我院”)行肾癌根治性切除术和肾部分切除术后的手术标本,共8例,男5例,女3例。患者平均年龄(58±6)岁,每份组织切取量约10 g。切取肾透明细胞癌组织和远离肿瘤的正常肾脏皮质组织。切取组织均通过病理学评估。将组织浸入无菌IMEM细胞培养基中并置于冰上,30 min内转移至实验室开始细胞提取工作:①粉碎组织,组织盛放无菌细胞培养皿内,头戴式放大镜下显微操作。切除肿瘤组织内血管筋膜等结缔组织,保留黄色肿瘤组织。肾皮质组织剔除肾周纤维囊。无菌眼科剪刀将组织切割为直径约1 mm组织块。②充分清洗,收集粉碎组织于15 mL离心管中,预冷无菌HBSS冲洗3遍。1000 r/min(离心半径167 mm)离心10 min。③胶原酶消化,溶解100 mg Ⅱ型胶原酶(280 U/mg)于50 mL IMEM培养基中,0.22 μm无菌滤膜过滤后备用。分别将10 mg肿瘤组织和正常肾组织置入25 mL胶原酶溶液中,置于37℃恒温摇床中,连续震荡1~2 h。配合吸管间断吹打增加组织裂解效果。④原代细胞连续筛分,胶原酶消化后的组织液离心后弃上清。预冷无菌HBSS反复冲洗3遍。再次预冷无菌HBSS重新悬浮细胞后,依次用100、70、40 μm细胞筛过滤。
1.2.2 HRTC和HPTEC的培养、冻存 过滤后的细胞悬液离心弃上清液后生理盐水悬浮细胞。取20 μL细胞悬液加20 μL胎盘蓝混匀后记数。细胞计数后调整细胞接种浓度为5×104/cm2。细胞充分吹打混匀后接种于25 cm2培养瓶中。置孵育箱(37℃,5%CO2)培养。24 h后全量更换培养液,以后每3 d换液1次。细胞融合度80%左右时细胞传代培养或冻存。按照上述方法,HRTC细胞在接种后7~10 d达到传代和冻存条件。HPTEC细胞生长速度较快,则需要3~5 d。将第2~3代原代细胞进行冻存,以控制传代间的变异性。
1.3 原代细胞RNA-seq
Trizol法提取HPTEC和HRTC RNA。原代细胞的illumina RNA-seq工作交于北京博奥晶典生物技术有限公司完成,具体方法同文献[8]。
1.4 免疫细胞化学检测
HPTEC或HRTC接种于24孔板。细胞融合度达50%时开始后续实验。无菌磷酸缓冲盐溶液(PBS)清洗3遍,4%甲醛固定20 min,1%Triton X-100溶液破膜5 min。之后细胞用1%牛血清白蛋白、0.4%Triton X-100和4%叠氮钠混合物4℃封闭过夜。之后依次加入小鼠抗人一抗[pan-CK抗体(1∶100)α-SMA抗体(1∶100)、Vimentin抗体(1∶100)、PAX8抗体(1∶100)]及山羊抗鼠二抗(1∶100)室温下分别孵育2 h。PBS冲洗3遍后,按照S-P偶联免疫组织化学试剂盒说明书完成后续实验。PBS作为一抗阴性对照。中性树脂封片后显微镜下观察。
1.5 透射电鏡细胞超微检测
收集原代HPTEC和HRTC。3%戊二醛溶液固定,环氧树脂包埋,制备超薄切片,在JEM-2100HR型透射电子显微镜(首都医科大学中心实验室提供)下观察和鉴定HPTEC和HRTC超微细胞结构。
1.6 碱性磷酸酶染色
6孔细胞培养板内置入无菌细胞爬片,然后接种HPTEC。细胞融合度达50%时开始后续实验。碱性磷酸酶染色采用南京建成生物工程研究所碱性磷酸酶染色试剂盒。
1.7 裸鼠荷瘤模型建立
BALB/c(nu/nu)雌性裸鼠(由北京维通利华实验动物技术有限公司提供)饲养于我院医学研究中心暨国家重点学科呼吸病学实验SPF屏障系统动物室。鼠龄5~6周,体重18~20 g。实验动物生产和使用许可证号:SYXK(京)2020-0005。实验过程中严格遵循实验动物伦理相关规定。选取2~3代原代HRTC,细胞悬浮于100 μL预冷的PBS和基质胶(Matrigel)混悬溶液(PBS:Matrigel=1∶1)中。每次接种细胞量1.0×106个。接种于裸鼠左肋部建造肾癌裸鼠移植瘤模型。记录成瘤时间,计算成瘤百分率,测量肿瘤长径、短径、重量,并进行病理学检查。
2 结果
2.1 观察原代细胞生长观察
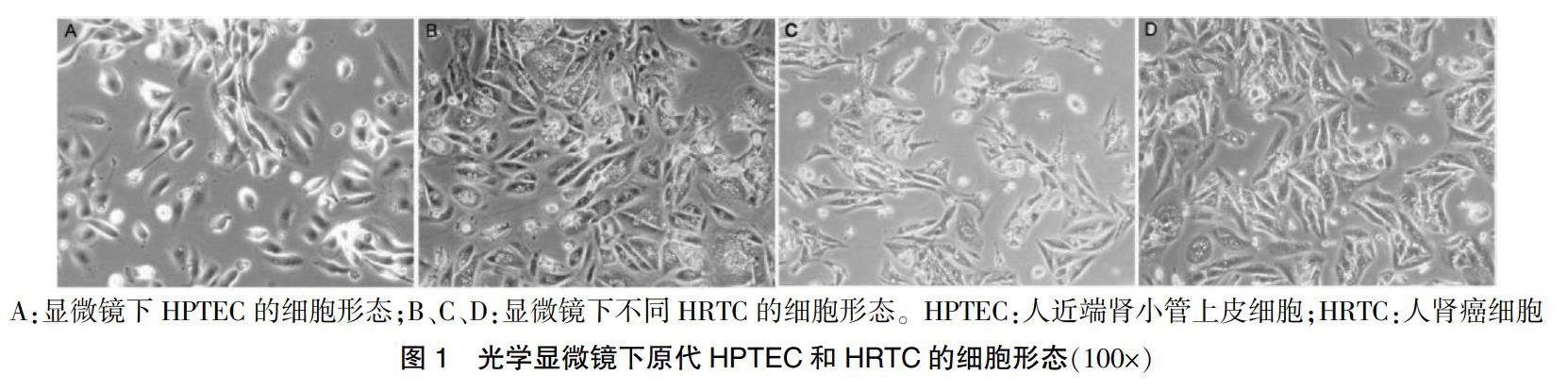
共计分离纯化得到3株原代HPTEC及8株原代透明细胞型HRTC。所有组织样本均完成病理确认。倒置显微镜观察培养瓶中的细胞生长。HPTEC形态呈典型的多边鹅卵石样,镜下透明度及折光性强,各细胞紧密相靠,互相衔接,可见融合成片及复层生长。HPTEC生长速度较快,3~4 d细胞融合度可达80%~90%。HRTC呈多样性,细胞形态大小不一。胞浆内可见大量的脂肪颗粒(图1)。生长速度相对较慢,传代冻存间隔时间为5~6 d。在本实验的条件下,HRTC传代5次以后生长速度明显变缓。HPTEC传代10次左右时生长速度未见明显变缓。连续倒置显微镜观察发现,培养过程中HRTC逐渐失去“透明细胞”表型,胞浆内富含的脂肪颗粒随传代次数逐渐减少。
2.2 细胞转录组测序结果
3株HPTEC的基因表达谱如下图所示(图2A,封三)。测序结果提示HPTEC和HRTC均表达近端肾小管上皮的标志物,均未见明显远端肾小管上皮相关标志物表达(图2B,封三)。分析HRTC与HPTEC的基因表达谱,两种细胞差异基因的表达与文献报道的肾癌和正常肾组织的差异基因的表达相符合(图2C,封三)[9-11]。如在HRTC内高表达的基因有:CA9、VEGFA、APLN、ALDH1A1、C4A、C4B、ENPP3、NDUFA4L2等。在HRTC内低表达的基因有:VHL、PBRM1、MAL、SLIT2、GATA3、TFAP2B、TFCP2L1等(图2C,封三)。
2.3 免疫细胞化学检测与碱性磷酸酶检测
所培养的HPTEC表达Pan-CK和PAX8蛋白,而没有α-SMA和Vimentin的蛋白表达(图3,封三)。碱性磷酸酶染色(偶氮偶联法)中可见HPTEC和HRTC胞浆内发现大量棕红色颗粒形成。提示原代细胞碱性磷酸酶含量丰富(图4A~B,封三)。
2.4 透射电镜细胞超微检测
收集第2代HPTEC和HRTC送检透射电镜。透射电子显微镜下原代HPTEC可见典型的顶端微绒毛形成,胞浆内可见大量线粒体形成(图4C~D,封三)[12-13]。HRTC电镜下胞质内充斥大量的脂滴,呈圆形卵圆形,没有界膜,均电子密度。有少量线粒体、内质网和核糖体及其他细胞器(图4E,封三)[14-15]。
2.5 HRTC裸鼠移植瘤模型建立
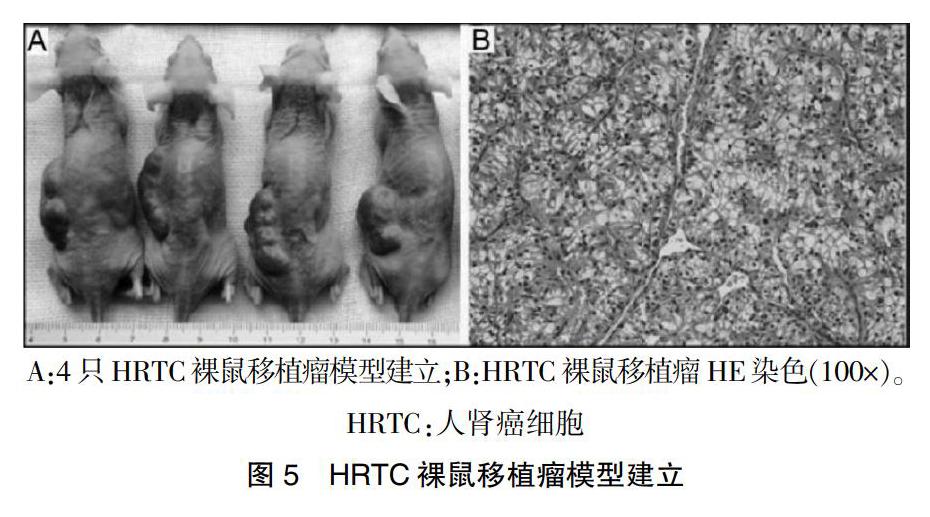
使用分离纯化得到的4株原代HRTC进行裸鼠荷瘤模型建立。共接种裸鼠20只,荷瘤成功19只。皮下移植瘤模型的成瘤时间为5~7 d。皮下接种28 d后移植瘤平均长径为(23.58±2.85)mm,平均短径为(11.18±1.89)mm,平均体积为(1988.13±359.76)mm3,平均瘤重为(1.45±0.27)g(图4A)。移植瘤HE染色显示,瘤体由大量透明细胞组成,癌细胞体积大,呈圆形或多边形,轮廓清楚,具有清晰的胞膜,丰富透明的胞浆。组织间质内可见大量微血管结构。经两名病理医生确认符合肾透明细胞癌的组织特征(图4B)。
3 讨论
由于精准医学发展的需要,肿瘤患者的个体化治疗被越来越多的患者所接受[16]。商业化的肾癌细胞系虽可用作临床前期研究的工具细胞,但由于遗传背景与原发肾癌的明显差异,使研究结果缺乏直接的临床指导意义。因此把人源性原代细胞作为工具细胞深入研究,更加具有临床指导意义[1,17-18]。建立一种实用的方法从临床组织标本中分离原代肿瘤细胞和与之相匹配的原代正常细胞是很有必要的。
目前,永生化细胞系通常由病毒转导产生。虽然永生化细胞系易于体外培养,但经過长期培养和多次传代,永生化HPTEC细胞株将逐渐失去上皮表型和特性。又由于肿瘤细胞遗传学的不稳定性,RCC细胞系遗传学背景与临床RCC组织存在较大差异。相比之下,原代细胞更能代表人体真实生理环境和遗传学背景。目前人原代HPTEC和HRTC培养物建立的难点是如何建立纯度高、数量足、重复性好的原代HPTEC和HRTC培养物。常用的原代细胞分离培养方法可分为两类:组织块贴壁法和胶原酶消化法。组织块贴壁法培养原代HPTEC过程中常见的问题是成纤维细胞和远端肾单位的污染[19-20]。另有研究试图通过使用免疫磁珠技术或Percoll溶液密度梯度离心来促进HPTEC的富集,但细胞提纯流程繁琐并且细胞产量低和活力低[21-22]。本研究证实机械分解,胶原酶消化和细胞连续筛分的原代细胞分离方法操作简单快捷。不仅增加了原代培养时细胞的获得量,同时也避免了繁琐的分离纯化过程对细胞造成损伤,更大限度地保护了原代细胞的活性。本实验的另一关键在于如何精确获取细胞组织。显微操作应用于分离目标组织,可以更大限度地去除杂质组织,有利于后期细胞纯化。本实验的不足在于采用机械分离纯化的方法,无法达到流式细胞分选的精度。但后期的RNA-seq结果却证实了该方法所得细胞的纯度较高。可能是因为分离纯化后数目较多的目标细胞成为“优势细胞”,在后续的培养过程中杂质细胞失去了“细胞群体效应”而最终消亡。
Valente等[23]建立一种与本研究相类似的分离提纯原代细胞的方法。然而,另一个研究采用同样的方法提纯HPTEC和HRTC[24],却得出令人困惑的结果。结果提示在基因测序过程中发现此法提纯的原代肿瘤细胞中存在大量的正常细胞。为解决这一矛盾问题,本研究试图通过严格优化原代细胞提纯步骤,首次通过RNA-seq的方法验证原代细胞遗传学背景。证实了机械分解,胶原酶消化和细胞连续筛分是一种快速便捷的原代细胞提纯方法。所分离HPTEC和HRTC细胞纯度高,符合文献所报道的两种细胞的遗传学背景[9-11]。进一步连续倒置显微镜观察还发现,随传代次数增多,HRTC逐渐失去“透明细胞”表型,胞浆内富含的脂肪颗粒逐渐减少。具体细胞表型变化的分子机制还待后续进一步深入研究。可能与体外培养环境与体内差异有关。因此,本研究使用第2~3代细胞进行后续研究,以控制传代间的变异性。
为确保实验的可重复性,本实验对上述分离纯化方法做了如下3点优化:①严格剔除肿瘤组织内坏死和血管等纤维结缔组织,头戴放大镜下显微操作;②胶原酶充分消化裂解组织,配合吸管间断吹打增加组织裂解效果;③实验需选取1~3代的HRTC作为工具细胞。综上,本研究验证了一种快速有效的原代HPTEC和HRTC分离提纯方法,使为肾细胞癌个体化精准治疗提供良好的细胞模型成为可能。
[参考文献]
[1] Atkins MB,Tannir NM. Current and emerging therapies for first-line treatment of metastatic clear cell renal cell carcinoma [J]. Cancer Treat Rev,2018,70:127-137.
[2] Brugarolas J. Molecular genetics of clear-cell renal cell carcinoma [J]. J Clin Oncol,2014,32(18):1968-1976.
[3] Beroukhim R,Brunet JP,Di Napoli A,et al. Patterns of gene expression and copy-number alterations in von-hippel lindau disease-associated and sporadic clear cell carcinoma of the kidney [J]. Cancer Res,2009,69(11):4674-4681.
[4] Lee J,Kotliarova S,Kotliarov Y,et al. Tumor stem cells derived from glioblastomas cultured in bFGF and EGF more closely mirror the phenotype and genotype of primary tumors than do serum-cultured cell lines [J]. Cancer Cell,2006,9(5):391-403.
[5] van Staveren WC,Solís DY,Hébrant A,et al. Human cancer cell lines:Experimental models for cancer cells in situ? For cancer stem cells? [J]. Biochim Biophys Acta,2009,1795(2):92-103.
[6] Pollard SM,Yoshikawa K,Clarke ID,et al. Glioma stem cell lines expanded in adherent culture have tumor-specific phenotypes and are suitable for chemical and genetic screens [J]. Cell Stem Cell,2009,4(6):568-580.
[7] van de Wetering M,Francies HE,Francis JM,et al. Prospective derivation of a living organoid biobank of colorectal cancer patients [J]. Cell,2015,161(4):933-945.
[8] Li XN,Wang ZJ,Ye CX,et al. Circular RNA circVAPA is up-regulated and exerts oncogenic properties by sponging miR-101 in colorectal cancer [J]. Biomed Pharmacother,2019(112):108611.
[9] Wang M,Li X,Zhang J,et al. AHNAK2 is a Novel Prognostic Marker and Oncogenic Protein for Clear Cell Renal Cell Carcinoma [J]. Theranostics,2017,7(5):1100-1113.
[10] Xu S,Zhang H,Chong Y,et al. YAP Promotes VEGFA Expression and Tumor Angiogenesis Though Gli2 in Human Renal Cell Carcinoma [J]. Arch Med Res,2019,50(4):225-233.
[11] Tolkach Y,Ellinger J,Kremer A,et al. Apelin and apelin receptor expression in renal cell carcinoma [J]. Br J Cancer,2019,120(6):633-639.
[12] 方開云,石明隽,肖瑛,等.原代肾小管上皮细胞的培养和鉴定[J].贵阳医学院学报,2008,33(2):136-138.
[13] 余德芊,王富英,马元芬,等.微分离方法原代培养大鼠肾近曲小管上皮细胞[J].遵义医学院学报,2009,32(5):448-450.
[14] 邢传平,钱震,李宁.肾细胞癌的组织病理和超微结构观察[J].电子显微学报,1997(5):62-66.
[15] 许红民,李维华.肾细胞癌的超微结构分型[J].中国人民解放军军医进修学院学报,1990(3):257-259,284.
[16] Abubakar MB,Gan SH. Molecular Targets in Advanced Therapeutics of Cancers:The Role of Pharmacogenetics [J]. Oncology,2016,91(1):3-12.
[17] Okada S,Vaeteewoottacharn K,Kariya R. Application of Highly Immunocompromised Mice for the Establishment of Patient-Derived Xenograft (PDX) Models [J]. Cells,2019,8(8):889.
[18] Meehan TF,Conte N,Goldstein T,et al. PDX-MI:Minimal Information for Patient-Derived Tumor Xenograft Models [J]. Cancer Res,2017,77(21):e62-e66.
[19] 王梨名,陳佳,陈客宏,等.小鼠近端肾小管上皮细胞原代培养及鉴定[J].生理学报,2018,70(4):406-412.
[20] 王裕,杨霞,高继萍,等.小鼠肾小管上皮细胞的培养和鉴定[J].山西医科大学学报,2014,45(11):1106-1109, 1119.
[21] Vesey DA,Qi W,Chen X,et al. Isolation and primary culture of human proximal tubule cells [J]. Methods Mol Biol,2009,466:19-24.
[22] Qi W,Johnson DW,Vesey DA,et al. Isolation,propagation and characterization of primary tubule cell culture from human kidney [J]. Nephrology(Carlton),2007,12(2):155-159.
[22] Valente MJ,Henrique R,Costa VL,et al. A rapid and simple procedure for the establishment of human normal and cancer renal primary cell cultures from surgical specimens [J]. PLoS One,2011,6(5):e19337.
[24] Lobo NC,Gedye C,Apostoli AJ,et al. Efficient generation of patient-matched malignant and normal primary cell cultures from clear cell renal cell carcinoma patients:clinically relevant models for research and personalized medicine [J]. BMC Cancer,2016,16:485.
(收稿日期:2020-06-01)
