犬细小病毒2a型致弱疫苗株的培育与免疫效力试验
2020-11-06甘军纪田晓彦吕海峰刘秀梵
甘军纪,田晓彦,吕海峰,刘秀梵
(扬州大学 兽医学院 江苏省动物重要疫病与人兽共患病防控协同创新中心,江苏 扬州 225009)
犬细小病毒(CPV)是幼犬急性出血性肠炎的主要病原,感染犬可表现严重的临床症状,如白细胞减少症、发热、厌食、出血性腹泻、脱水,甚至死亡[1]。CPV(CPV-2)于1978年首次出现,1979年CPV-2变异株开始出现,称为CPV-2a。1984年在美国出现CPV-2b变异株,2000年在意大利又出现CPV-2c变异株[2]。目前,这3种不同的抗原变异株CPV-2a、CPV-2b 和 CPV-2c,不同程度地分布于我国及世界各地[3-10]。
控制CPV病的主要方法是疫苗接种。目前,大多数CPV商品疫苗用CPV-2毒株制备。虽然有研究表明CPV-2疫苗对CPV变异株的保护依然有效[11-12],但病毒的持续变异使人们对CPV-2疫苗的效力提出质疑[6,13-14]。在许多国家,CPV依然是幼犬发病和死亡的重要原因[5,15]。为了进一步控制CPV变异株的流行,已有CPV-2b毒株(SAH株,CPV-39株)制备的减毒活疫苗(ML)在国外获得注册并商品应用[16-19],这些疫苗株是通过在细胞上连续传代获得[13]。本试验利用国内分离的CPV-2a变异株,通过在FK81细胞上连续传代的方式获得致弱毒株,并评价其毒力和免疫效力,为CPV新型致弱疫苗研制奠定基础。
1 材料与方法
1.1 细胞与病毒CPV-2、CPV-2a、CPV-2b野毒株,由本实验室分离鉴定[8]。毒株信息见表1。FK81细胞由本实验室保存,用于CPV分离和培养,细胞生长液和维持液为分别含10%,1% FBS的DMEM培养基。
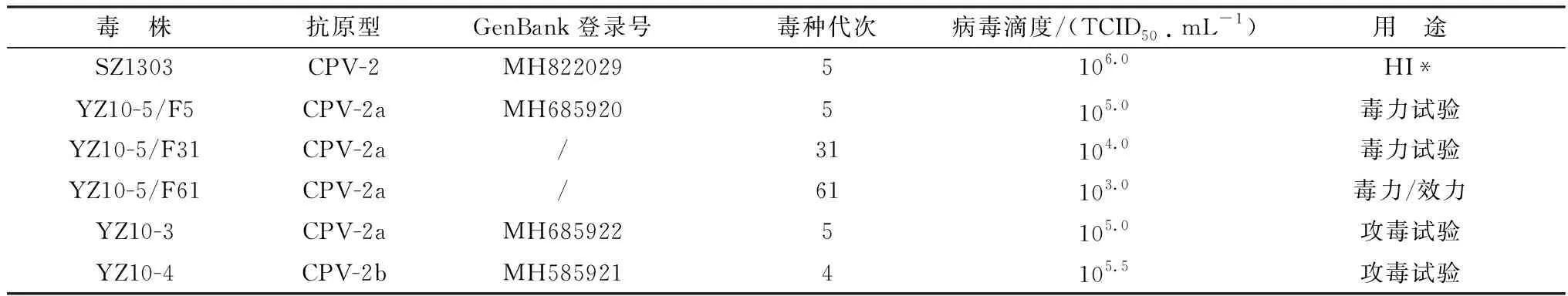
表1 本试验使用的CPV毒株
1.2 实验动物10周龄低CPV 母源抗体比格犬(HI 效价<1∶4)11只,由扬州大学实验动物中心基地提供(种犬未经疫苗免疫),用于CPV致病性试验。15~16周龄高母源抗体比格犬(种犬使用CPV-2商品疫苗免疫)9只,购自扬州四方实验动物科技有限公司,用于致弱毒株的免疫效力试验。实验犬饲养于扬州大学比较医学中心隔离动物房,饲喂商品饲料,自由饮水,试验前适应1周。试验前1 d,用CPV抗原快速检测试剂盒(BioNote,Inc.,Republic of Korea)检测证明无CPV感染,HI试验检测血清CPV-2母源抗体滴度。
1.3 细胞传代致弱毒株的培育CPV YZ10-5株在FK81细胞上连续传代。传代过程中,当细胞出现明显细胞病变(CPE)后,-25~37℃冻融1次,取培养物悬液250 μL,接种FK81细胞单层(25 cm2方瓶,Corning),37℃吸附1 h,加5 mL维持液继续培养3~5 d,出现明显CPE后,再进行下一代传代。毒种在FK81细胞上连续传80代,各代次传代毒种-70℃保存备用。传代毒种经纯净性检验,无细菌、支原体和外源病毒污染。
1.4 CPV传代毒种VP2全序列分析FK81细胞连续传代的不同代次病毒培养液,用DNA提取试剂盒(EasyPure Viral DNA/RNA Kit,北京全式金生物技术有限公司)抽提DNA。根据GenBank CPV 参考序列,设计覆盖VP2全序列的3组引物,进行PCR扩增,引物序列见表2。PCR扩增产物用1%琼脂糖凝胶电泳,切胶,送南京金斯瑞生物技术有限公司测序。

表2 CPV VP2基因扩增引物
1.5 CPV毒种毒力试验对CPV-2a YZ10-5株在FK81细胞上连续传代的5代(YZ10-5/F5)、31代(YZ10-5/F31)、61代(YZ10-5/F61)病毒进行毒力比较试验,毒力试验在低母源抗体(MDA)犬上进行。试验分4组,其中YZ10-5/F5、YZ10-5/F31、YZ10-5/F61接种组各3只,对照组2只。YZ10-5/F5接种组,每只犬接种2 mL(滴鼻、口服各1 mL)。YZ10-5/F31、YZ10-5/F61接种组,每只犬接种10 mL(滴鼻1 mL、口服9 mL)。各病毒滴度见表1。对照组,每只犬接种细胞维持液10 mL(滴鼻1 mL、口服9 mL)。病毒接种后每天观察试验犬的临床症状,监测直肠温度,检测粪便排毒,白细胞分类计数。
1.6 临床评分指标临床评分参照文献[20]的评分标准进行,稍有改变。直肠体温(≤37.3℃=1,37.4~39.5℃=0,39.6~39.9℃=1,40.0~40.5℃=2,≥40.6℃=3);腹泻(粪便带黏液=1,水样粪=2,血粪=3);状态(厌食=1,呕吐=1,抑郁=1,脱水=1)。
1.7 白细胞(WBC)分类计数按试验设计的时间点采集EDTA抗凝血0.5 mL,用全自动血细胞计数分析仪(迈瑞,BC-2800 vet)进行血细胞分类计数。比较病毒接种前后的WBC、淋巴细胞(Ly)数量变化,当与攻毒前基数比较,下降达到或超过50%时,视为幼犬患WBC或Ly减少症[21]。
1.8 免疫效力试验
1.8.1试验分组 比格犬9只,分2组,其中免疫组6只,对照组3只。试验前1 d采血,分离血清,HI试验检测犬母源抗体水平,采抗凝血0.5 mL进行血细胞分类计数。
1.8.2免疫与攻毒 选取CPV-2a YZ10-5/F61进行免疫效力试验。首免,免疫组皮下注射2 mL/只。对照组皮下注射1% FCS-DMEM培养液,2 mL/只。隔3周进行二免,接种剂量、途径同首免,二免后3 周,所有实验犬用CPV2a/2b(YZ10-3+YZ10-4株各1.5 mL,混合)野毒株攻毒, 3 mL/只,其中滴鼻1 mL(0.5 mL/鼻孔),口服2 mL。各病毒滴度见表1。首免后、攻毒后14 d内每天观察临床症状,按规定时间测定体温,进行血细胞分类计数。实验犬临床评分,按1.6方法进行。
1.8.3抗体应答 采集免疫前犬血清,免疫后、攻毒后每周采集血清,-20℃保存。HI试验检测血清抗体效价[14]。血清用PBS 连续2倍稀释。试验在4℃ 96孔V型板上进行,使用8 HA单位CPV抗原,1%猪红细胞。HI滴度以完全抑制病毒血凝性的血清最高稀释度表示。
1.8.4排毒检测 免疫、攻毒前后,采集粪便样品,分别用CPV抗原快速检测试剂盒(BioNote Inc.,Republic of Korea)、HA试验检测粪便样品中CPV排毒情况。CPV抗原快速检测试剂盒(胶体金法)操作按说明书方法进行。HA试验参照文献[19]的方法,稍有改变:粪便样品用PBS稀释(1∶10)制备悬液,4℃,4 000 r/min离心10 min,取上清在V型血凝板上1∶2连续稀释(50 μL体系),加入等量1%猪红细胞,4℃ 4 h后观察结果。
1.8.5WBC分类计数 免疫、攻毒前后,采集EDTA抗凝血进行WBC分离计数,按1.7方法进行。
2 结果
2.1 传代毒种VP2氨基酸全序列比较结果CPV YZ10-5株在FK81细胞上连续传代后,VP2氨基酸全序列(584 aa)分析表明,其在20代开始300位氨基酸出现G→V突变,并稳定遗传至80代(图1),VP2序列其他位置没有发生氨基酸变异。

图1 YZ10-5株连续传代300位氨基酸突变
2.2 不同代次CPV毒株的毒力
2.2.1CPV低代次毒力 非免疫比格犬,口鼻接种CPV YZ 10-5/F5(5代病毒),接种后4 d(感染后天数,DPI)开始出现体温升高(≥39.6℃),并呈典型临床症状(厌食、抑郁、呕吐、腹泻),粪便大量排毒,死亡前表现WBC和Ly减少症,8 DPI全部死亡(3/3),结果由表3,4可见,YZ 10-5/F5毒株是高毒力毒株。

表3 CPV YZ10-5/F5对幼犬的毒力
2.2.2CPV中等代次毒力 非免疫比格犬,口鼻接种CPV YZ 10-5/F31(31代病毒),观察14 d,有个别犬(1/3)采食量下降、体温稍有升高外(39.7℃),无其他临床症状,WBC/Ly正常(表4)。结果表明,YZ 10-5/F31毒力已显著下降。
2.2.3CPV高代次毒力 非免疫比格犬,口鼻接种CPV YZ 10-5/F61(61代病毒),观察14 d,无任何临床症状,体温、WBC/Ly正常,接种犬粪便的胶体金检测和HA试验均未检测到CPV排毒(表4)。结果表明,高代次CPV YZ 10-5/F61对幼犬无致病性。

表4 细胞传代不同代次的CPV YZ10-5毒种对幼犬的毒力
2.3 CPV传代致弱毒种的免疫效力
2.3.1攻毒临床保护 YZ10-5/F61毒种2次免疫后,用CPV/2a+2b攻毒,攻毒后14 d内,所有免疫犬没有明显临床症状,但有2只犬(2/6)7~9 DPC(攻毒后天数,DPC)出现体温稍有升高(39.6~39.8℃)。未免疫对照犬4 DPC开始全部(3/3)出现明显临床症状,主要表现厌食、腹泻、呕吐,并发生Ly减少症(该指标未计入临床评分),CS399号犬8,9 DPC高热(40.5~41.0℃)。未免疫对照犬10 DPC 后逐渐康复,无犬死亡。攻毒后临床评分结果见表5。
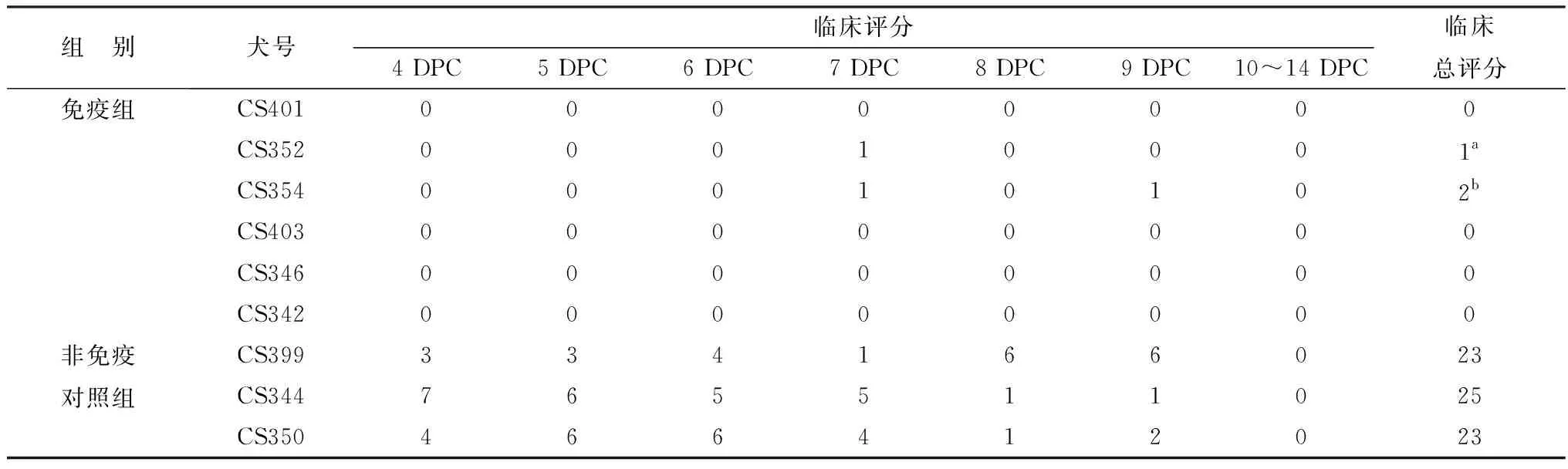
表5 免疫攻毒试验犬临床症状评分
2.3.2抗体应答 在高母源抗体幼犬(HI平均值8.1 log2),YZ10-5/F61毒种2次免疫,血清抗体HI效价均未见明显提高,攻毒后2 周抗体显著升高(HI平均值10.9 log2)(图2)。
2.3.3排毒检测 HA试验结果表明,CPV YZ10-5/F61免疫组首免后以及攻毒后14 d内,粪便均无排毒。非免疫组攻毒后5~7 d粪便大量排毒,HA效价最高可达12 log2,部分犬排毒可延续到14 d(表6)。IC检测结果与HA试验基本相符,5 DPC粪便大量排毒,免疫组攻毒后粪便排毒阴性,非免疫组强阳性(图3)。

图3 5 DPC粪样胶体金检测结果

表6 CPV疫苗免疫后、攻毒后粪便排毒检测
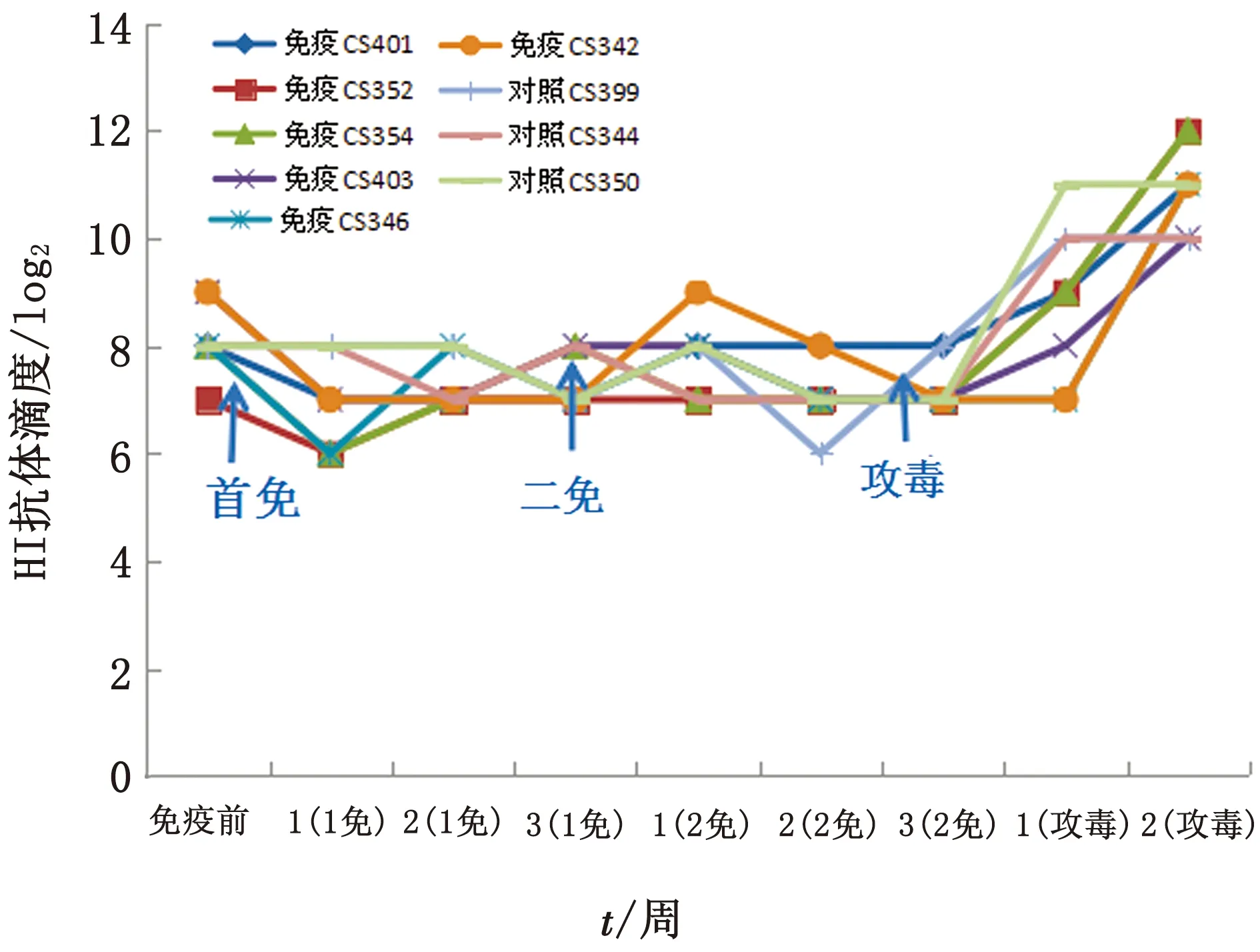
图2 CPV YZ10-5/F61免疫攻毒HI抗体应答
2.3.4WBC分类计数 免疫、非免疫犬攻毒前后的WBC、Ly分类计数结果见表7,免疫组攻毒后WBC或Ly数在正常范围,而非免疫对照组3~10 DPC出现WBC或Ly减少症(与0 DPC基数比较,下降≥50%),主要出现在3~7 DPC。
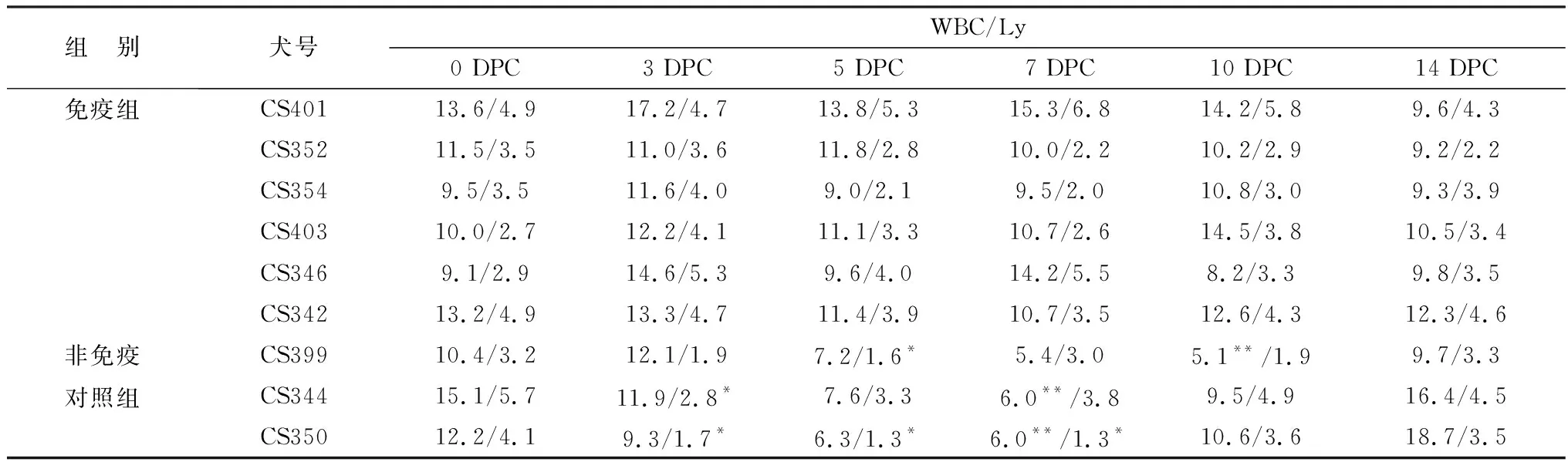
表7 攻毒后WBC分类计数结果
3 讨论
尽管已有安全有效的CPV-2疫苗,但在许多国家CPV仍然是引起幼犬严重发病和死亡的重要原因[15]。由于临床上CPV-2已被CPV-2a、2b或2c变异株取代,目前的CPV-2疫苗可能无法保护幼犬免受变异病毒的感染[14]。有研究表明,CPV-2母源抗体HI滴度≥1∶160的幼犬依然不能阻止CPV-2a/2b变异株的感染[22]。PRATELLI等[13]认为,接种原始的CPV-2毒株疫苗对变异株的“真实”免疫力相对较低。在临床上已发生由变异株(CPV-2a/2b/2c)引起的CPV-2疫苗免疫失败[5,7,23-24],因此,开发使用在犬群中流行的变异株制备的新型疫苗很有必要。
目前市售的CPV致弱活疫苗毒株都是通过犬或猫细胞系连续传代的方法获得的,毒株传代代次在37~115代不等[25-26]。在不同的传代条件和传代代次,其致弱病毒株的基因序列改变具有多样性[27]。本试验选用的YZ10-5毒株,在FK81细胞连续传20代开始出现VP2G300V突变,传至80代依然稳定。已知CPV VP2中关键氨基酸替换具有重要的生物学意义,VP2/300位氨基酸是决定宿主范围和抗原性的关键位点[28-29],根据毒力试验结果,推测此位点的改变可能与毒株致弱相关。
CPV免疫的一个主要问题是幼犬体内持续存在高水平的母源抗体,会严重干扰疫苗诱导免疫力的建立[1]。一般认为,抗体HI滴度≥1∶20就会干扰疫苗接种后的主动免疫应答[27]。为了克服母源抗体的影响,MARTELLA等[26]提出使用高滴度(107TCID50/剂)CPV-2疫苗口服或鼻内接种方法。除了母源抗体以外,其他因素也可能影响CPV疫苗接种后免疫应答水平,如疫苗的病毒效价、病毒致弱的程度(即连续传代代次)、疫苗株的抗原性以及接种途径等[30]。有研究表明,注射104.5TCID50致弱CPV-2b疫苗(29/97株,40代毒)被证明在克服母源抗体干扰方面比高滴度的CPV-2疫苗有效[14,21],同等剂量(29/97株,68代毒)鼻内接种母源抗体HI滴度≤1∶80幼犬,可诱导主动免疫应答[27]。本试验使用的幼犬具有高水平的母源抗体,HI平均滴度达1∶256(8 log2),2次接种低剂量的(2×103TCID50/剂)YZ10-5/F61后,虽然没有检测到明显的HI抗体提高,但对CPV-2a和2b变异株强毒攻击产生明显的临床保护作用,并完全抑制排毒,说明该致弱毒株能克服CPV-2高母源抗体干扰,诱导良好的免疫应答。而产生HI抗体低应答的原因可能与接种剂量较低或毒种代次较高有关,尚待进一步研究。
本试验初步研究表明,CPV-2a传代致弱毒株(YZ10-5/F61)有望用于开发CPV防控的新型疫苗。
