核壳结构镍肼复合物的红外光谱研究
2020-11-06石昂昂于洪霞顾敏芬杨忠林
石昂昂,于洪霞,顾敏芬*,杨忠林,杨 雪
1. 南京师范大学分析测试中心,化学与材料科学学院,江苏 南京 2100462. 南京农业大学资源与环境科学学院,江苏 南京 2100953. 中石化南京化工研究院有限公司,江苏 南京 210048
引 言
近年来,核壳结构纳米复合材料成为了纳米材料领域的研究热点。通过在纳米粒子表面使用性能稳定的外壳进行包覆,可以产生许多单一纳米粒子无法得到的新性能,进一步拓宽纳米材料的应用领域[1-4]。间苯二酚-甲醛(RF)树脂是间苯二酚和甲醛在碱性催化条件下缩聚反应的产物,常被用作核壳结构纳米复合材料的壳层材料,将制备的RF核壳结构复合材料在高温煅烧后可形成碳基复合材料,在催化、电池、超级电容器等领域有广泛应用。Yang把含有Ni源的RF利用聚合过程原位生长在SiO2核的外层,通过热处理过程制备了SiO2@C/Ni复合材料,在催化还原4-NP对硝基苯酚的过程中表现了较高的催化活性,并且在5个循环周期后没有明显失活[5]。Yu等通过以镍肼(NHC) 纳米棒为核,外层包覆RF,为了防止团聚再在外层包覆了SiO2制备了NHC@RF@SiO2复合材料,在惰性气氛下高温煅烧后经NaOH和HCl溶液刻蚀后得到多孔管状碳纳米棒,证明当用作超级电容器的活性电极材料时,所制备的管状碳纳米棒显示出优于商业石墨和碳纳米管的电化学性能[6]。SiO2因其在水溶液中的高度稳定性以及表面易于改性的特点,常被用作壳层对纳米粒子进行包裹,使复合材料具有良好的化学稳定性、磁性核稳定性、亲水性和生物相容性。例如,有研究利用一种新方法制备Au@SiO2,后在其表面涂覆一层聚甲基丙烯酸甲酯(PMMA),制得Au@SiO2@PMMA复合材料,得到物理稳定性较好且SERS信号重复性好的纳米复合颗粒。磁性纳米粒子具有稳定性差、易团聚、易氧化等缺点,SiO2的包裹有效阻止粒子团聚,增强磁性粒子的稳定性。Shao等通过原位生长法合成了具有花状形貌、均匀介孔的Fe3O4@SiO2@NiAl-LDH微球,在药物传递和生物传感器等多种生物医学领域具有潜在的应用[7]。
本工作采用反胶束法,以氯化镍和水合肼为主要原料合成了NHC,并以NHC为核心,对其包裹RF和SiO2,合成了核壳结构镍肼复合物(NHC@RF,NHC@SiO2,NHC@RF@SiO2)。通过透射电子显微镜(TEM)对所得材料进行形貌表征; 利用X射线衍射仪(XRD)对所得材料进行物相分析; 采用傅里叶变换红外光谱透射法(TR-FTIR)、衰减全反射法(ATR-FTIR)和漫反射法(DRS-FTIR)对其进行红外测试,分析所得材料的组分信息,比较了三种红外测试方法在对核壳结构纳米材料进行检测的特点,研究了RF及SiO2包覆对NHC红外特征峰的影响。
1 实验部分
1.1 试剂与仪器
主要化学试剂: 37%甲醛溶液、氯化镍、二乙胺、氢氧化钠、37.5%盐酸、环己烷和异丙醇购于Fisher公司; 聚氧乙烯(20)十六烷基醚(Brij58)和间苯二酚由Sigma-Aldrich贸易有限公司提供; 水合肼(N2H4·H2O 100%,N2H464%)和正硅酸四乙酯(TEOS)购于Acros化学试剂有限公司。所有试剂均为分析纯,无需进一步提纯; 实验用水为去离子水。
1.2 NHC的制备
将15 mL环己烷和8.5 g Brij58在50 ℃下持续搅拌0.5 h,充分溶解。再逐滴加入1.7 mL 0.8 mol·L-1的氯化镍水溶液,在50 ℃下持续搅拌2 h。将0.45 mL水合肼加入到混合溶液中,在50 ℃下持续搅拌3 h,溶液颜色由绿色透明瞬间变为蓝色透明,随后又逐渐变为浅紫色不透明。将所得溶液在8 000 r·min-1的转速下离心3 min,异丙醇洗涤,真空干燥,即可得NHC样品。
1.3 NHC复合物的制备
首先配制RF溶液,将0.5 g间苯二酚和0.7 mL甲醛溶液依次加到2 mL异丙醇中,充分搅拌。再将1 mL二乙胺和2 mL RF溶液依次加入到NHC混合溶液中,在50 ℃下持续搅拌2 h,溶液颜色由浅紫色逐渐变为深棕色。离心,异丙醇洗涤,真空干燥,得NHC@RF样品。将1 mL二乙胺和3 mL TEOS(正硅酸四乙酯)依次加入到NHC混合溶液中,即可得NHC@SiO2样品。将1 mL二乙胺和3 mL TEOS依次加入到NHC@RF混合溶液中,即可得NHC@RF@SiO2样品。
2 结果与讨论
利用TEM(JEOL JEM-2100F,日本电子株式会社)在200 kV条件下对所得材料进行形貌表征; 利用XRD(D/max 2500/PC,日本理学株式会社)分析所得材料的物相组成,扫描条件是: 光源为Kα射线(λ=1.540 6 Å),铜靶电压为40 kV,电流为100 mA,扫描范围为10°~70°,扫描速度为15°·min-1; 利用TR-FTIR,ATR-FTIR和DRS-FTIR(VERTEX 70,德国布鲁克公司)分别对所得材料进行红外光谱测试,扫描次数为32,分辨率为4 cm-1,光谱范围为4 000~400 cm-1。
2.1 形貌表征
由图1(a,b)可知NHC为纳米棒状结构,平均直径为30 nm,长度为150 nm。合成过程中在表面活性剂Brij 58与环己烷形成的反胶束体系中加入NiCl2后,NiCl2会均匀分布在胶束的亲水极,当引入水合肼时就会与其配位形成一维纳米棒状结构。如图1(c,d)所示为NHC@RF,NHC纳米棒外包裹的RF树脂的平均厚度为8 nm。在包覆RF的过程中二乙胺作催化剂,不与NHC反应,有助于在RF包裹期间保持样品纳米棒结构。核心处NHC纳米棒部分呈颗粒状,这是样品在TEM成像期间在电子束辐射下NHC分解后重结晶形成的。图1(e,f)所示为NHC@SiO2,在NHC纳米棒外包裹的SiO2厚度约12 nm。图1(g,h)所示为NHC@RF@SiO2的微观形貌。

图1 样品的TEM图像(a,b): NHC; (c,d): NHC@RF; (e,f): NHC@SiO2; (g,h): NHC@RF@SiO2Fig.1 TEM images of samples(a,b): NHC; (c,d): NHC@RF; (e,f): NHC@SiO2; (g,h): NHC@RF@SiO2
2.2 物相分析
图2(a)为NHC及其复合物的XRD图谱。如图2(a)中a所示,△标记的衍射峰为Ni(N2H4)2Cl2(JCDPS no.28-065),●标记的衍射峰与Ni(NH3)6Cl2(JCDPS no.76-1842)吻合。由于在制备过程中,NiCl2与N2H4反应也会生成Ni(N2H4)3Cl2,但是Ni(N2H4)3Cl2不稳定,会逐渐分解为Ni(N2H4)2Cl2,在50 ℃时Ni(N2H4)2Cl2部分又会缓慢转换为Ni(NH3)6Cl2。图2(a)中b为NHC@RF复合物的XRD图谱。因为外层包裹的RF树脂为聚合物材料,属于非晶态,没有明显的XRD衍射峰,所以NHC@RF总体显示为与NHC相似的衍射峰。图2(a)中c和d显示NHC@SiO2及NHC@RF@SiO2样品在24°附近有一宽峰,是SiO2的特征峰。

图2 样品的XRD及TR-FTIR图谱a: NHC; b: NHC@RF; c: NHC@SiO2; d: NHC@RF@SiO2Fig.2 XRD and TR-FTIR pattern of the samplesa: NHC; b: NHC@RF; c: NHC@SiO2; d: NHC@RF@SiO2
2.3 红外光谱分析
2.3.1 NHC及其复合物的TR-FTIR分析
图2(b)为NHC及其复合物的TR-FTIR谱图,NHC的主要特征峰归属如下: 在3 289和3 231 cm-1处附近的峰归属于Ni(N2H4)2Cl2中NH2和Ni(NH3)6Cl2中NH3的N—H伸缩振动,1 607和1 568 cm-1处的尖锐吸收峰归属于N—H弯曲振动; 1 340和1 315 cm-1处的峰归属于配位体中N—N的伸缩振动,1 202和1 173 cm-1处的峰归属于N—N的弯曲振动; 980 cm-1处的峰归属于NH2摇摆振动,650和613 cm-1处的峰对应于NH3的摇摆振动[8-9]。
由图2(b)中b可以看出,NHC在包裹RF前后,其红外特征吸收峰无明显位移。除了NHC的特征峰,在1 609,1 460,1 000~1 300和976 cm-1处出现吸收峰,分别为RF树脂中亚甲基—CH2—以及C—O—C基团的基团振动[11]。NHC@SiO2样品在图2(b)的c曲线中1 082 cm-1处有宽而强的吸收峰是Si—O—Si的反对称伸缩振动峰,961 cm-1处的峰是Si—OH的弯曲振动峰,799和461 cm-1处的峰是Si—O键的对称伸缩振动峰[10]。d曲线NHC@RF@SiO2的TR-FTIR谱图上可以同时看到NHC,RF及SiO2的特征峰。RF树脂的包覆对油相NHC的红外特征峰没有明显的影响,而包覆SiO2后在3 280和3 228 cm-1处的N—H伸缩振动吸收峰有明显的红移,分别红移至3 220和3 154 cm-1,在1 607和1 568 cm-1处N—H的弯曲振动峰发生了蓝移,为1 630和1 597 cm-1。1 173及650 cm-1的特征峰几乎消失,说明Si—OH与N—H有相互作用。
2.3.2 同种样品三种红外方法的比较
TR-FTIR是最常规的红外检测方法,检测的是穿透样品的红外光信息,ATR-FTIR需要样品与高折射率的晶体紧密接触,入射光在晶体内部进行全反射的同时,部分光会穿透样品表面一定深度,测定衰减后的光线即可得到样品信息。DRS-FTIR的基本原理是当入射光照射到样品时,一部分被镜面反射,其他部分进入样品内部向各个方向漫反射,与样品分子相互作用,收集这些漫反射光就可获得样品物质信息。由于检测原理的差异,这三种方法对核壳结构材料进行检测的时候各有利弊。
从图3可以看出由于TR-FTIR法采用了KBr进行稀释和压片,DRS-FTIR也用了KBr进行稀释,所以在3 425 cm-1附近有比较明显的水吸收宽峰。而ATR-FTIR法在制样过程中不使用KBr,不需要对样品进行过多的预处理,因此水分对检测结果的影响较小。图3(a)是NHC在三种红外测试方法下得到的谱图,三种方法均能比较好地获得NHC的红外特征信号,但是从精细图中可以看出ATR-FTIR谱线在1 160和1 170 cm-1出现双峰,而在TR-FTIR法和DRS-FTIR法中没有出现。这是由于样品在与KBr研磨过程中,氨基类物质容易与KBr发生离子交换所导致的,也体现了ATR-FTIR检测方法无需对样品进行预处理,不会对核壳结构样品造成损坏的优势。图3(b),(c)和(d)所示,对于核壳结构的NHC复合物而言,TR-FTIR法入射光穿透样品,可以同时得到清晰的核、壳材料的组份信息; ATR-FTIR谱线中NHC特征峰信号较为微弱,而外层包覆物特征峰信号强烈。分析认为ATR-FTIR附件仅能测试样品表面一定厚度以内信息,因而可以根据外层壳结构的红外信息,对核壳结构的包覆完整度及包覆层的厚度做一些定性的探究。而DRS-FTIR法检测深度和样品信息强度介于TR-FTIR与ATR-FTIR之间,更适用于避免KBr研磨,表面疏松且不能与ATR附件中晶体紧密接触的样品。
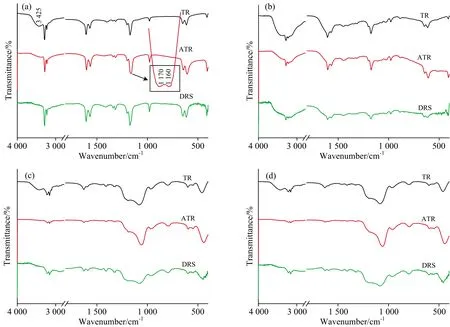
图3 三种红外测试方法的比较(a): NHC; (b): NHC@RF; (c): NHC@SiO2; (d): NHC@RF@SiO2Fig.3 Comparison of three infrared testing methods(a): NHC; (b): NHC@RF; (c): NHC@SiO2; (d): NHC@RF@SiO2
3 结 论
对NHC和NHC@RF,NHC@SiO2,NHC@RF@SiO2核壳结构的NHC复合物进行了合成和表征。结果显示,NHC为纳米棒状结构,RF和SiO2在表面包覆时形成核壳结构复合物; 主要成分除了Ni(N2H4)2Cl2,还含有少量Ni(NH3)6Cl2; TR-FTIR,ATR-FTIR和DRS-FTIR三种傅里叶变换红外光谱法都能检测出NHC样品中主要官能团的特征峰; 对于核壳结构复合物,ATR-FTIR谱线中外层包覆物特征峰信号更为显著,因为ATR-FTIR附件仅能测试样品表面一定厚度以内信息,因而可以根据外层壳结构的红外信息,对核壳结构的包覆完整度及包覆层的厚度做一些定性的探究; RF的包覆对NHC的红外特征峰影响不大,但是SiO2的包覆使N—H的伸缩振动峰红移而弯曲振动峰蓝移。
