表面增强拉曼散射技术在核酸检测中的研究进展及应用
2020-11-06田晖艳黄姣祺谢凤欣黄国荣府伟灵
田晖艳,刘 羽,黄姣祺,谢凤欣,黄国荣,廖 璞,府伟灵,张 阳
1. 陆军军医大学第一附属医院检验科,重庆 4000382. 重庆大学附属肿瘤医院检验科,重庆 400030
1 拉曼光谱技术及其生物医学应用
1928年印度科学家Raman首次发现拉曼散射效应,该效应产生的拉曼光谱是一种散射光谱,当单色光束的光子与生物分子相互作用时,可发生弹性碰撞及非弹性碰撞; 其中,弹性碰撞所产生的光散射被称为瑞利散射,该碰撞过程仅改变了光子的运动方向而不改变频率; 而在非弹性碰撞过程中,光子与分子之间发生能量交换,光子的运动方向及频率均发生改变,这种非弹性散射称为拉曼散射。拉曼散射光谱反应了特征峰的数量、强度、峰宽和位移等信息,这些丰富的谱峰信息均与待测物质的分子振动和转动能级密切相关,因此,每种物质都有其特征拉曼光谱,通过检测得到的拉曼光谱与数据库中的拉曼光谱进行比对,便可得到待测物质的组成信息,从而达到定性分析的目的。此外,利用拉曼特征峰强度与待测物质浓度成正比的关系,可以达到半定量分析的目的。
核酸是以核苷酸为合成单位形成的生物大分子化合物,是生命最基本的遗传物质,在生命体生长、遗传、进化等一系列重大生命现象中占据着决定性作用。开展核酸分子诊断对促进人类健康医疗的发展具有重要意义。拉曼光谱技术在核酸等生物样本的检测与分析方面具有独特的技术优势: (1)对待测样本的形状、大小要求低,可以省去复杂的样本预处理环节; (2)样本需求量少,适用于微量及痕量样本的检测; (3)可实现快速检测,一般在30 s内即可完成对一个样本的检测; (4)通过拉曼标签技术的引入可以达到强特异性检测的目的; (5)由于水的拉曼散射很微弱,使得拉曼光谱技术非常适用于水环境中样本的检测。因此,SERS光谱非常适合于多元生物样本的检测。
2 表面增强拉曼散射技术(SERS)
2.1 表面增强拉曼散射光谱的发现
拉曼光谱作为一种无损、非接触式且可重复的快速检测技术,能够提供分子结构振动的指纹图谱信息且谱峰窄不易发生重叠,在生化物质检测中具有显著优势。但拉曼光谱因其散射截面只有10~30 cm2/分子(约为红外的10-6,荧光光谱的10-14)且容易受到荧光干扰[1],限制了拉曼光谱的广泛应用。20世纪70年代,Fleischmann小组研究发现,将吡啶吸附在粗糙的银表面时,可获得高强度的拉曼光谱信号[2]。在随后的研究中,Van Duyne及Creighton等证实了粗糙银表面对吡啶分子的拉曼信号放大程度可达105~106倍,并将这一粗糙金属表面的增强效应命名为表面增强拉曼散射(surface-enhanced Raman scattering,SERS)[3]。20世纪末,Nie小组及Kneipp等先后研究报道了SERS在单分子及单纳米粒子中的检测,其拉曼信号增强因子可达1014 [4-5]。
2.2 SERS增强原理
在众多的SERS增强机理研究中,物理增强机理和化学增强机理是目前被普遍接受的两种解释机理(如图1所示)。其中,物理增强又称为电磁场增强(electromagnetic enhancement,EM),即电磁波与比波长小得多的等离子体(如Au、Ag)纳米结构的相互作用会引起金属表面自由电子的集体振荡; 当入射光的频率与金属中自由电子固有的振荡频率相匹配时,局域表面等离激元共振(LSPR)就会发生,从而导致入射光场的增强,研究表明电磁场增强的增强因子可达1011左右[6]。化学增强(chemical enhancement)是一种电荷转移增强[7],需要分析物直接吸附或通过化学键结合在粗糙金属表面,并与金属表面存在电荷转移,当入射光子的能量与电子在金属基底及吸附物之间的转移能量差相等时将产生共振,从而使体系的有效极化率增加并使拉曼信号增强,研究表明化学增强因子为101~103左右[8]。通常认为SERS效应的产生是由上述两种增强机理共同作用的结果。此外,Michaels小组研究发现在金属纳米结构的连接点及空隙处,SERS增强因子最大,这是因为当金属纳米颗粒相互靠近形成聚集时跃迁偶极分子相互耦合,在颗粒的结合处能获得显著增强的SERS效应[9],这些特殊的增强位点被称为SERS“热点”。目前,大量对SERS金属基底的选择研究显示,Au、Ag纳米结构因具备较好的稳定性、重复性且极易制取,成为研究者们对SERS基底的首选,并且,具备各向异性及尖锐形态的纳米颗粒(如锥形、纳米棒、纳米星等)较对称形(如球形)纳米颗粒的SERS增强效果更好[10]。

图1 SERS原理示意图
3 基于SERS的核酸检测技术类型及应用
核酸的特异性检测是临床检验医学的重要研究内容,在疾病的诊断及治疗方面具有非常重要的应用价值。常见的基于SERS的核酸检测技术,根据是否使用探针标记物,可分为无标记检测(Label-free SERS)及标记型检测(SERS tags)两种类型(如图2所示)。

图2 SERS无标记检测(左)及标记型检测(右)技术原理示意图
3.1 无标记检测
在无标记检测方法中,待测样本直接吸附于金属纳米结构表面,利用SERS技术直接获取生物样本自身的拉曼指纹图谱,该方法需要结合特殊的纳米基底结构及光谱分析技术,用于区分不同状态下的生物分子或不同物种的细胞、微生物的光谱信息[11]; ElSayed等利用高浓度的球形纳米银胶体颗粒聚集后形成的SERS“热点”效应,研究了癌细胞DNA发生构想变化而形成的拉曼特征峰,实现了对癌细胞DNA和健康细胞DNA高重现性的分辨[12]。Abell等设计了一种以Ag纳米棒为结构单元的微阵列芯片,以此来研究miRNA序列中嘌呤及嘧啶的相对比率,并通过最小二乘法分析成功实现了miRNA捕获杂交前后拉曼光谱的特征差异探究[13]。无标记SERS核酸检测技术的优点在于步骤简单,无需对样本进行特殊处理,但总体而言,该方法尚未能满足临床实际检测对灵敏度及特异性的要求。

表1 SERS无标记检测及标记型检测方法分析Table 1 Analysis of the label-free SERS approach and SERS tags-based nucleic acid assays
3.2 标记型检测
标记型检测方法通常依赖拉曼报告分子修饰的金属纳米颗粒,通过检测拉曼报告分子强烈而独特的拉曼信号达到检测目的[14-15]。当前,基于SERS标记型检测技术的核酸检测方法,主要包括: “夹心法”、“信号开关法”及链式杂交反应(hybridization chain reaction,HCR)引起的信号放大。其中,“夹心法”检测策略灵敏度高,具有良好的定量检测能力,可应用于多元检测,是开展SERS标记型检测DNA/RNA最常用的方法。
3.2.1 “夹心法”检测
“夹心法”SERS探针检测结构一般由纳米金属核、拉曼活性分子、DNA探针链及封闭液构成(如图3所示)。其中,金属核在SERS探针中用作增强基底,是保证SERS探针实现高性能检测的关键之一。金、银胶体溶液因制备简单、易于保存、表面增强效果好等优势在SERS探针金属核的应用最为广泛; 经研究发现,相同实验条件下,纳米金颗粒的表面增强能力较纳米银弱10~100倍[16]。在金属核的结构及形貌方面,伴随着纳米材料制备技术的迅猛发展,不拘于早期的单一球形金属纳米颗粒,现已成熟应用的还有纳米棒、多面体形、星形、树枝形和花形等; 此外,新型的合金或核壳双金属复合纳米粒子也越来越多地应用于SERS探针金属核,如金核银壳、银核金壳等。拉曼活性分子可通过绑定在金属核表面来实现拉曼信号的输出功能; 常用的拉曼活性分子可大致分为三类: 含氮阳离子染料(如结晶紫、罗丹明6G等)、含硫染料(如孔雀石绿)以及硫代小分子(如4-氨基苯硫酚、4-甲基苯硫酚等)[17]。DNA探针链是保证实现SERS探针特异性靶向识别检测目标序列的关键,将DNA探针链在金属核表面的固定方法主要有两种: 一是通过巯基形成S-金属共价键,以及通过氨基和羧基缩合形成酰胺键,从而将DNA探针有序组装到金属核表面。
此外,为了保证上述SERS探针的结构稳定性及特异性检测,通常需要对SERS探针结构外表面进行封闭,常用的封闭液有BSA和MCH等。Zhou等[19]在构建“夹心”SERS标签的基础上,研制了一种以细菌为模板的Ag微球作为信号放大基底,如图4所示,该方法设计了3种分别结合了不同拉曼信号分子(44DP,4-ATP,DTNB)的“夹心”SERS标签,通过捕获探针将SERS标签结合在Ag微球表面,通过对SERS标签的检测可达到同时检测3种肝癌肿瘤标志物miRNA-21,miRNA-122,miRNA-223的目的。从SERS光谱检测结果图中显示: 该方法在具有较高灵敏度与特异性的同时,成功实现了多个肿瘤标志物的高通量检测。
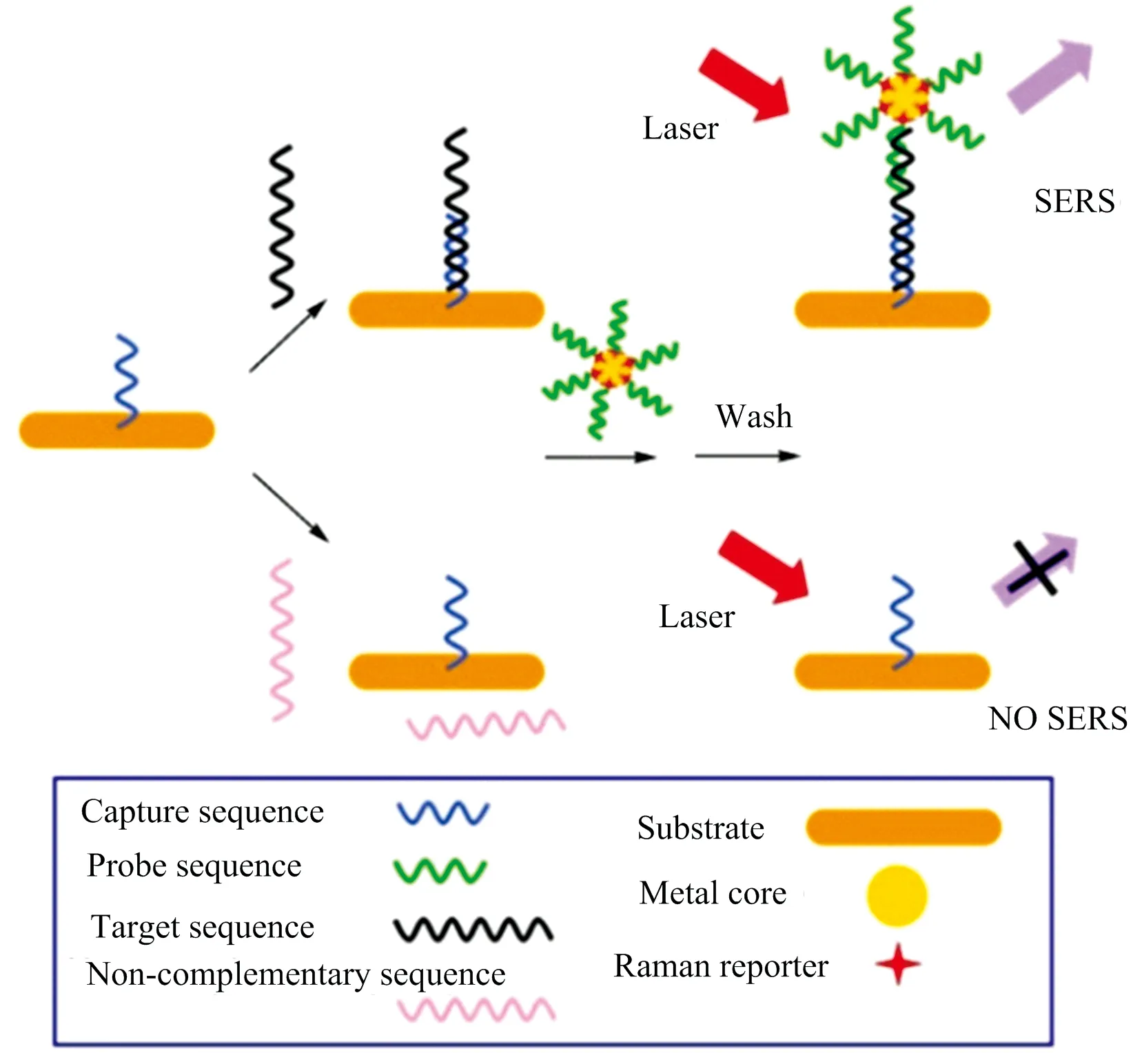
图3 “夹心法”SERS核酸检测结构示意图[18]Fig.3 Scheme of SERS-based nucleic acid detectionbased on sandwich structure[18]
Li等[20]以银纳米粒为核标记探针拉曼分子并包裹二氧化硅壳(Ag nanorice @ MGITC @ SiO2)作为SERS 探针,利用光刻技术在硅圆片上形成三角状金纳米膜作为SERS活性检测基底,实现了乙型肝炎病毒DNA的检测,检测限达到50 amol·L-1。Kang等[21]在直径约为150 nm的金纳米棒上构建检测基底,与球形金纳米颗粒探针一起实现了对复合病原体DNA的检测,检测限达到10 pmol·L-1。Liu等[22]通过合成寡核苷酸修饰的Ag纳米结构为增强基底,并采用DTNB、4-MBA标记、并用寡核苷酸修饰的Au纳米粒子作为SERS标签,直接在水溶液中进行DNA检测,实验结果显示目标DNA浓度在10-11~10-8mol·L-1范围时,目标DNA的浓度对数与SERS信号强度呈现良好的线性关系,此实验方法可与固相检测方法的灵敏度相媲美。
3.2.2 信号开关法
“信号开关法”一般是通过分子探针与目标序列的结合实现。如图5所示,根据目标DNA/RNA序列针对性地设计与目标序列结合过程中可发生可逆性解离、聚合的发夹型DNA探针链,在探针链的两端分别标记上固定基团(如巯基)和拉曼活性分子,探针链通过固定基团组装到SERS活性基底表面,从而成功构建发夹型SERS检测探针。该发夹型探针要求探针链含有与目标DNA/RNA序列完全互补的环状序列,通过与目标DNA/RNA序列的结合实现环链的打开,拉曼活性分子远离基底表面,从而使SERS信号强度发生变化[23]。
Song等[24]采用发夹型SERS检测探针同时检测3种肺癌miRNA标志物(miRNA 21,miRNA 486,miRNA 375),如图6(a),通过设计与目标miRNA完全互补的3种发夹型SERS检测探针,并将探针吸附结合于银纳米棒微阵列基板上。当目标miRNAs存在时,发夹探针环序列打开,拉曼活性分子远离银基底表面,SERS信号由“ON”到“OFF”,信号强度显著降低。通过监测SERS信号值的变化达到定量检测血清中目标miRNAs的目的。实验结果显示: 利用该方法检测人血清中miRNAs的LOD值为: miRNA 21/393 amol·L-1,miRNA 486/176amol·L-1,miRNA 375/144 amol·L-1。
在另一项分析中,Wang等[25]开发了一个SERS信号由“OFF”到“ON”的信号开关,他们称之为“反向分子哨兵(inverse molecular sentinel,iMS)”纳米探针,以区别于之前的“ON”到“OFF”开关。如图6(b),在此项研究中,以一条单链DNA作为“占位”链与纳米探针的茎环序列杂交,发夹探针的环序列打开,从而使拉曼报告分子远离金属纳米颗粒表面; 当目标序列出现时,占位DNA链与纳米探针序列解离,探针序列重新形成发夹型结构,拉曼报告分子移动到金属纳米颗粒表面,从而产生强烈的SERS信号,从图6(b)中的SERS光谱图可以看出,谱线b(样本组)呈现出的SERS信号远高于谱线a(空白对照组),从而佐证了该方法的可行性。
3.2.3 HCR信号放大法
链式杂交反应(hybridization chain reaction,HCR)是一种在室温条件下进行的无酶、线性扩增方法。在HCR反应的溶液中存在着稳定的DNA发夹探针,触发链的进入可引发一系列的杂交反应,最终形成双螺旋DNA聚合物。HCR信号放大联合SERS检测的方法是在DNA聚合物上连接由拉曼活性分子包被的金属纳米颗粒,由金属纳米颗粒形成的“热点”效应可显著实现拉曼信号放大并最终达到定量检测靶序列的目的。
与酶促扩增检测法相比,HCR反应操作简单且成本更低,仅靠单链DNA即可实现双链DNA聚合物大小的原位调节。Li等[26]设计了一种以靶序列为触发链的HCR信号放大联合SERS检测miRNA-141的方法,如图7(a)所示,该方案中的捕获探针由捕获链、Au纳米颗粒及拉曼信号分子构成,由靶序列miRNA-141触发形成的双链DNA聚合物通过纳米磁珠产生聚集后,捕获探针通过捕获链特异性结合DNA聚合物上的粘性末端,使得Au纳米颗粒在聚合物上形成“热点” 效应,通过检测放大后的拉曼信号达到定量检测复杂生物样本中miRNA-141的目的。实验结果显示,利用该方法检测乳腺癌细胞中miRNA-141,其线性有效检测范围为10-15~10-7mol,LOD值可达0.17 fmol·L-1。
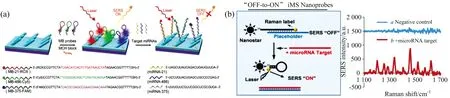
图6 (a)一种用于高通量检测miRNAs的功能化发夹探针SERS传感器原理图[24]; (b)SERS“反向分子哨兵(IMS)”纳米探针检测原理图[25]Fig.6 (a) Schematic illustration of the molecular beacons functionalized-SERS sensor for simultaneously measuringmultiple miRNAs[24]; (b) Detection scheme of the SERS “inverse Molecular Sentinel” nanoprobes[25]
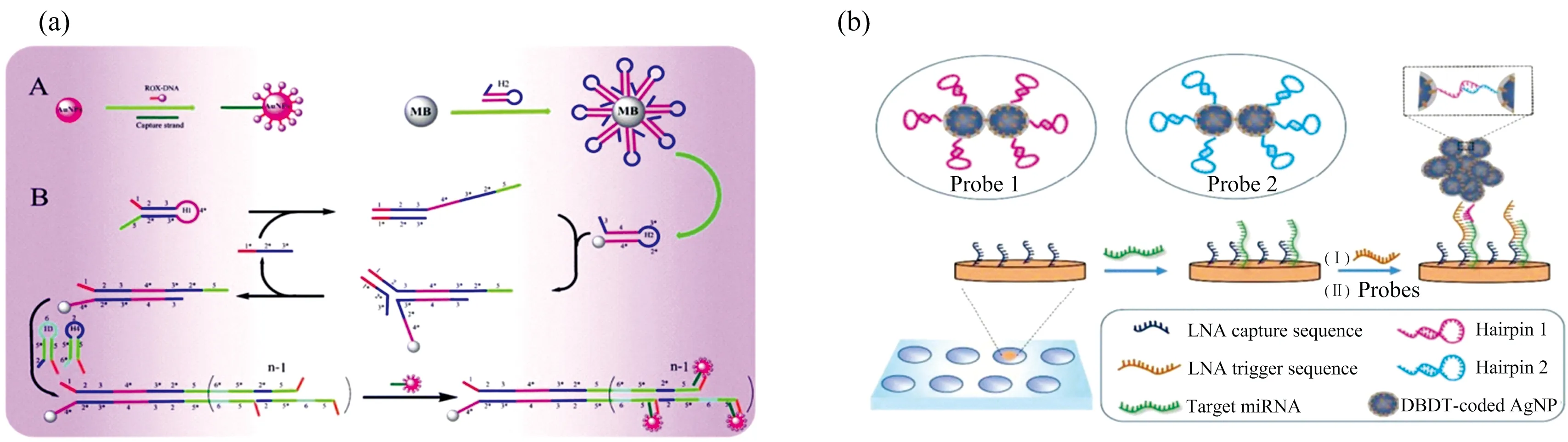
图7 HCR信号放大SERS核酸检测示例图[26-27]Fig.7 Scheme of SERS-based nucleic acid detection based on the signal amplification of hybridization chain reaction[26-27]
在后续的研究中,Liu等[27]采用HCR联合银纳米颗粒形成的“热点”效应,如图7(b),在微阵列硅基片上成功实现了单细胞的miRNA-21检测,如图7所示,该方案采用DBDT(4,4’-biphenyldithiol)作为拉曼信号分子并连接形成间隔距离为1 nm的AgNP二聚体,从而产生典型的SERS “热点”; 当修饰有捕获链的硅基片上引入靶序列miRNA-21后,发生的一系列HCR反应将大量AgNP富集,从而产生超强拉曼信号; 实验结果显示,该方法特异性好,对单碱基突变及双碱基突变序列的检测信号点分别仅为12.4%和4.6%(定义对靶序列miRNA-21的检测信号点100%)。
4 与SERS技术联用的核酸检测方法
4.1 SERS联合PCR核酸检测方法
基于聚合酶链式反应(PCR)的SERS技术主要是目标DNA片段的PCR扩增产物与SERS探针结合,在激光照射下产生SERS信号,根据SERS光谱实现DNA检测。He等[28]利用RCA扩增技术及SERS信号开关技术建立了一种miRNA超灵敏检测方法,在磁性纳米颗粒上连接功能性发夹探针,发夹探针一端连接纳米金颗粒; 原始状态下,磁性纳米颗粒上的发夹探针通过与占位DNA链的结合-环链打开,Cy5远离磁性纳米颗粒,拉曼信号弱,信号开关处于闭合状态; 通过引入RCA扩增产生的DNA触发链后,该触发链竞争性结合占位DNA链,发夹探针的形成环序列,拉曼活性分子靠近磁性纳米颗粒并在SERS效应的影响下产生强烈的拉曼信号,从而达到超灵敏检测miRNA-150的目的。实验结果显示: 此检测方法的LOD值为70.2 amol·L-1,有效线性检测范围为100 amol·L-1~100 pmol·L-1。SERS联合PCR核酸检测方法在微量检测及样本处理方面具有诸多优势,通过PCR技术可以成功实现对靶序列的重组及浓度放大,从而达到超灵敏检测的目的。
4.2 SERS联合酶切技术的核酸检测方法
基于酶切技术的核酸SERS检测主要是借助金属纳米颗粒之间“热点”的优异SERS增强性能,利用ss-DNA的自组装增加热点形成的概率,利用酶切反应进行热点消除,来实现SERS信号从弱到强再从强到弱的变化。Crew等[29]在包被了拉曼活性分子的金纳米颗粒之间设计并连接了一条30 bp的DNA双链,通过DNA双链连接形成的金纳米颗粒多聚体形成了大量SERS“热点”,可产生较强的SERS信号; 当限制性内切酶作用于DNA双链时,“热点”消失,SERS信号显著减弱,由此根据SERS信号的变化可以实现对DNA杂交及限制性酶切过程的检测。SERS联合酶切技术的核酸检测方法可成功实现在液相环境中的DNA组装及核酸有效检测,充分发挥了金属纳米颗粒之间SERS“热点”的优势,达到高灵敏检测的目的。该研究清楚地验证了DNA自组装及酶切反应在SERS“热点效应”形成过程中的能力,这对于制定新的生物分析策略具有重要意义。
关于SERS技术在核酸检测中的应用研究主要集中在不同SERS增强基底、不同靶标捕获方式、不同信号放大方式等方面,基底功能化、多种拉曼报告分子形成多元检测、“热点效应”的产生及减弱已成为SERS核酸检测的主要趋势,表2为SERS技术在核酸检测中的应用。

表2 SERS在核酸检测中的应用Table 2 Typical research about SERS used for detection on nucleic acids
5 SERS技术走向临床应用的技术发展方向
SERS技术作为一种新兴的快速检测方法,因其特有的指纹图谱、无损性、高灵敏度、操作简单且不受水干扰等技术优势,已成为核酸检测领域近年来的研究热点。然而,SERS技术在临床应用方面仍然存在着诸多挑战: (1)大规模生产重现性能好、可长期稳定储存的高灵敏度SERS探针较难实现,目前常用的Au和Ag纳米颗粒在溶液中极易产生聚集,并且拉曼活性分子与纳米颗粒的结合稳定性差,因此,对SERS探针表面结构的涂层保护非常重要; (2)为了准确实现对生物样本中各种循环标志物浓度检测,必须首先获得可信的定量检测标准曲线,但由于生物样本自身的成分复杂,对SERS检测信号的干扰因素较多,使得对临床样本的准确定量检测较难成功实现; (3)研制高灵敏度、易操作、低成本的拉曼光谱仪是将SERS技术转化为实际应用的关键。我们相信,在多学科研究人员和临床工作者的不断共同努力下,基于SERS的生物样本检测技术将得到进一步改进,并将稳步向临床应用方向发展。
6 展 望
拉曼光谱作为一种无损、非接触式且可重复的快速检测技术,能够提供分子结构振动的指纹图谱信息且谱峰窄不易发生重叠,在生化物质检测中具有显著优势。SERS有望实现高灵敏分析检测核酸的技术,在临床分子诊断、食品安全、病原微生物检测领域展现了潜在的应用价值。相信随着纳米技术、生物芯片、微流体技术的进步以及便携式拉曼光谱仪、生物样本拉曼光谱数据库的完善,SERS技术会在不久的将来广泛应用于生物样本检测,尤其是核酸分子诊断领域,为临床实验室诊断提供一种强大的分析技术。
