自噬在膜性肾病补体攻膜复合物所致足细胞损伤中的作用
2020-11-06吴洪銮李志航刘伟敬刘华锋广东医科大学附属医院肾病研究所湛江市慢性肾脏病防控重点实验室广东湛江524001
吴洪銮,安 宁,钟 珍,李志航,刘伟敬,刘华锋,杨 陈 (广东医科大学附属医院肾病研究所、湛江市慢性肾脏病防控重点实验室,广东湛江 524001)
原发性膜性肾病(pMN)是一种以蛋白尿为主要临床表现的原发性肾小球疾病,约15%pMN患者在5~15 a内进展成终末期肾衰竭(ESDR)[1]。目前认为其发病机制之一是原位免疫复合物在肾小球上皮下沉积,激活补体系统,形成攻膜复合物C5b-9[2]。C5b-9作用于足细胞,导致足细胞产生足突融合、凋亡、增殖受限以及从肾小球基底膜上脱落等改变,引起肾小球滤过屏障结构和功能障碍,进而产生蛋白尿[3]。由此可见,C5b-9所致的足细胞损伤在pMN起始与进展中发挥重要作用,同时也说明足细胞是治疗pMN的重要靶细胞。自噬是胞浆大分子物质和细胞器在膜包囊泡中降解的生物学过程,是一种广泛存在于真核细胞中的生命现象。肾小球系膜细胞、足细胞、肾小球内皮细胞和肾小管上皮细胞等均保持一定程度的自噬以维持细胞本身的正常生理功能[4-8]。因此,进一步明确自噬在pMN足细胞损伤中所扮演的角色或许是今后pMN治疗的另一突破口。本研究探讨了自噬在C5b-9所致足细胞损伤中的作用,旨为膜性肾病寻找新的治疗靶点提供参考依据。
1 材料和方法
1.1 材料
MPC-5细胞株为永生化小鼠足细胞株,由广东省人民医院史伟教授赠送。RPMI 1640(Roswell Park Memorial Institute 1640) 培养基、胎牛血清、0.05%胰蛋白酶-乙二胺四乙酸(EDTA)、I型鼠尾胶原购于美国Gibco公司;γ-干扰素购于美国Millipore公司;乳酸脱氢酶(LDH)活性测定试剂盒购于美国BioVision公司;兔抗人C5b-9抗体、兔抗小鼠nephrin、兔抗小鼠podocin、兔抗小鼠LC3和兔抗小鼠Tubulin抗体购于美国Abcam公司;Alexa Fluor 488染料标记的驴抗兔IgG和鬼笔环肽(fluorescein phalloidin)购于美国Molecular Probes公司;抗荧光淬灭封片液4', 6-二脒基-2-苯基吲哚(DAPI)购于中国碧云天公司;雷帕霉素(RAP)、氯喹(CQ)、二甲基亚砜(DMSO)和酵母多糖A(zymosan A)购于美国Sigma公司。其他试剂均购于国内外知名试剂公司。
1.2 酵母多糖活化血清(ZAS)的制备及刺激浓度的筛选[9]
0.15 mol/L氯化钠配置1%的酵母多糖,双蒸水煮沸1 h后冷却至室温,4 000 r/min离心30 min,弃上清,沉淀备用。无菌采集取正常志愿者血清,用0.8 μm滤器过滤,并于56 ℃热灭活30 min,即得到热灭活正常人血清(HIS)。将过滤后的未灭活血清以1:1的比例与酵母多糖混匀后37 ℃孵育1 h,1 2210 r/min 于4 ℃离心5 min,取上层血清,用0.8 μm滤器再次过滤后即可得酵母多糖活化血清(ZAS)。分别用含2%、4%、6%、8%、10%和12%ZAS的培养基在37 ℃培养细胞60 min,参考试剂盒说明书检测其培养液上清LDH释放率,寻找足细胞C5b-9亚溶破模型建立的最适ZAS浓度,并用免疫荧光检测足细胞上C5b-9的表达情况,评价足细胞C5b-9亚溶解模型建立是否成功。同时根据实验结果,选取含10%ZAS的培养液作用于MPC-5细胞,建立MPC-5 细胞C5b-9亚溶破模型[10]。
1.3 细胞培养和分组
用含10%(体积分数)胎牛血清、100 U/mL青链霉素以及10~ 50 U/mLγ-干扰素的RPMI 1640培养液在5% CO2、33 ℃条件下诱导MPC-5细胞增殖。待细胞生长至60%~70%融合时,转入37 ℃培养箱、I型胶原铺被的培养瓶中诱导其分化,培养基无需加入γ-干扰素。足细胞经8~12 d诱导后,用于后续分组:正常对照组(CON组)、10%酵母多糖活化血清刺激组(ZAS组)、ZAS+雷帕霉素组(ZAS+RAP组)、ZAS+氯喹组(ZAS+CQ组)、单独雷帕霉素组(RAP组)及单独氯喹组(CQ组)。CON组加入10%热灭活后正常人血清(HIS)作对照,ZAS组加10%ZAS(含人C5b-9)进行刺激。雷帕霉素和氯喹的刺激终浓度均为10 μmol/L。
1.4 蛋白免疫印迹法检测自噬标记蛋白LC3表达
用含苯甲基磺酰氟(PMSF)的RIPA裂解液(radio immunoprecipitation assay lysis buffer)提取细胞蛋白,用BCA(bicinchoninic acid)定量蛋白浓度。将等量蛋白行SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE),而后湿转法转至聚偏二氟乙烯(PVDF)膜上。用含5%牛血清白蛋白(BSA)的磷酸盐缓冲液(PBS-T)封闭PVDF膜1 h后,加入兔抗小鼠LC3一抗或Tubulin一抗于4 ℃孵育过夜。PBS-T清洗后,加入HRP标记的驴抗兔IgG二抗孵育1 h。PVDF膜经清洗后,加入ECL发光液进行显色,于Azure C500成像系统中观察结果。
1.5 透射电子显微镜观察足细胞自噬泡形成
将体外处理后的足细胞加入2.5%戊二醛混合固定液中,置于4 ℃固定24 h后,用1%锇酸固定液再固定1~2 h;依次用50%、75%、90%和100%酒精进行脱水,每个浓度停留15~30 min;用氧化丙烯透明3次,每次10~15 min;氧化丙烯和Epon812工作液等量混合,对组织进行渗透;新鲜配制的Epon812固化块逐渐加高温度(不超过60 ℃)使之聚合变硬,包埋;切0.2~2 μm的半薄切片,以0.5%美兰溶液染色5 min,光学显微镜定位观察,之后将包埋块切成表面积为0.3 mm×0.2 mm的锥体状,用超薄切片机制成50~60 nm的超薄切片,并置于镍网的火棉胶薄膜上,用醋酸铀、柠檬酸铅双染色;最后在JEM-1400型电子显微镜下观察足细胞自噬泡的形成情况。
1.6 直接免疫荧光法标记足细胞骨架蛋白F-actin的变化
将培养于盖玻片上的足细胞用4%多聚甲醛于常温固定10 min;PBS洗后用0.5% Triton X-100常温通透5 min,PBS洗后,每张片加50 μL 100 nmol/L的鬼笔环肽,于湿盒避光常温孵育30 min染色细胞骨架蛋白F-actin。PBS洗后,滴加DAPI染核5 min,滴加抗荧光淬灭封片液封片,于4 ℃避光保存。激光共聚焦显微镜下观察并随机采集5个视野(至少50个细胞)进行拍照。细胞内出现的显示细胞轮廓的线状荧光即细胞骨架的阳性染色。按细胞骨架的变化程度设立评分标准[11],即正常(0分)、轻微变化(1分)、中度变化(2分),严重变化(3分)。
1.7 间接免疫细胞荧光法检测C5b-9的组装及nephrin、podocin的表达
取出细胞爬片,用4%多聚甲醛在常温下固定10 min;PBS冲洗后,加入0.5% TritonX-100穿透细胞膜10 min,用PBS冲洗后加入5%BSA封闭抗原60 min。而后滴加用2.5%BSA稀释的兔抗人C5b-9、兔抗小鼠nephrin或兔抗小鼠podocin多克隆抗体,每次实验均作空对照白(PBS代替一抗)和同型对照(兔/鼠血清或IgG亚型代替一抗),湿盒内4 ℃孵育过夜后。次日用PBS洗后,滴加Alexa Fluor 488染料标记的驴抗兔IgG,37 ℃避光孵育60 min;PBS洗后,滴加DAPI 染核10 min,滴加抗荧光淬灭封片液。在激光扫描共聚焦显微镜下观察并随机采集5个视野(至少25个细胞)进行拍照。评估C5b-9的组装:在细胞膜上出现绿色针尖点样、粗颗粒样或片状结构认为染色阳性。足细胞nephrin和podocin表达情况用Image J软件进行定量分析,并进行组间比较。
1.8 统计学处理
应用SPSS 16.0软件进行统计分析。计量资料以±s表示,多个样本比较采用单因素方差分析,方差齐时两两比较采用Bonferroni法,方差不齐时两两比较采用Tamhane’s T2法。P<0.05表示差异有统计学意义。
2 结果
2.1 亚溶解型C5b-9的刺激对足细胞自噬状态的影响
如图1所示,与CON组相比,ZAS刺激下足细胞内自噬标记蛋白LC3 II的表达显著增加。透射电子显微镜下观察发现,较之CON组,ZAS刺激下足细胞内自噬泡生成增多。
2.2 调节自噬对C5b-9亚溶破模型下足细胞骨架蛋白F-actin的影响
如图2所示,与CON组比较,ZAS组细胞骨架结构明显被破坏,细胞骨架极性消失,排列紊乱。与ZAS组比较,ZAS+CQ组的细胞骨架破坏程度更加明显,细胞回缩,细胞骨架丝状结构完全消失,极性消失,排列紊乱和稀疏;ZAS+RAP组的细胞骨架结构明显改善,表现为排列较为有序、细胞极性有所保留。对各组MPC-5细胞的细胞骨架破坏程度进行评分,结果显示亚溶解型C5b-9作用于足细胞造成细胞骨架明显破坏(P<0.01);加入自噬抑制剂氯喹后能够加重这种损害(P<0.01),而加入雷帕霉素则减轻C5b-9造成的细胞骨架异常变化(P<0.01)。
2.3 调节自噬对C5b-9亚溶破模型下足细胞裂孔膜蛋白podocin和nephrin的影响
与CON组比较,ZAS组足细胞podocin和nephrin表达减少(P<0.01)。与ZAS组比较,ZAS+CQ组足细胞podocin和nephrin表达量进一步减少(P<0.01或0.05),而加用雷帕霉素处理后能够抑制ZAS刺激所致足细胞podocin和nephrin表达量的下降(P<0.05或0.01)。见图3、4。
3 讨论
本研究通过体外建立足细胞C5b-9亚溶破损伤模型发现足细胞自噬相关蛋白LC3 II的表达升高,自噬泡生成增多,提示自噬活化参与其中。不仅如此,我们还发现抑制自噬进一步加重亚溶解型C5b-9所致足细胞骨架蛋白F-actin及裂孔蛋白podocin和nephrin的表达下调;而用雷帕霉素进一步激活自噬,则减轻C5b-9所致足细胞形态损伤变化。

图1 亚溶解型C5b-9刺激下足细胞自噬蛋白LC3 Ⅱ的表达及自噬泡形成的变化

图2 自噬调节对亚溶解型C5b-9所致MPC-5细胞骨架蛋白F-actin的影响

图3 自噬调节对亚溶解型C5b-9所致MPC-5细胞podocin表达的影响
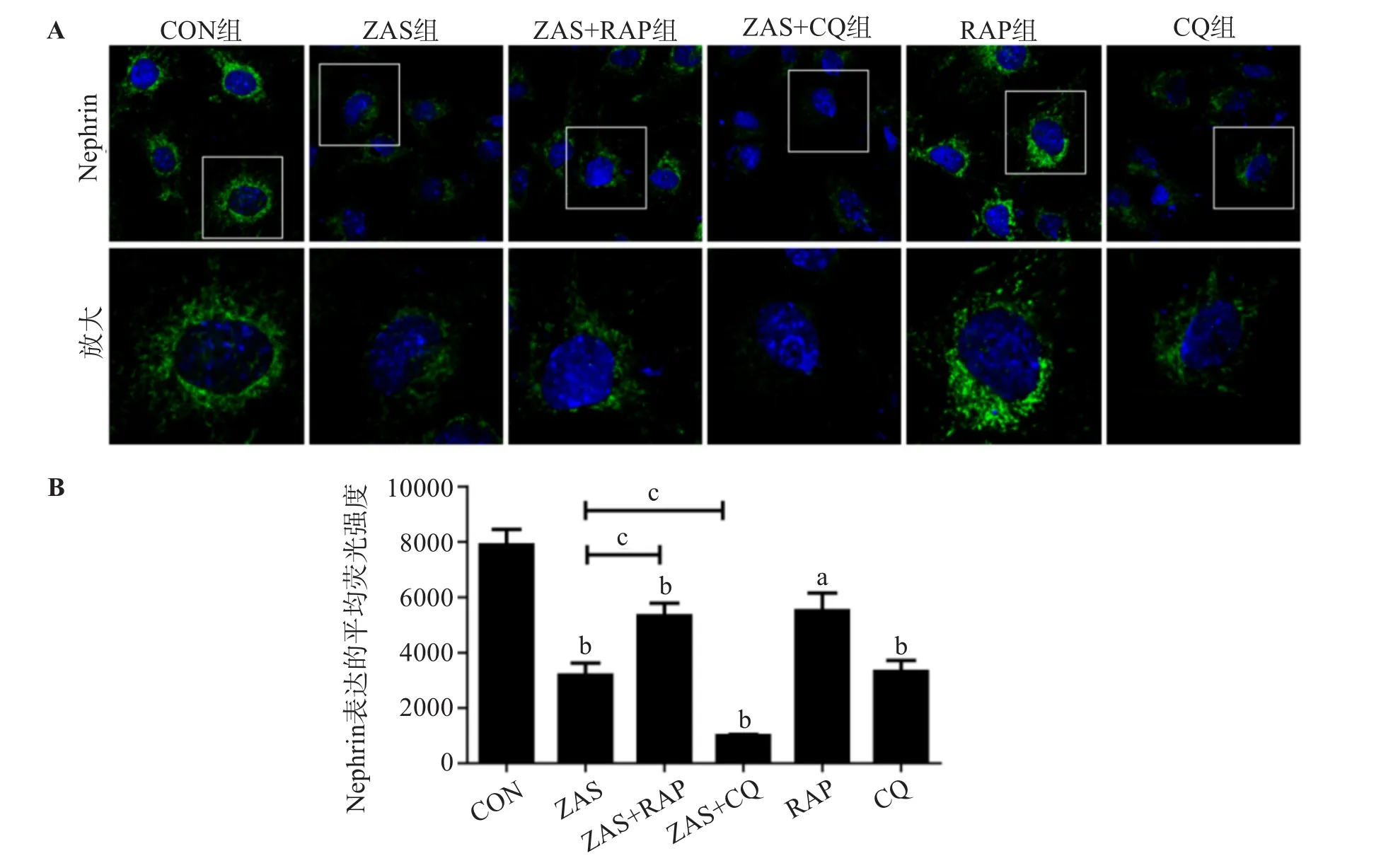
图4 自噬调节对亚溶解型C5b-9所致MPC-5细胞nephrin表达的影响
pMN是较常见的一种肾小球疾病[12],尽管其发病机制尚未完全阐明[13],但是随着研究的深入,目前认为,足细胞自身抗原与相应抗体结合所致的原位免疫复合物在其发病过程中起着重要作用。研究发现,这一免疫过程激活了补体系统,最终形成补体C5b-9攻膜复合物,C5b-9作用于足细胞,引起一系列病理生理改变,最终导致蛋白尿的产生及肾小球硬化等[2]。
相关研究指出,C5b-9损伤足细胞同时,也会引起足细胞内自我保护机制发挥作用[14-15]。因此,在找到抑制自身抗体的产生、彻底清除自身抗体抑或补体攻膜复合物沉积的方法之前,针对性地足细胞保护可能为pMN治疗带来新思路。
自噬是广泛存在于真核细胞中的一种进化上高度保守、溶酶体调控的细胞内降解机制,其主要负责降解蛋白聚集体和损坏的细胞器以维持细胞的新陈代谢,与细胞的生长、分化、功能和存活密切相关。越来越多的研究发现:自噬参与人类的健康和多种疾病[16-17]。而目前自噬在肾脏疾病发生发展中的重要作用也越来越得到重视。研究报道,在生理状态下,足细胞基础自噬活性明显高于其他肾脏固有细胞[4],这足以让我们相信足细胞内降解系统在维持细胞生理稳态中扮演着重要的角色。确实,有研究表明,足细胞自噬在肾脏损伤中起着保护性的作用并能延缓足细胞病(微小病变性肾病和局灶节段性肾小球硬化)的进展[18]。
为了解自噬如何参与补体攻膜复合物所致足细胞损伤,我们利用酵母多糖孵育正常人血清得到含C5b-9的活化血清ZAS。酵母多糖通过替代活化途径激活补体系统,最终形成C5b-9攻膜复合物。在此亚溶解型C5b-9刺激体外模型中,足细胞内自噬相关蛋白LC3 Ⅱ表达升高,电子显微镜观察到自噬泡有明显的增加。因此,提示C5b-9所致足细胞损伤过程中,自噬可能被激活。
那么自噬活化是否起保护作用呢?抑或调控足细胞的自噬能否减轻C5b-9所致其损伤呢?为此,我们应用体外研究方法观察,调节足细胞自噬水平能否加重抑或减轻C5b-9所致的足细胞骨架蛋白和裂孔蛋白的表达和分布异常。应用免疫荧光的方法检测了各组足细胞骨架蛋白F-actin以及裂孔标志蛋白podocin和nephrin的表达。我们发现,在C5b-9刺激下,F-actin纤维丝失去平行排列形态,出现骨架蛋白塌陷,点状或团块状聚集。而podocin和nephrin的表达下降且分布异常,提示足细胞发生形态损伤。在此基础上利用溶酶体抑制剂氯喹抑制自噬通路后,F-actin团块样聚集进一步增加,podocin和nephrin表达进一步下降;这与既往研究,自噬缺陷或抑制自噬起始加重足细胞损伤的报道是一致的。而利用雷帕霉素激活自噬则能够减轻上述损伤。既往报道雷帕霉素通过抑制mTOR激活自噬可以保护足细胞抵抗糖尿病状态所致损伤。因此,自噬对C5b-9所致的足细胞的损伤是起保护作用的。
综上所述,C5b-9可导致F-actin、podocin和nephrin表达异常或减少,引起足细胞损伤,而激活足细胞自噬可减轻补体攻膜复合物C5b-9所致的足细胞损伤。该研究发现为临床上治疗pMN及其他补体所致足细胞损伤肾小球疾病提供了新思路。
