斜带石斑鱼INAD基因cDNA的克隆及表达
2020-11-06黄景军魏润平黄春仁何家瑞邓贤铭马细兰李水生周立斌
黄景军,魏润平,黄春仁,何家瑞,邓贤铭,马细兰,李水生,张 勇,周立斌
(1.惠州学院 生命科学学院,广东 惠州 516081;2.中山大学 水生经济动物研究所暨广东省水生经济动物良种繁育重点实验室,广州 510275;3.海南晨海水产有限公司,海南 三亚 572000;4.海南德益丰水产科技有限公司,海南 文昌 571000;5.西南林业大学 生命科学学院,昆明 650224)
0 引言
斜带石斑鱼(Epinepheluscoioides),属于鲈形目(Perciformes)、鮨科(Serranidae)、石斑鱼亚科(Epinephelinae)、石斑鱼属(Epinephelus)[1],为广盐性暖水性中下层鱼类,主要分布于太平洋和印度洋的热带及亚热带海区[2].斜带石斑鱼生长快、适应性强、肉质鲜美、营养丰富,是我国南方沿海海水养殖的高档经济鱼类[3].斜带石斑鱼是典型的雌雄同体鱼类,一般雌性性成熟之后,再经历性逆转过程,变为雄性.性腺内精原细胞开始增殖发育直至占主导地位之后,才具有雄性生殖功能,一般情况下发生性逆转的年龄至少在4龄以上[4].斜带石斑鱼的性腺发育和性逆转受到遗传因素和外部环境因素影响.针对斜带石斑鱼的性别发育和性逆转现象,我国研究人员从遗传因素包括性别决定相关基因以及生殖内分泌调控的促性腺激素(Gonadotropin,GtH),即促卵泡激素(Follicle-stimulating Hormone,FSH)和促黄体激素(Luteinizing Hormone,LH)等方面开展了系统的研究,而在外部环境因素方面,则主要从群体中的性别比例、层级关系、打斗现象等社会学角度开展研究[5].
INAD(Inactivation no after-potential D)蛋白定位于果蝇光感受器的微绒毛上,是一种典型的支架蛋白,负责介导G蛋白偶联级联视觉信号通路,调控果蝇视觉信号的传导,其核心功能结构由5个PDZ结构域串联组成[6].PDZ结构域由80~100个氨基酸组成,其标志性结构包括6个β折叠和2 个α螺旋,是介导蛋白质之间相互作用的经典结构域.PDZ 结构域能够特异性地识别配体靶蛋白C 末端氨基酸序列(-X-S/T-X-Ф,X是任意残基,Ф 是疏水残基)[7].这种PDZ结构域广泛分布于神经递质受体、离子通道的胞内段,是受体、离子通道向胞膜转运、锚定的必备条件[8].在黄颡鱼的研究中有学者构建了YY超雄黄颡鱼的BAC文库并筛选到了包含性别连锁标记Pf62-Y的BAC克隆,对BAC克隆进行测序鉴定到了新基因INAD,并推测该INAD基因可能跟黄颡鱼性别调控相关[9-10].
本研究以斜带石斑鱼为研究对象,通过克隆获得INAD基因序列,并通过QRT-PCR定量分析的方法,研究了INAD基因在斜带石斑鱼中的组织差异性表达,以及在不同时期性腺中的差异性表达.另外,本研究还分析了注射促卵泡激素(FSH)或促黄体激素(LH)两种激素对INAD基因表达的影响等,初步探究了INAD基因与斜带石斑鱼性别决定与分化存在可能关联,为斜带石斑鱼性别决定的研究提供新的思路.
1 材料与方法
1.1 实验动物处理
实验用斜带石斑鱼(Epinepheluscoioides),雌鱼3龄,雄鱼4~5龄,来自广东省海洋渔业试验中心,通过不间断的抽取海水并过滤来饲养.麻醉后,测其体长体质量,进行活体解剖取出各组织器官,液氮速冻保存带回实验室,存放于-80 ℃冰箱备用.共提取17个组织的样品,分别为:嗅球、端脑、中脑、小脑、延脑、下丘、垂体、心脏、肝脏、胃、性腺、头肾、肾脏、皮肤、肌肉、鳃、脾脏.同时,提取处于不同发育时期性腺组织样品,即卵巢、兼性性腺、精巢各四个.
注射用促卵泡激素(宁波市三生药业有限公司)与注射用促黄体激素(宁波市三生药业有限公司)溶于0.5 mL 0.9%生理盐水,实验组分为两组(n=12)每两周分别腹腔注射FSH 200 UI/尾或200 UI/尾LH,对照组注射等量(0.5 mL)生理盐水,共注射2次,每次注射后第15天活体抽取适量性腺,用于后续的QRT-PCR分析.
1.2 斜带石斑鱼INAD基因克隆和序列分析
采用Trizol试剂(Invitrogen,USA)从性腺组织中提取总RNA,总RNA纯度用1%琼脂糖凝胶电泳检测,通过NanoDrop2000核酸蛋白检测仪对总RNA浓度测定.按照Transcriptor First Strand cDNA Synthesis Kit反转录试剂盒(Roche,德国)说明书将1 μg总RNA反转录合成第一链cDNA.根据实验室已有的性腺转录组数据,获取了其余INAD基因的序列,根据已知序列两端信息设计RACE(rapid-amplification of cDNA ends)引物,扩增出片段.在此基础上,设计扩增引物,从而获得INAD基因的完整ORF序列(表1).

表1 斜带石斑鱼INAD基因克隆与分析所用的引物序列
1.3 氨基酸序列的同源性比对
采用了如下9种鱼类INAD基因的表达产物氨基酸序列,利用BioEdit软件进行了同源性分析.这9种鱼类:鲈形目的斜带石斑鱼(Epinepheluscoioides)、奈里朴丽鱼(Pundamilianyererei)和大弹涂鱼(Boleophthalmuspectinirostris);鳉形目的茉莉花鳉(Poecilialatipinna)和花斑剑尾鱼(Xiphophorusmaculatus);狗鱼目的白斑狗鱼(Esoxlucius);鲤形目的斑马鱼(Daniorerio)和鲤鱼(Cyprinuscarpio);鲇形目的斑点叉尾鮰(Ictaluruspunctatus).
1.4 INAD基因的进化树分析
在本步骤中,选取11种鱼类:鲈形目的斜带石斑鱼(Epinepheluscoioides)、大黄鱼(Larimichthyscrocea)、奈里朴丽鱼(Pundamilianyererei)和大弹涂鱼(Boleophthalmuspectinirostris),鳉形目的茉莉花鳉(Poecilialatipinna)、秀美花鳉(Poeciliaformosa)和花斑剑尾鱼(Xiphophorusmaculatus),狗鱼目的白斑狗鱼(Esoxlucius),鲤形目的斑马鱼(Daniorerio)和鲤鱼(Cyprinuscarpio);鲇形目的斑点叉尾鮰(Ictaluruspunctatus);还选取了哺乳纲的黑猩猩(Pantroglodytes)、人(Homosapiens)、倭狐猴(Microcebusmurinus)、褐家鼠(Rattusnorvegicus)、家牛(Bostaurus),鸟纲的双领鸻(Charadriusvociferus)、暴雪鹱(Fulmarusglacialis)、大杜鹃(Cuculuscanorus)共19个物种;利用MEGA 7对INAD基因进行多重序列比对,并进一步绘制进化树.
1.5 组织表达检测
采用β-actin基因作为内参基因,对斜带石斑鱼INAD基因在17个组织的表达进行RT-PCR检测.加样体系为:12.5 μL PCR Mix(2×),10.5 μL无菌水,0.5 μL上游引物,0.5 μL下游引物,1 μL cDNA模板.RT-PCR的程序如下:95 ℃预变性30 s,1个循环;95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s,共进行循环40次;最后72 ℃延伸5 min;4 ℃保存.PCR产物进行1%琼脂糖凝胶电泳分析.
1.6 性腺表达检测
在Roche Light Cycler 480(Roche,德国)实时荧光定量PCR 仪上进行qPCR 分析,检测INAD基因在性腺不同发育时期和激素处理后的表达,以β-actin作为内参基因.参照试剂盒说明书及LightCycler 480 SYBR Green I Master(Roche)说明书进行,反应体系为:5 μL SYBR-Green,0.4 μL上游引物,0.4 μL下游引物,0.5 μL 各组织cDNA模板,3.7 μL去离子水.反应程序:95 ℃预变性60 s,1个循环;95 ℃变性15 s,55 ℃退火20 s,72 ℃延伸,20 s,共循环40 次.运用2-ΔΔCt方法计算INAD基因的相对表达量.
1.7 数据处理
本实验采用Mega7软件构建系统发生树,实验数据通过SPSS 21.0软件进行统计分析,所得数据结果用平均值±标准差(Mean±SD)表示,先对数据进行单因素方差分析(One-way ANOVA),再对有显著性差异的数据进行Duncan氏多重比较,P<0.05则表示差异显著.
2 结果
2.1 斜带石斑鱼INAD基因序列分析
通过RACE-PCR扩增后,再经胶回收、连接转化、验证及公司测序系列操作得到单一的片段后,通过使用BLAST和ORFfinder软件分析后,获得斜带石斑鱼INAD基因的ORF区段序列,共5 337 bp.根据真核生物的密码子表,将INAD基因的ORF的核酸序列,翻译为相应蛋白质的氨基酸序列(图1).

表示软件预测的PDZ 结构域.图1 INAD基因的cDNA ORF核酸序列及推导的氨基酸序列


图1(续)
2.2 斜带石斑鱼INAD基因同源性分析
2.2.1 氨基酸序列的同源性比对
获得了斜带石斑鱼INAD基因所编码蛋白的氨基酸序列后,从网上已知数据库中查询到多种其他鱼类中INAD基因表达产物(蛋白)的氨基酸序列,通过对属于鲈形目、鳉形目、鲤形目、狗鱼目和鲇形目的几种鱼类的INAD基因编码的蛋白氨基酸序列进行比对(表2),可以发现该蛋白都分别在不同鱼类中均具有一定的同源性,主要集中在氨基酸序列25~521 bp、658~768 bp、919~1 017 bp、1 322~1 451 bp、1 572~1 685 bp、1 869~2 041 bp以及2 183~2 383 bp(图2).

表2 斜带石斑鱼INAD与其他已知INAD同源序列氨基酸比对

图2(续)
2.2.2INAD基因的进化树分析
通过邻接法(Neighborjoining)构建了基于INAD基因序列的系统发生树,在构建系统发生树时,用Bootsrap value 法检验,1 000 次重复抽样得到节点的置信度以自引导值估计.结果显示:由INAD基因构建的NJ系统发生树得出斜带石斑鱼与鲈形目的大黄鱼最先聚到一支,之后与奈里朴丽鱼再聚到一起,之后再依次与鳉形目中的花斑剑尾鱼、茉莉花鳉和秀美花鳉聚到一起,合为一个分支再与鲈形目的大弹涂鱼聚到一起,再合为一个分支与狗鱼目的白斑狗鱼、鲤形目的斑马鱼和鲤鱼及鲇形目的斑点叉尾鮰聚到一起.斜带石斑鱼INAD基因与哺乳纲和鸟纲处于较远的不同分支(图3).

图3 几个物种INAD基因的进化系统树 注:从GenBank中选出的其他物种基因的序列号是大黄鱼(KKF11065.1)、奈里朴丽鱼(XP_005732471.1)、大弹涂鱼(XP_020787702.1)、茉莉花鳉(XP_014870465.1)、秀美花鳉(XP_016521813.1)、花斑剑尾鱼(XP_014329708.1)、白斑狗鱼(XP_012990420.1)、斑马鱼(NP_001120657.1)、鲤鱼(XP_018920765.1)、斑点叉尾鮰(AHH42714.1)、黑猩猩(JAA40750.1)、人(NP_001337074.1)、倭狐猴(XP_012622537.1)、褐家鼠(NP_536323.1)、家牛(DAA31268.1)、双领鸻(KGL92467.1)、暴雪鹱(KFV96570.1)、大杜鹃(KFO82237.1).
2.3 斜带石斑鱼INAD基因在不同组织以及不同时期性腺中的表达
2.3.1 RT-PCR检测INAD基因的组织差异性表达的结果
INAD基因在端脑检测不到表达,在嗅球、中脑、小脑、延脑、下丘、垂体、心脏、肝脏、胃、性腺、头肾、肾脏、皮肤、肌肉、鳃、脾脏等16个组织中均检测到表达(图4).表明该基因可能在鱼体中多个组织均发挥着重要的作用.

图4 斜带石斑鱼INAD基因在17个组织中的表达特异性电泳图注:a为INAD基因;b为内参基因.
2.3.2 斜带石斑鱼INAD基因不同时期性腺中的表达结果
INAD基因在斜带石斑鱼不同时期的性腺,包括雌性状态鱼体中的卵巢、雄鱼状态鱼体中的精巢、雌性状态鱼体将要性逆转为雄鱼状态鱼体状态的兼性性腺,具有相对较高的表达量,这说明了INAD基因可能在性腺之中发挥着某种重要作用.值得注意的是,INAD基因的表达量依次从卵巢、兼性性腺、精巢递减,表明INAD基因可能在雌雄同体的斜带石斑鱼性逆转过程发挥一定作用(图5).

图5 斜带石斑鱼INAD基因在卵巢、兼性性腺、精巢组织中的表达特异性
2.4 注射FSH或LH对斜带石斑鱼INAD基因在性腺中表达的影响
通过腹腔分别注射FSH和LH这两种激素后,FSH组的15 d和30 d后性腺中INAD基因的表达量均低于对照组,LH组15 d和30 d后性腺中INAD基因的表达量均高于对照组,但均没有发生显著变化,斜带石斑鱼中FSH和LH两种激素可能对INAD基因有影响,但可能没有直接的调控作用(图6).
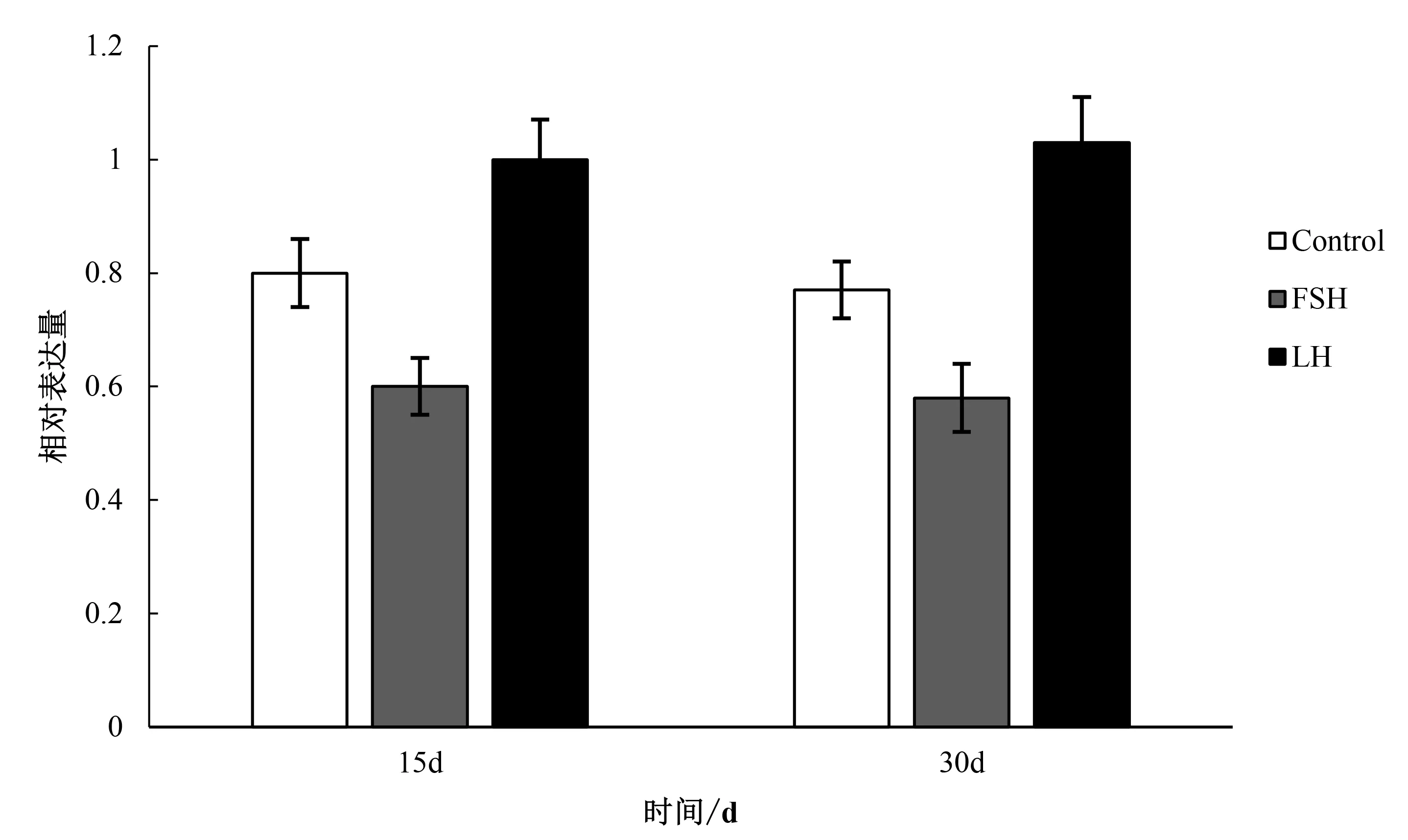
图6 斜带石斑鱼注射FSH和LH后INAD基因在性腺组织中的差异性表达
3 讨论
本研究克隆了斜带石斑鱼INAD基因,ORF框长度为5 337 bp,INAD基因翻译合成的是一种典型的支架蛋白,负责介导G蛋白偶联级联视觉信号通路,调控视觉信号的传导,通过软件预测其核心结构由多个PDZ结构域串联组成.含PDZ 结构域的蛋白多参与细胞内运输离子通道、受体,以及相关信号传导通路等多种生物学过程.最近的研究发现斜带石斑鱼性逆转不仅受到季节的影响[11],也有可能受到社群控制诱导[12],社群控制诱导中的重要影响因素是视觉信号的传导.两条雌性斜带石斑鱼在社会等级确立过程中会发生剧烈的打斗行为,在打斗过程中双方体色会发生暂时性的变化,同时该颜色模式的出现也会引起群体内其他个体的激烈反应,在参与打斗的鱼中,优胜者将会在几周的时间内发生性逆转,由雌性转变为雄性[13]231.在斜带石斑鱼社会等级确立的过程中发生打斗行为的雌鱼视网膜中光转导信号通路被激活,说明了视觉信号在社会等级确立及性逆转的过程中起到重要作用[13]232,[14-15].一些研究报道,含有PDZ结构域蛋白在脊椎动物的性别决定和分化及配子形成过程中发挥着一定的功能.小鼠含有PDZ结构域的SIP-1/NHERF2蛋白与SRY蛋白直接结合,在雄性决定过程中共定位于原支持细胞的细胞核中并可能发挥潜在的功能[16].还有研究报道,在黄鳍短须石首鱼(Seriolaquinqueradiata)中,对性别决定位点连锁的BAC进行测序和连锁分析,发现包含PDZ结构域的GIPC蛋白可能会参与该石首鱼的性别决定[17].
本研究通过腹腔分别注射FSH和LH这两种激素后,检测INAD基因在斜带石斑鱼性别的调控.FSH组的15 d和30 d后性腺中INAD基因的表达量均低于对照组,有研究发现,FSH在斜带石斑鱼由雌性性逆转为雄性和雄性转变成雌性过程中均发挥重要的作用[18],但FSH的作用似乎与其浓度相关,低剂量FSH注射激活雌性相关基因(例如cyp19a1a)的表达,高剂量下却抑制雌性相关基因的表达,激活雄性相关基因的表达,即诱导雄性命运[19].LH组15 d和30 d后性腺中INAD基因的表达量均高于对照组,LH的主要作用可能是调控雌雄配子的发生与成熟.它可以诱导性腺合成和分泌与性腺成熟相关的性类固醇激素,以促进卵母细胞和精子细胞的最后成熟以及排精排卵中起重要作用[20].可能由于注射的浓度及注射的持续时间长短的原因,FSH组和LH组与对照组相比INAD基因的表达量没有显著性差异.但从实验结果来看,在斜带石斑鱼中FSH和LH两种激素对INAD基因的表达是有一定的调控作用.
本研究克隆鉴定了斜带石斑鱼INAD基因,对其cDNA进行了序列分析和不同物种中的氨基酸序列同源性比对及进化关系分析.初步探究了斜带石斑鱼INAD基因的表达与性腺发育过程中的功能,为后续研究奠定基础.
