低分子肝素通过EGFR/PI3K/Akt信号通路对胚泡植入障碍小鼠子宫内膜容受性的影响
2020-11-06王春雪牛凯迪于月新
王春雪,牛凯迪,于月新∗
(1.锦州医科大学北部战区总医院研究生培养基地生殖医学中心,沈阳 110000;2.北部战区总医院生殖医学中心,沈阳 110000)
低分子肝素在生殖领域常用于复发性流产、反复植入失败等多种疾病的治疗。已有研究表明低分子肝素通过影响囊胚与子宫内膜表面的粘附、滋养层分化和浸润[1],对子宫内膜容受性产生调控作用,从而提高胚泡植入的成功率[2],但其具体机制仍不清楚。肝素结合性表皮生长因子(heparin binding epidermal growth factor,HB-EGF)是子宫内膜容受性的标志物之一,HBEGF与其受体表皮生长因子受体(epidermal growth factor receptor,EGFR)的相互作用是胚泡植入和滋养层浸润过程中母胎对话的重要因素。
EGFR/磷脂酰肌醇3-激酶(phosphoinositide 3-kinase,PI3K)/蛋白激酶B(Serine/threonine protein kinase,PKB也称Akt)(EGFR/PI3K/Akt)信号通路是体内一条极为重要的信号通路,在刺激细胞外生长因子与细胞生长、分化、增殖和血管生成等多种细胞过程之间发挥重要作用[3]。本研究旨在探讨低分子肝素对EGFR/PI3K/Akt信号通路的影响,探究其对子宫内膜容受性的作用机制。
1 材料与方法
1.1 材料
1.1.1 实验动物
8~10周龄SPF级C57BL/6雌性小鼠72只,体重(18±2)g,未交配过;雄性小鼠30只,体重(20±2)g,证明有生育能力,购于辽宁长生生物技术有限公司【SCXK(辽)2015-0001】,实验动物饲养于北部战区总医院医学动物实验室【SYXK(军)2015-020】,室温(23±2)℃,自然光照条件,自由摄食、饮水。福利伦理审查证号2019004,动物实验过程中遵循3R原则。
1.1.2 药物制备
吲哚美辛肠溶片,规格每片25 mg(临汾宝珠),取25 mL在研钵中研碎,溶于25 mL生理盐水,制成浓度为1 mg/mL的溶剂;注射用低分子量肝素钙,规格5000 IU/支(兆科药业),取1支溶于500 mL生理盐水制成10 IU/mL的溶液;阿司匹林肠溶片,规格每片100 mg(湖南新汇),取50 mg在研钵中研碎,溶于10 mL 0.5%羧甲基纤维素钠溶液中,制成浓度为10 mg/mL的溶液。
1.1.3 试剂和仪器
HBEGF抗体(Affinity);pEGFR抗体(Affinity);pPI3K抗体(Affinity);pAkt抗体(Affinity);DAB显色试剂(20×)(迈新);反转录试剂盒(近岸蛋白);荧光定量PCR试剂盒(近岸蛋白);SDS-PAGE凝胶快速制备试剂盒(美仑);飞克特超敏ECL液(美仑);垂直电泳槽(六一仪器);半干转电转印仪(六一仪器);紫外凝胶成像仪(美国Bio-Rad);普通PCR仪(ABI);Real-time PCR仪7300(ABI);光学显微镜CX40(OLYMPUS);PCR引物:生工生物工程股份有限公司,引物序列及其内参磷酸甘油醛脱氢酶(GAPDH)序列(见表1)。
1.2 方法
1.2.1 分组与建模
将72只C57BL/6小鼠随机分为6组,空白组、模型组、低分子肝素高剂量组、低分子肝素中剂量组、低分子肝素低剂量组、阿司匹林组,每组12只。
雌鼠每日阴道涂片观察动情周期变化,当阴道涂片有大量无核角化上皮细胞时即为发情期,将发情期的雌鼠于每日16:00与雄鼠合笼,雌雄比2∶1。次日检查合笼雌鼠的阴道,有阴道栓或引道涂片可见精子的小鼠视为妊娠第1天。除空白组外,其余各组用吲哚美辛建立胚泡植入障碍模型,于第2、3天的9:00和16:00皮下注射0.13 mL吲哚美辛溶剂,空白组皮下注入等量生理盐水。第1天开始每日15:00给药,连续5日。空白组和模型组皮下注射生理盐水0.3 mL,低分子肝素高剂量组200 IU/kg,中剂量组150 IU/kg,低剂量组100 IU/kg皮下注射药物,阿司匹林组100 mg/kg灌胃给药。第5天下午尾静脉注射1%台盼蓝0.2 mL,10 min后颈椎脱臼法处死孕鼠,取出子宫,计数小鼠子宫植入位点数。PBS缓冲液冲洗子宫,将子宫分为两部分,一部分4%甲醛固定,用于免疫组化检测,另一部分液氮速冻后-80℃保存,用于Western Blot、Real-time PCR检测。
1.2.2 胚泡植入位点数
每组平均植入位点数=该组植入胚泡总数/该组妊娠小鼠数
1.2.3 RT-PCR法检测HB-EGF、EGFR、PI3K、Akt基因表达
TRIzol法提取总RNA;逆转录合成cDNA;荧光定量检测CT值,每个样品重复3次;2-△△Ct法计算基因表达量。
1.2.4 免疫组化法检测HB-EGF、EGFR、PI3K、Akt蛋白定位
切片、贴片;脱蜡、水化;封闭;一抗4℃过夜;二抗孵育;DAB显色;苏木素复染;脱水、透明;中性树脂封片。
1.2.5 Western Blot检测HB-EGF、EGFR、PI3K、Akt蛋白表达
蛋白提取;BCA蛋白定量;SDS-PAGE凝胶制备;上样电泳;半干法转膜;抗体杂交;印记膜发光;用Image-Pro Plus 6.0软件对目的条带进行灰度分析。
1.3 统计学分析
数据采用SPSS 21.0软件进行统计分析,计量资料采用均数±标准差(±s)表示。组间比较差异采用单因素方差分析(One-way ANOVA),两两比较采用LSD法,P<0.05为差异具有统计学意义。
2 结果
2.1 胚泡植入位点数
与空白组比较,模型组平均胚泡植入位点数降低(P<0.05),证明建模成功。与模型组比较,药物治疗组平均胚泡植入位点数均增高(P<0.05),治疗组间无显著性差异(P>0.05)(图1)。
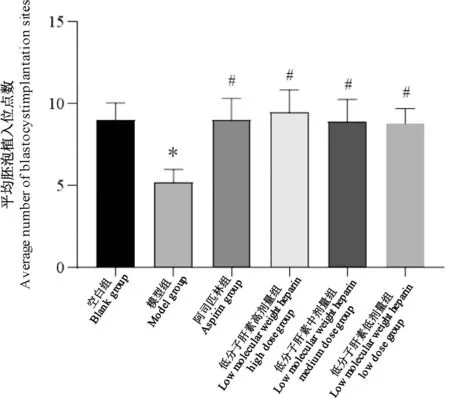
图1 各组小鼠妊娠第5天平均胚泡植入位点数Note.Compared with the blank group,∗P<0.05.Compared with the model group,#P<0.05.(The same in the following Figures)Figure 1 Average number of blastocyst implantation sites on the 5th day of pregnancy in each group of mice
2.2 HB-EGF的表达
2.2.1 HBEGF蛋白定位
HBEGF蛋白主要表达于子宫腔上皮、腺上皮及间质细胞。空白组在子宫腔上皮、腺上皮及间质细胞呈阳性表达;模型组在子宫腔上皮和腺上皮呈弱阳性,间质细胞呈阴性表达;药物组在子宫腔上皮、腺上皮及间质细胞均有表达,其中低分子肝素低剂量组表达呈弱阳性表达,低分子肝素中剂量组与阿司匹林组相呈阳性,低分子肝素高剂量组呈阳性或强阳性表达(图2)。
2.2.2 HBEGF蛋白表达
与空白组比较,除低分子肝素高剂量组外,模型组及其他药物治疗组HBEGF蛋白表达均显著降低(P<0.01);与模型组比较,低分子肝素各剂量组均显著增高(P<0.01),其中低分子肝素高剂量组最高(图3)。
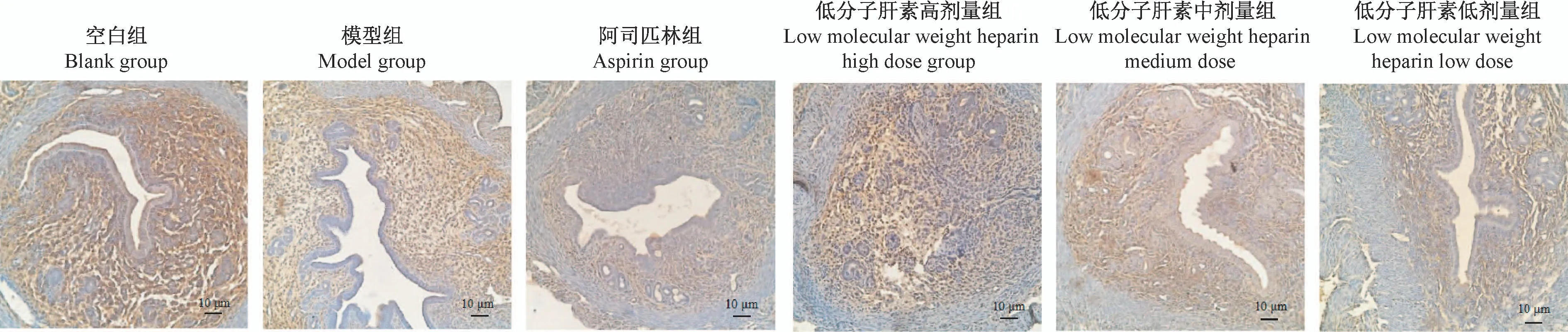
图2 小鼠子宫内膜HBEGF蛋白定位Figure 2 Location of HBEGF protein in mouse endometrium
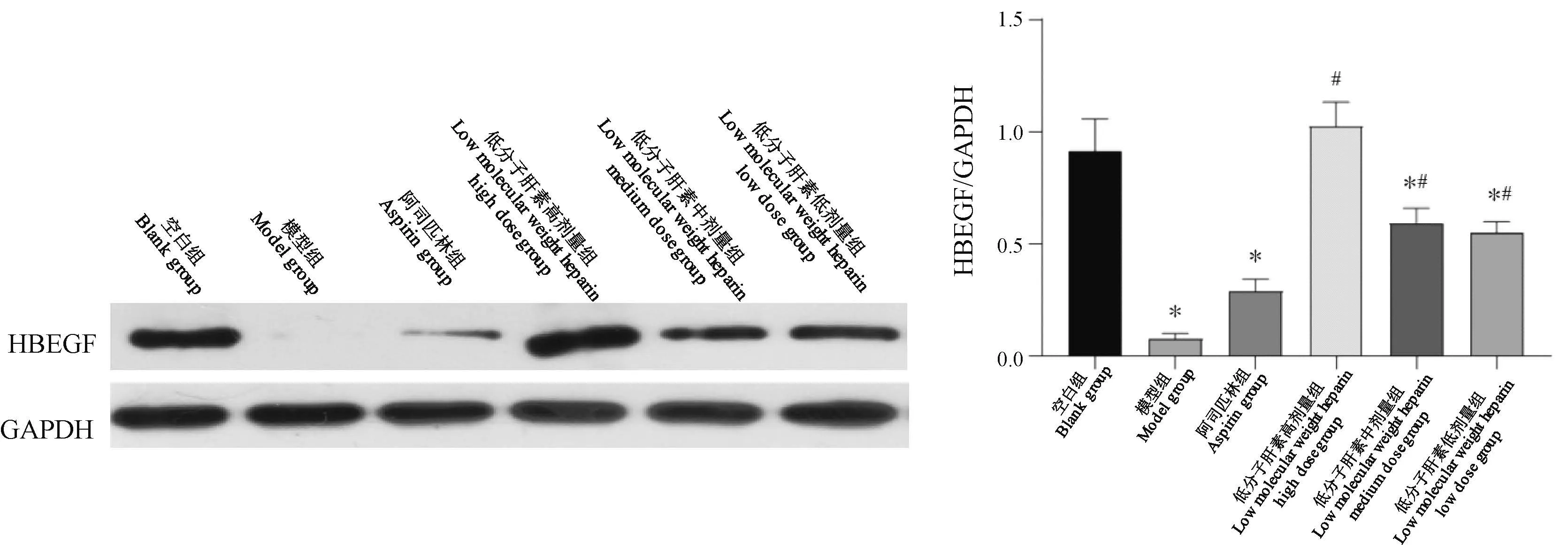
图3 小鼠子宫内膜HBEGF蛋白表达Figure 3 HBEGF protein expression in mouse endometrium
2.2.3 HBEGF mRNA表达
与空白组比较,模型组子宫内膜HBEGF mRNA表达量降低(P<0.05)。与模型组比较,低分子肝素高剂量组子宫内膜HBEGF mRNA表达量增高(P<0.05)(图4)。
2.3 EGFR表达
2.3.1 pEGFR蛋白定位
pEGFR蛋白主要表达于子宫腔上皮、腺上皮及间质细胞。空白组在子宫腔上皮、腺上皮及间质细胞呈阳性表达;模型组在子宫腔上皮、腺上皮呈阳性,间质细胞呈弱阳性表达;药物治疗组在子宫腔上皮、腺上皮及间质细胞均表达,其中低分子肝素低剂量组呈弱阳性,低分子肝素中剂量组与阿司匹林组呈阳性,低分子肝素高剂量组呈强阳性(图5)。
2.3.2 pEGFR蛋白表达
与空白组比较,低分子肝素高剂量组pEGFR蛋白表达增高(P<0.05),其余各组均降低(P<0.05);与模型组比较,药物治疗组pEGFR蛋白表达均增高(P<0.05)(图6)。
2.3.3 EGFR mRNA表达
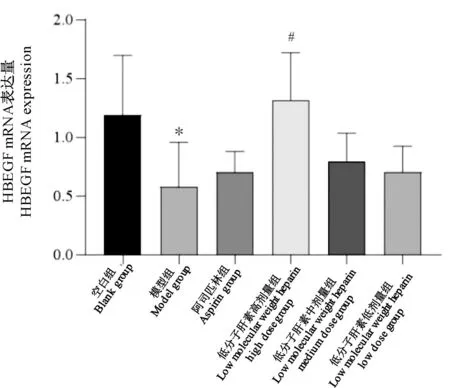
图4 HBEGF mRNA表达量Figure 4 HBEGF mRNA expression
与空白组比较,模型组子宫内膜EGFR mRNA表达量显著降低(P<0.05),其余各组无显著差异;与模型组比较,低分子肝素高剂量组子宫内膜EGFR mRNA表达量增高(P<0.05)(图7)。
2.4 PI3K表达
2.4.1 pPI3K蛋白定位
pPI3K蛋白主要表达于子宫内膜腔上皮、腺上皮以及血管上皮细胞。空白组在子宫腔上皮、血管上皮呈阳性表达,腺上皮呈弱阳性;模型组在子宫腔上皮、腺上皮及血管上皮细胞呈弱阳性或阴性表达;药物治疗组在子宫腔上皮、腺上皮以及血管上皮细胞与均呈阳性表达(图8)。
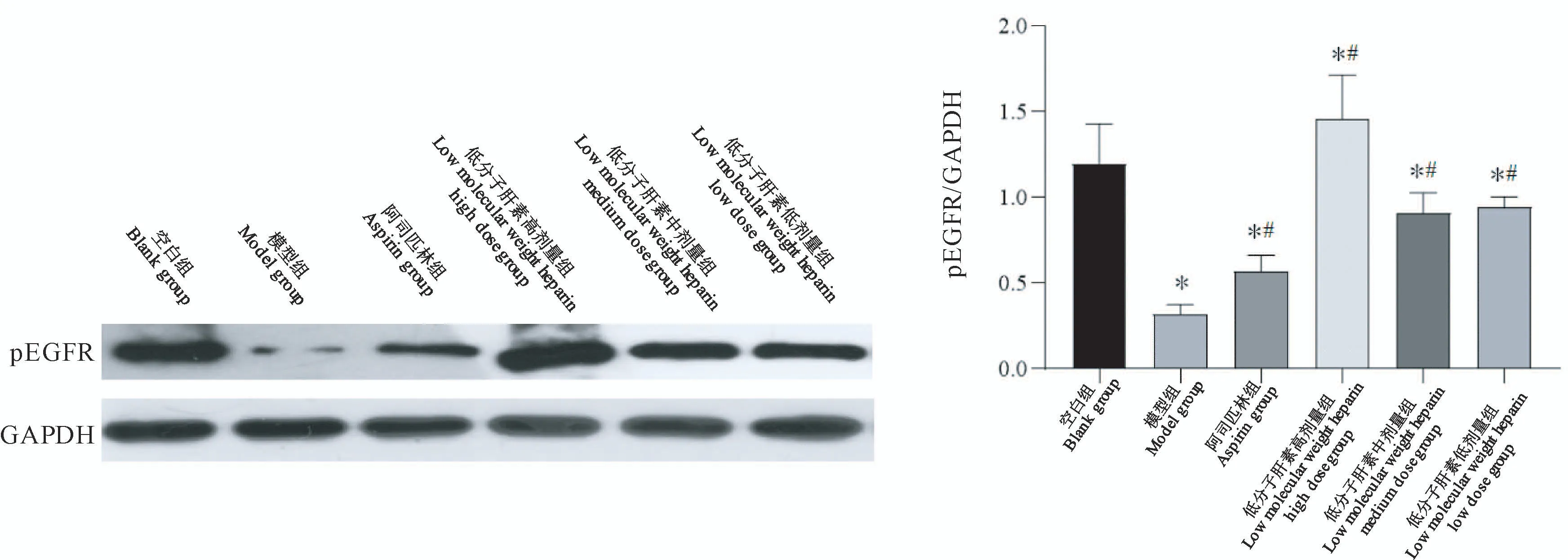
图6 小鼠子宫内膜pEGFR蛋白表达Figure 6 pEGFR protein expression in mouse endometrium
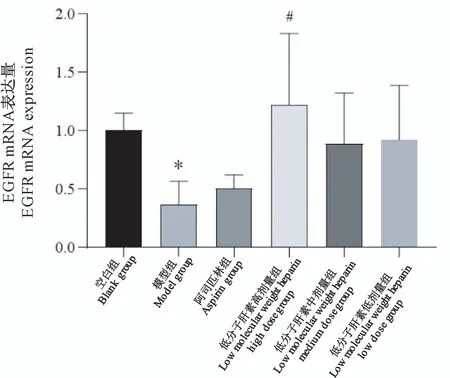
图7 小鼠子宫内膜EGFR mRNA表达量Figure 7 EGFR mRNA expression
2.4.2 pPI3K蛋白表达
与空白组比较,除低分子肝素高剂量外,其余各组pPI3K蛋白表达均降低(P<0.05);与模型组比较,药物治疗组pPI3K蛋白表达均增高(P<0.05)(图9)。
2.4.3 PI3K mRNA表达
与空白组比较,模型组及低分子肝素中、低剂量组子宫内膜PI3K mRNA表达量降低(P<0.05),低分子肝素高剂量组表达量增高(P<0.05);与模型组比较,低分子肝素高剂量组子宫内膜PI3K mRNA表达量增高(P<0.05)(图10)。
2.5 Akt表达
2.5.1 pAkt蛋白定位
pAkt蛋白主要表达于子宫腔上皮、血管上皮细胞。空白组在子宫腔上皮及血管上皮呈阳性表达;模型组在子宫腔上皮及血管上皮细胞呈弱阳性或阴性表达;药物治疗组在子宫腔上皮及血管上皮细胞均呈阳性表达(图11)。
2.5.2 pAkt蛋白表达
与空白组比较,模型组及阿司匹林组子宫内膜pAkt蛋白表达均显著降低(P<0.05),低分子肝素高剂量组显著增加(P<0.05);与模型组比较,药物治疗组pAkt蛋白表达均显著增高(P<0.05),其中低分子肝素高剂量组pAkt蛋白表达最高(图12)。

图8 小鼠子宫内膜pPI3K蛋白定位Figure 8 Location of pPI3K protein in mouse endometrium
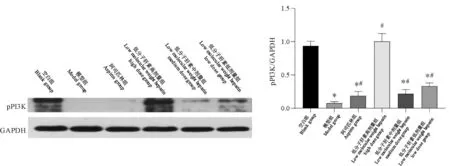
图9 小鼠子宫内膜pPI3K蛋白表达Figure 9 pPI3K protein expression in mouse endometrium
2.5.3 Akt mRNA表达
与空白组比较,模型组子宫内膜Akt mRNA表达量降低(P<0.05),低分子肝素高剂量组表达量增高(P<0.05);与模型组比较,低分子肝素高剂量组子宫内膜Akt mRNA表达量增高(P<0.05)(图13)。
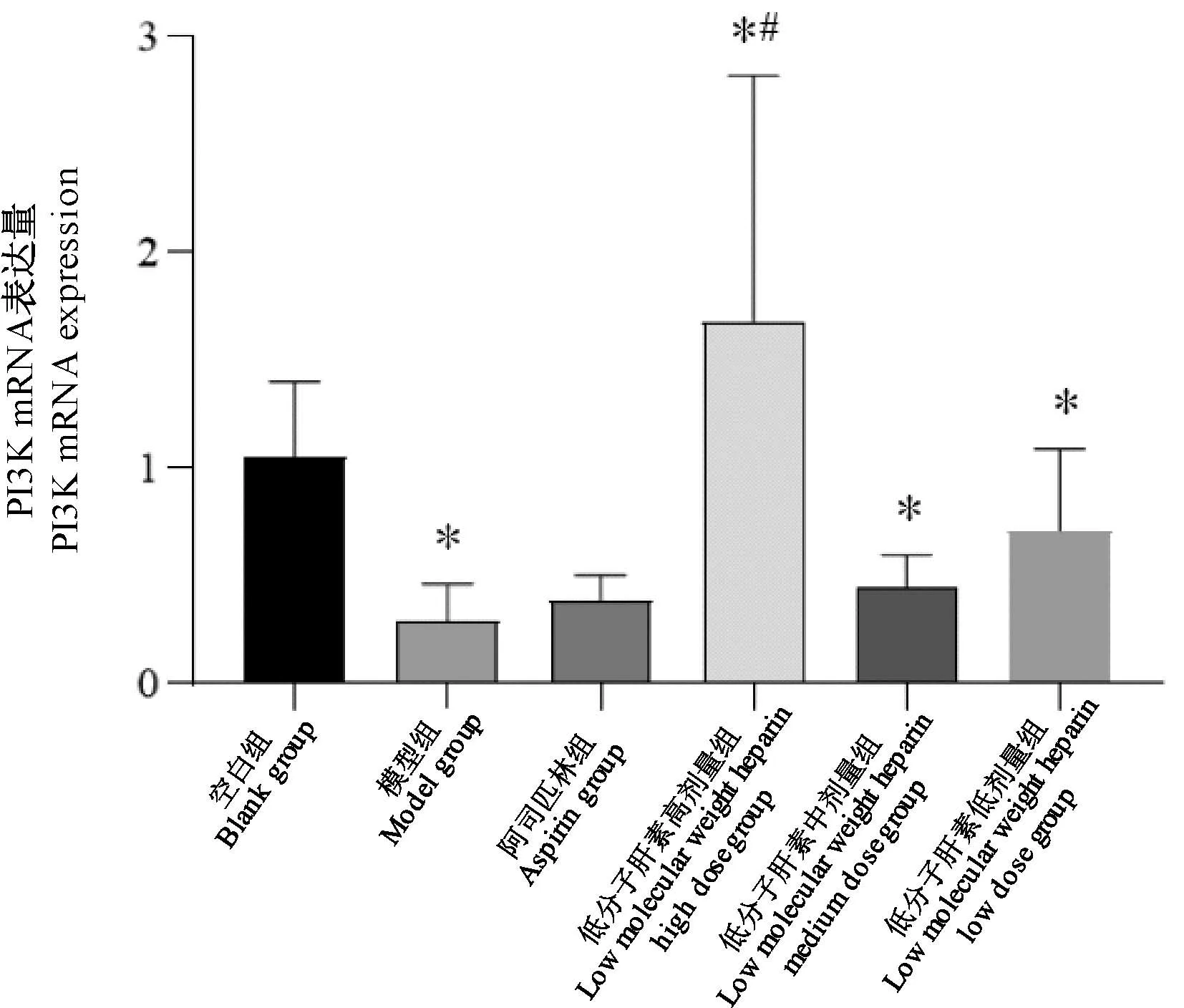
图10 PI3K mRNA表达量Figure 10 PI3K mRNA expression
3 讨论
3.1 动物模型的建立
为探讨低分子肝素对胚泡植入的影响,本研究使用吲哚美辛建立小鼠胚泡植入障碍模型。吲哚美辛是环氧化酶(cyclooxygenase,COX)抑制剂,可通过抑制COX的表达,使前列腺素(prostaglandin,PGs)合成减少,血管内皮生长因子(vascular endothelial growth facto,VEGF)的表达降低,使子宫内膜血管生成减少,从而抑制子宫内膜容受性[4]。有研究表明,小鼠妊娠第4天发育正常的胚泡可移行至子宫腔,第4.5天植入子宫内膜[5],因此于妊娠第3、4天9:00和16:00皮下注射吲哚美辛溶剂,可使小鼠子宫内膜的腺体、血管等均受到影响,且植入障碍程度与吲哚美辛呈剂量依赖性,当剂量为3 mg/kg时,胚泡植入率可降低77%,为建模最佳剂量[6-7]。
3.2 低分子肝素与子宫内膜容受性
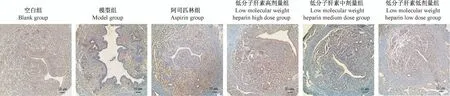
图11 小鼠子宫内膜pAkt蛋白定位Figure 11 Location of pAkt protein in mouse endometrium

图12 小鼠子宫内膜pAkt蛋白表达Figure 12 pAkt protein expression in mouse endometrium
低分子肝素相比于普通肝素具有更高的安全性,除抗凝作用外,还有抗炎和免疫调节作用。近年来,在临床上常用于治疗复发性流产(recurrent spontaneous abortion,RSA)和血栓性疾病相关的妊娠并发症[8],对RSA患者应用低分子肝素后可提高胚泡植入成功率[9]。有研究发现,低分子肝素可通过增加流向植入部位的血流量和减少血栓性病变来改善子宫内膜及胎盘的生物学功能[10-11]。
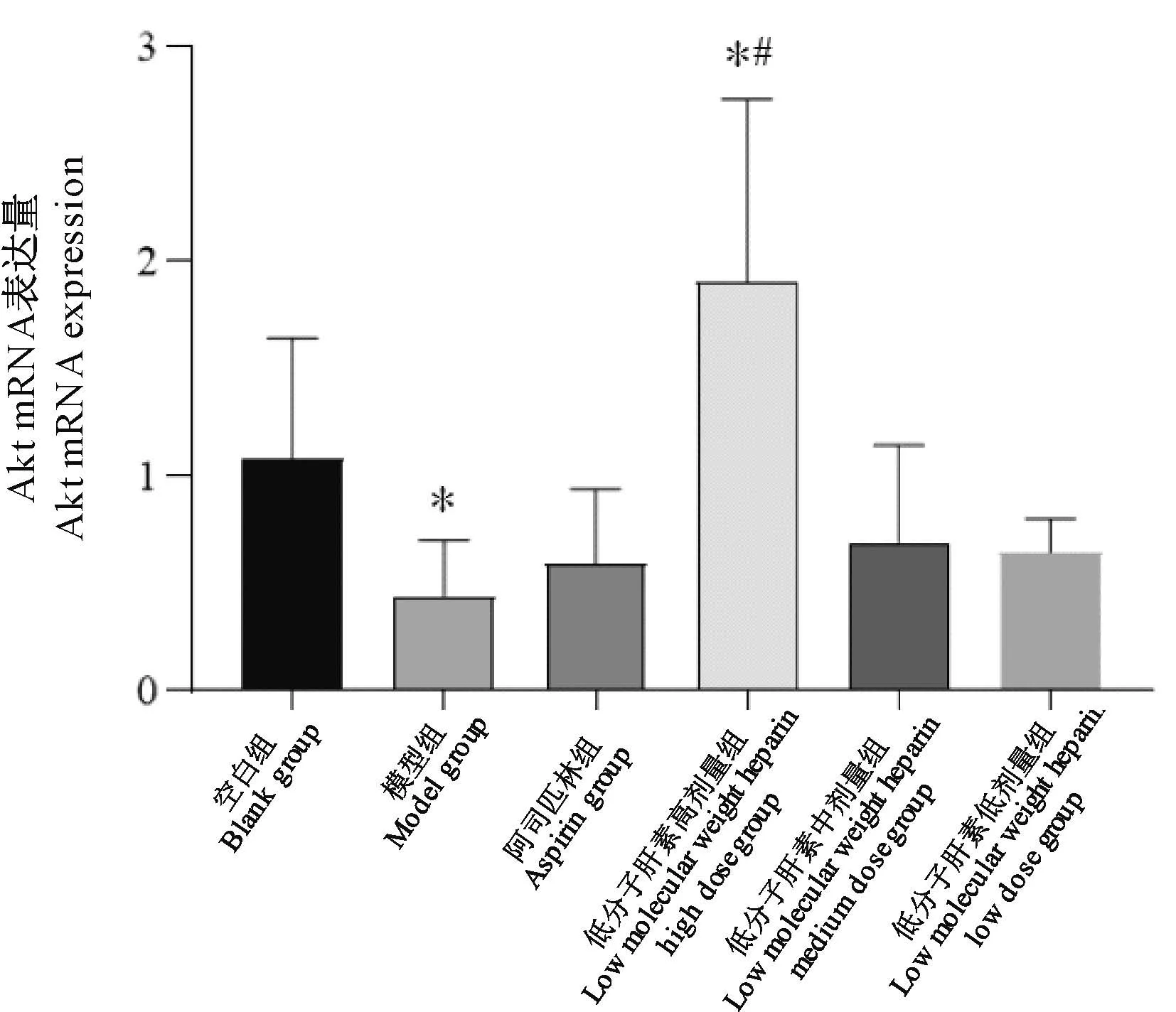
图13 Akt mRNA表达量Figure 13 Akt mRNA expression
HBEGF作为子宫内膜容受性的标志物,可促进胚泡植入部位的血管生成,维持胚泡的正常生长发育。HBEGF在整个月经周期中表达,在“窗口期”子宫腔上皮、腺上皮、间质细胞表面HBEGF蛋白及mRNA表达达最高[12-13]。HBEGF是EGF家族的一员,HBEGF在猪、大鼠、小鼠和人的子宫中均表达[14]。当HBEGF表达降低,胚泡植入部位血管生成减少,易出现胚泡发育缓慢甚至流产[15]。
3.3 低分子肝素激活EGFR/PI3K/Akt信号通路
HBEGF可表达为可溶性(solubility,sol)和跨膜(transmembrane,tm)两种生物活性[16],分别激活表皮生长因子受体(human epidermalgrowth factor receptor,HER)的两种受体EGFR(HER1)和erb4(HER4)[17],并将硫酸乙酰肝素结合到细胞表面[18]。EGFR可在蜕膜和滋养细胞中表达,与HBEGF相互作用可影响胚泡植入和滋养层浸润[19-20],提高胚泡的存活率[21]。
EGFR具有多种配体,如EGF,TGF-α,HBEGF和双调蛋白等[22]。EGFR通过二聚化后刺激Ras蛋白,导致磷酸化级联反应的发生激活PI3K[23],PI3K被活化后,使底物二磷酸磷脂酰肌醇(phosphatidylinositol-4,5-bisphosphate,PIP2)水解形成三磷酸肌醇(inositol-1,4,5-trisphosphate,IP3)和二酰甘油(diacylglycerol,DAG)。IP3是第二信使的一种,可参与信号传导,激活Akt使其磷酸化(pAkt)[24],pAkt可影响细胞增殖分化、血管生成[25]。所以,EGFR/PI3K/Akt信号通路在刺激细胞外生长因子及细胞增殖分化、血管生成等发挥重要作用。子宫内膜血管生成对胚泡植入具有重要意义,良好的子宫内膜血供可提高子宫内膜容受性,增加胚泡植入率。
本研究结果显示:(1)胚泡植入数量:与模型组相比较,低分子肝素组与阿司匹林组胚泡植入数量增加;(2)HBEGF的表达,低分子肝素组与阿司匹林组可增加HBEGF蛋白、mRNA表达,其中高剂量组增加尤为明显;(3)EGFR、PI3K、Akt mRNA表达:模型组子宫内膜EGFR、PI3K、Akt mRNA表达均低于空白组及药物治疗组,低分子肝素高剂量组EGFR、PI3K、Akt mRNA高于空白组水平,阿司匹林组与低分子肝素中、低剂量组表达相近;(4)EGFR、PI3K、Akt蛋白表达:模型组子宫内膜EGFR、PI3K、Akt蛋白表达均低于空白组及药物治疗组,低分子肝素高剂量组EGFR、PI3K、Akt蛋白表达均高于各组,低分子肝素中、低剂量组EGFR、PI3K、Akt蛋白表达高于阿司匹林组。低分子肝素高剂量平均胚泡植入数目高于空白组,虽无统计学差异,但该组HBEGF、EGFR、PI3K、Akt蛋白及mRNA表达均高于空白组,说明从基因到临床表现需要一定时间,同时药物起作用需要一定的起效剂量。
综上,低分子肝素可通过增加HBEGF的表达,激活EGFR/PI3K/Akt信号通路,对小鼠子宫内膜容受性产生调控作用,从而提高胚泡植入成功率。许多因素可影响子宫内膜容受性,低分子肝素是否与其他细胞因子的表达以及信号通路有关,还需进一步实验研究。
