p21在滋养细胞迁移和侵袭中的作用研究
2020-11-06王艳赵楠楠何艳舫董建新陈燕
王艳,赵楠楠,何艳舫,董建新,陈燕
(华北理工大学附属医院,唐山 063000)
绒毛外滋养细胞(extravillous trophoblast,EVT)侵入母体蜕膜对于胎盘植入和胎儿发育至关重要,该过程的失败与多种妊娠疾病有关,比如子痫前期(preeclampsia,PE)。PE的病理生理学与细胞功能障碍密切相关,包括细胞增殖失调、凋亡增加、分化缺陷、滋养层细胞侵入减弱以及氧化应激[1-2]。PE的全球患病率约为8%,是孕产妇和围产儿死亡的主要原因之一。尽管已对PE进行了数十年的研究,对其详细的病理生理和分子机制仍知之甚少。
细胞周期进程的平衡和控制需要通过不同的调控因子来确保。p21是周期素依赖性激酶(cyclin-dependent kinases,CDK)抑制剂,由CDKN1A基因编码。作为细胞周期调节因子的重要成员,p21在很多生理过程中都发挥了重要的作用,例如:参与细胞周期调控、包括有丝分裂、DNA修复、细胞凋亡、分化、细胞骨架动力学、细胞迁移、基因转录、诱导性多能干细胞的重新变成、衰老及衰老起始等[3]。在与癌症有关的多项研究中,p21被证实不仅能抑制癌症,还能作为原癌基因发挥致癌能力。然而,目前关于p21在胎盘学中的调节功能还研究的较少。有证据表明,在整个正常妊娠期内,p21基因都能在包括EVT在内的多种滋养细胞类型中表达,调控其增殖、分化和侵袭。因此,p21被认为是细胞周期停滞,衰老和凋亡的潜在标志物之一[4-5]。
本研究希望通过敲低滋养细胞HTR-8/SVneo中的p21,来探究p21对正常滋养细胞运动能力的影响及可能的机制。
1 材料与方法
1.1 材料
1.1.1 细胞
HTR-8/SVneo细胞与BeWo细胞由本院研究室提供。
1.1.2 试剂
靶向p21的siRNA(F:ACACCUCCUCAUGU ACAUA,R:UAUGUACAUGAGGAGGUGU;命名为sip21)、对照siRNA以及丝裂霉素C均购自Sigma-Aldrich公司;GAPDH(GTX627408,1∶1000)的抗体购自Genetex;p53(sc-126,1∶1000)的抗体购自Santa Cruz Biotechnology;p21(#2947,1∶1500)、ERK3(#4067,1∶1000)以及PARP(#9542,1∶1000)的抗体均购自Cell Signaling;CellTiter细胞活力检测试剂盒、总RNA提取试剂盒以及反转录试剂盒购自Promega公司;GAPDH、p21、ERK3、MMP2的反转录引物由生工生物工程股份有限公司合成;RPMI培养基、胎牛血清、青霉素、链霉素均购自生工生物工程股份有限公司。所用引物见表1。

表1 引物序列Table 1 Primer sequence
1.2 方法
1.2.1 细胞培养及siRNA转染
正常人绒毛膜滋养细胞HTR8/Svneo与人绒毛膜癌细胞BeWo分别接种于含5%胎牛血清(FBS)、100 U/mL青霉素和100μmol/L链霉素的RPMI-1640(标准生长培养基)中进行培养。融合前经胰蛋白酶消化,然后在5%CO2、37℃环境下连续传代培养。
用转染试剂Oligofectamine对10~20 nmol/L siRNA进行瞬时转染,转染采用电穿孔法(250 V,250μF,500Ω)。
1.2.2 细胞增殖、迁移和侵袭实验
细胞增殖实验:按照细胞活力检测试剂盒制造商的说明进行细胞增殖测定。细胞划痕实验:将HTR8/SVneo细胞以2.0×105个/孔的浓度接种在24孔板中并培养过夜。融合成单层状态时,用丝裂霉素C处理细胞,抑制增殖。划动移液枪尖端制造划痕,24 h后观察并用Image J分析划痕愈合情况。
Transwell小室侵袭实验:按照细胞侵袭检测试剂盒制造商的说明,进行细胞侵袭测定。简单说来,先将500μL无血清培养基添加到Transwell的上室中,再将HTR8/SVneo细胞以7.5×104个/孔的浓度接种到培养基中,并在下室中加入750μL无血清培养基。16 h后,去除下室中的培养基,添加含有10%胎牛血清的培养基,开始侵袭测定。24 h后,用甲醇固定侵袭的细胞,并用结晶紫染色。用显微镜对侵袭的细胞进行成像分析,并进行细胞计数。
1.2.3 实时荧光定量PCR(qPCR)
按照总RNA提取试剂盒制造商的说明提取总RNA,并按照反转录试剂盒制造商的说明对RNA进行反转录,使用ABI StepOnePlus Real-time PCR System进行实时荧光定量PCR。反应条件如下:
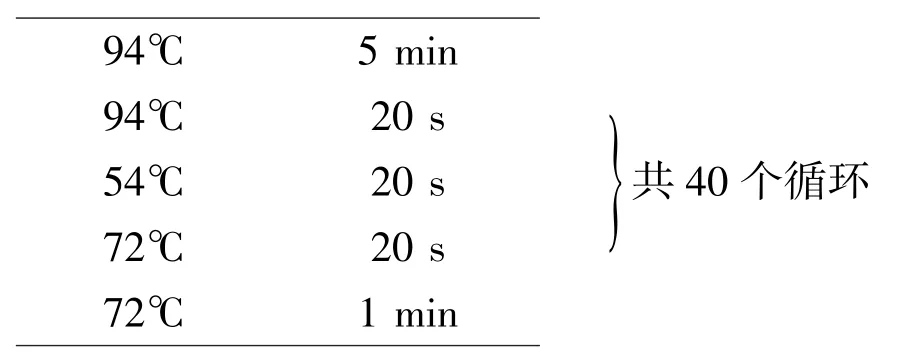
使用StepOne Software v2.2.2分析数据,通过2-ΔΔCt法计算基因相对表达量。
1.2.4 蛋白印记分析(Western Blot)
先使用RIPA缓冲液和蛋白酶抑制剂制备细胞裂解物,然后采用Bio-Rad法测量蛋白质浓度。用SDS-PAGE分离总蛋白并转移到聚偏二氟乙烯膜上,将膜用5%BSA在4℃下过夜封闭,与各一抗在室温下孵育1.5 h,用PBS将膜冲洗3次,然后与二抗在室温下孵育1 h,再用PBS冲洗3次。以GAPHD作为内参,使用化学发光检测试剂盒检测各蛋白表达。使用Image J对蛋白质印迹分析进行定量分析。
1.3 统计学分析
运用SPSS 20.0软件对实验数据进行统计分析。所有数据均以平均值±标准差(±s)表示,用Student’st检验进行组间差异比较。当P<0.05时,被认为差异具有统计学意义。
2 结果
2.1 p21和p53在滋养细胞中的表达
由图1所示,与人绒毛膜癌细胞株BeWo结果相反,在mRNA和蛋白质表达水平上,正常滋养细胞HTR8/SVneo细胞p53的表达水平较高,而p21表达则都较低(P<0.05)。说明滋养细胞p21及其主调控因子p53的表达在mRNA和蛋白质水平上相互对应,二者在正常滋养细胞与肿瘤细胞中表现出相反的表达水平。
2.2 细胞增殖
为了探究p21在滋养细胞增殖中的作用,用针对p21的siRNA(sip21)在HTR细胞中敲低了p21的表达,然后进行48 h的细胞活力分析。与对照siRNA(siCtrl)相比,用sip21处理的细胞在增殖上无显著差异(P>0.05,图2A)。PARP是细胞凋亡核心成员半胱天冬酶(caspase)的切割底物,可作为凋亡的标志此外。用免疫印迹分析检查了PARP及其裂解产物,结果在p21敲低的细胞与对照组细胞之间也未观察到显著差异(图2B)。这说明p21可能对正常滋养细胞的增殖和凋亡没有显著影响。
2.3 细胞迁移
为了探究p21对正常滋养细胞运动的影响,进行了细胞划痕实验来观察p21敲低后,滋养细胞迁移能力的变化。结果显示,与对照组相比,p21敲低后的滋养细胞迁移率显著降低(图3,P<0.05)。说明p21能影响正常滋养细胞的迁移能力。
2.4 细胞侵袭
通过Transwell小室侵袭实验,观察p21敲低后正常滋养细胞侵袭能力的变化。结果显示,与对照相比,p21敲低后的滋养细胞侵袭能力显著降低(图4,P<0.05),说明p21能影响正常滋养细胞的侵袭能力。
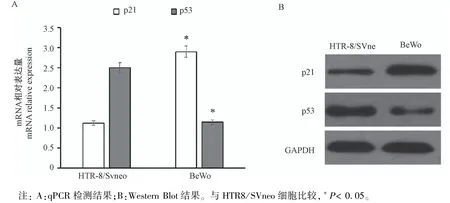
图1 正常滋养细胞HTR8/SVneo与人绒毛膜癌细胞BeWo中p21和p53的表达Note.A,Results of qPCR.B,Results of Western Blot.Compared with HTR8/SVneo,∗P<0.05.Figure 1 Expression of p21 and p53 in HTR8/SVneo and BeWo cells
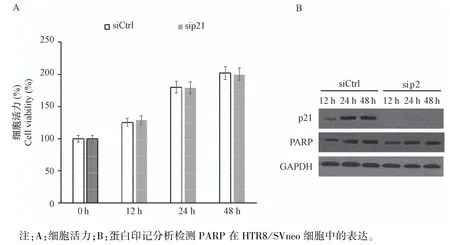
图2 HTR8/SVneo细胞增殖及凋亡Note.A,Cell viability.B,Expression of PARP in HTR8/SVneo by Western Blot.Figure 2 Proliferation and apoptosis of HTR8/SVneo
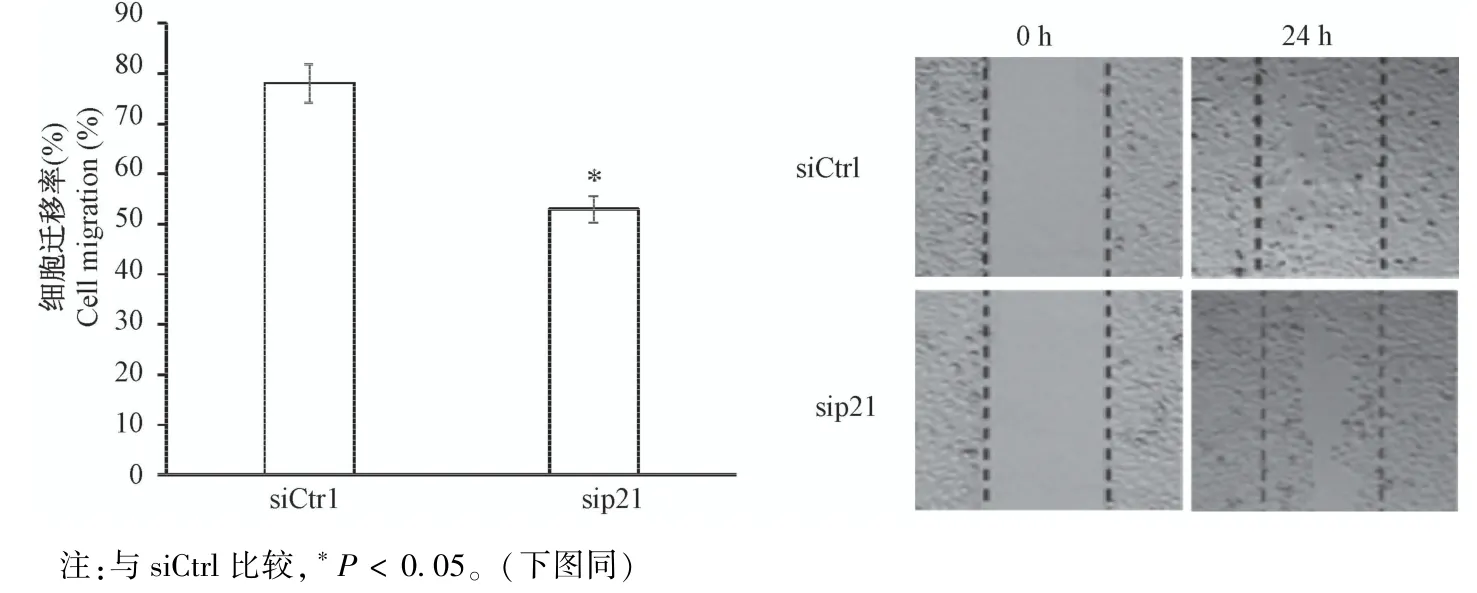
图3 HTR8/SVneo细胞迁移能力变化Note.Compared with siCtrl,∗P<0.05.(The same in the following figures)Figure 3 Change of HTR8/SVneo cell migration
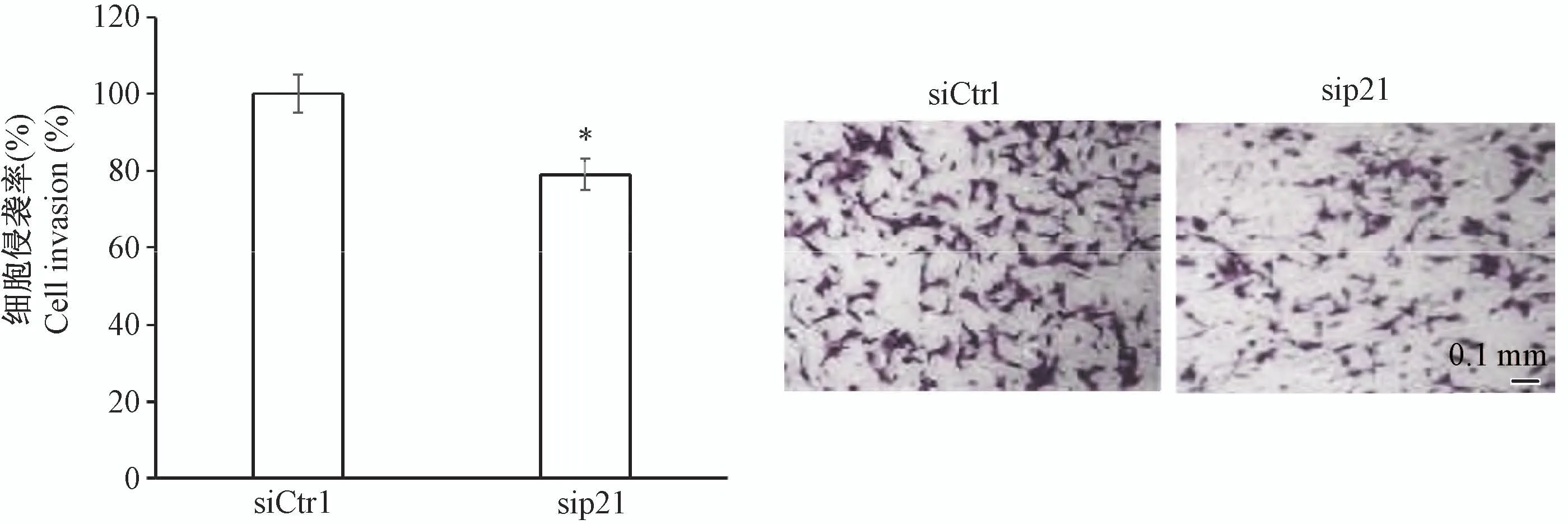
图4 HTR8/SVneo细胞侵袭能力变化Figure 4 Change of HTR8/SVneo cell invasion
2.5 ERK3的表达水平
ERK3是有丝分裂原激活的蛋白激酶(MAPK)超家族的远亲成员,参与细胞的分化和迁移。为了探究p21影响滋养细胞运动能力的可能机制,分别检测了p21敲低后ERK3在mRNA和蛋白质水平上的变化。结果表明,与对照组比较,在p21敲低的滋养细胞中,ERK3的mRNA和蛋白质表达水平均显著降低(图5,P<0.05)。说明p21可能通过调控ERK3相关信号路径来影响滋养细胞的运动能力。
2.6 MMP2 mRNA的表达水平
基质金属蛋白酶能够降解细胞外基质(ECM),因此滋养细胞的侵袭与基质金属蛋白酶(MMP)的表达密切相关。其中,MMP2被认为是在滋养层细胞侵袭过程中的关键酶,且受ERK3表达的影响。通过qPCR和Western Blot检测了p21敲低后MMP2在mRNA和蛋白质水平的变化。结果显示,与对照组比较,MMP2的mRNA和蛋白质表达水平均显著降低(图6,P<0.05)。该结果进一步证实了p21可能通过调控ERK3/MMP2信号路径来影响滋养细胞的运动能力。
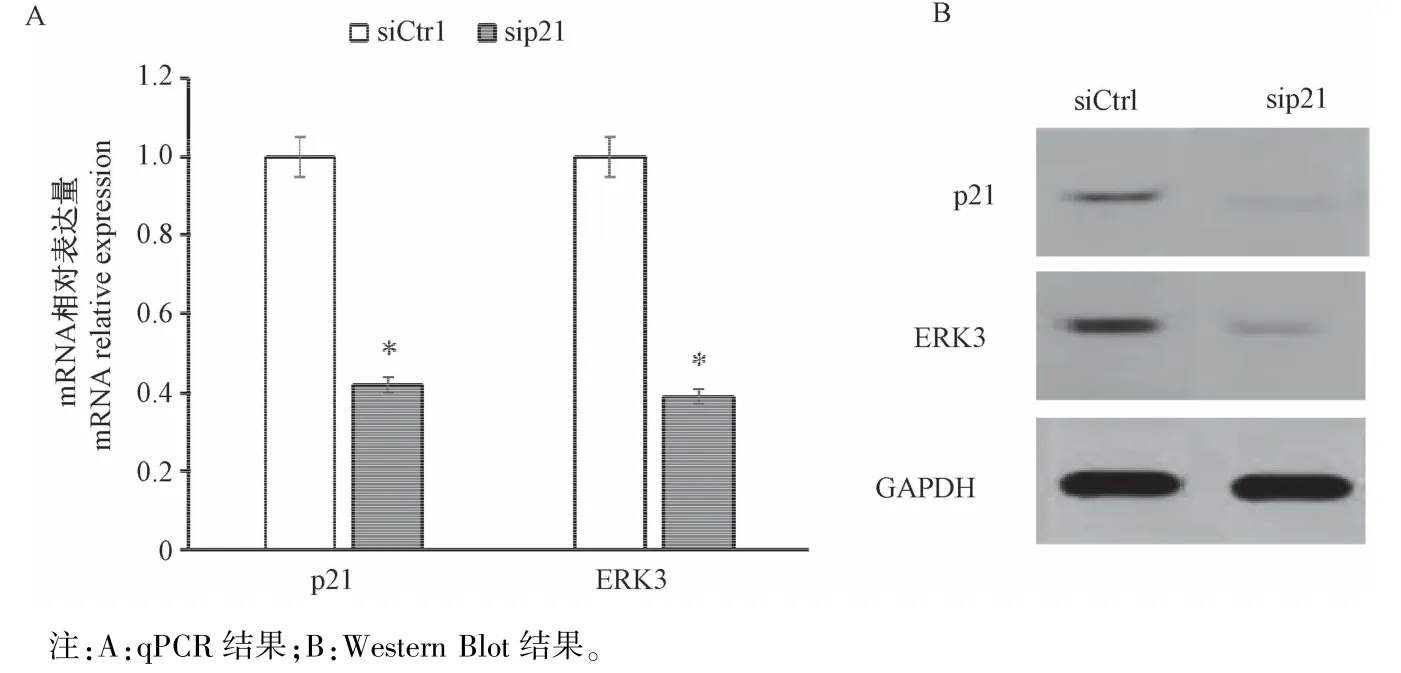
图5 p21和ERK3在mRNA和蛋白质上平上的的表达Note.A,Results of qPCR.B,Results of Western Blot.Figure 5 Expression of p21 and ERK3 at mRNA and protein levels
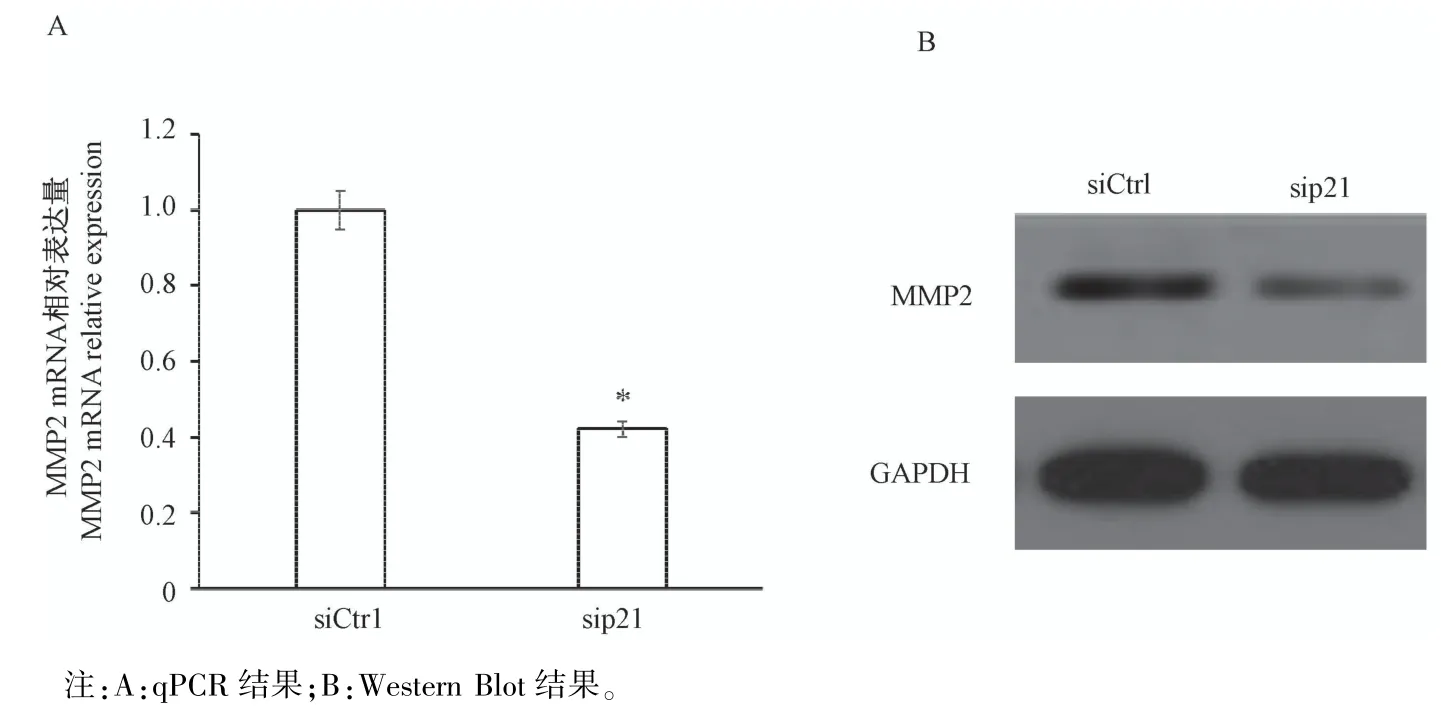
图6 MMP2在mRNA和蛋白质上平上的的表达Note.A,Results of qPCR.B,Results of Western Blot.Figure 6 Expression of MMP2 at mRNA and protein levels
3 讨论
p21在细胞运动中的作用是多方面的,取决于不同的细胞环境。核p21能作为转录因子/辅因子,在转化生长因子β(TGF-β)介导的乳腺癌细胞的迁移和侵袭有必不可少的作用,当其基因被沉默后,虽然对细胞生长和增殖没有显著影响,但能抑制乳腺脂肪垫异种移植小鼠和其他多种乳腺癌细胞的侵袭。Dai等[6]指出p21的高表达与促进癌细胞的迁移/侵袭进而降低乳腺癌患者的存活率有关。Qian等[7]关于肿瘤小鼠模型的研究则发现,肿瘤的侵袭伴随着p21的上调,而p21基因敲除的小鼠,其肿瘤转移受到明显的抑制,当p21重新表达后,该抑制现象被逆转。细胞质p21被发现能通过抑制Rho/ROCK/LIM途径来促进小鼠胚胎成纤维细胞的运动能力[8]。也有报道指出,细胞质p21和p53的复合物能通过诱导细胞凋亡来抑制侵袭[9]。同时,滋养细胞必须在侵袭过程发生之前就结束细胞周期,包括p21的激活[10]。
本研究的结果显示,p21的敲低造成了正常滋养细胞迁移能力和侵袭能力的减弱,但对细胞增殖或凋亡诱导则无影响。与对照相比,p21敲低的滋养细胞迁移率显著降低,仅为53%(P<0.05),而侵袭细胞的数量则比对照减少了21%(P<0.05)。此外,在p21敲低的滋养细胞中,EKR3不论在mRNA水平还是蛋白质水平上的表达都显著降低,这提示了滋养细胞运动能力和侵袭能力的减弱可能在一定程度上是由减少ERK3的表达来介导的。ERK3在细胞增殖,细胞周期进程和分化中都发挥了作用。ERK3可以激活其第一个被鉴定的底物PRAK,从而影响肌动蛋白的重塑和细胞迁移[11]。与p21一样,ERK3也是细胞有丝分裂过程中Cdk1的底物,其磷酸化受到Cdk1的调节[12]。ERK3促进癌细胞的迁移/侵袭和肿瘤的转移,其表达在乳腺癌、肺癌、头颈癌等多种癌症中受到上调[13]。除ERK3外,p21的敲低还与MMP2表达减少有关。ERK3通过激活癌蛋白SRC3的磷酸化,引起包括MMP2在内的不同MMP基因的上调,从而在体外和体内刺激肺癌细胞的侵袭。敲低ERK3则能够抑制肺癌细胞的侵袭[14]。本研究的结果证实,敲低p21后MMP2在mRNA和蛋白质水平上也都表现出显著的降低,进一步证实了p21可能通过调控ERK3/MMP2信号路径来影响滋养细胞的运动能力。但到目前为止,关于ERK3与p21间的直接相关性的研究还十分缺乏。
综上所述,本研究的结果表明p21与正常滋养细胞的运动有关,p21缺乏会减弱滋养细胞的迁移能力和侵袭能力。此外,p21缺乏还会降低ERK3和MMP2的表达。但与二者间的联系到底是直接的还是间接的,目前还尚未可知,有待进一步的研究。
