小鼠经骨髓注射肺转移和术后复发模型的建立
2020-11-06焦肖宁侯怡飞朱杨壮壮苏琳张飞陈晓朱诗国韦璐瑶王万涛王杰朱娴丹邹纯朴胥孜杭
焦肖宁,侯怡飞,朱杨壮壮,苏琳,张飞,陈晓,朱诗国,韦璐瑶王万涛,王杰,朱娴丹,邹纯朴∗,胥孜杭∗
(1.上海中医药大学基础医学院,上海 201203;2.上海交通大学医学院附属新华医院,上海 200092;3.上海中医药大学科技实验中心,上海201203)
恶性肿瘤是对人类健康最具威胁性的疾病之一,全球最新癌症报告显示:2018年全球恶性肿瘤新发病例约1810万例,死亡约960万例。其中乳腺癌是女性发病率最高的恶性肿瘤,这与国家癌症中心最新出炉的癌症统计数据相一致[1-2]。恶性肿瘤转移是造成乳腺癌等恶性肿瘤患者死亡的主要原因,尽管手术治疗在一定程度上可以延长患者生存期,但术后肿瘤复发往往会加快疾病进程[3]。在众多器官中,肺是血液循环的关键,其具有丰富的血管,因此肺常常是肿瘤转移的靶器官[4]。目前针对肿瘤肺转移的有效治疗仍以化疗为主,但化疗的副作用降低了患者的生存质量。因而,建立理想的肺转移模型是研究恶性肿瘤肺转移机制的关键之一。
乳垫注射、皮下注射和尾静脉注射等是常见的动物肺转移模型构建方法,其中尾静脉注射具有实验周期短和转移效率高的特点,因而是建立恶性肿瘤肺转移最常用的模型[5]。有学者提出在骨髓微环境中,肿瘤细胞可以加快毛细血管的增加和原发肿瘤的增长,其衍生的相关免疫细胞如髓源抑制细胞等可以促进肿瘤向远端器官的转移[6]。骨髓注射法是将肿瘤细胞注射到骨髓腔的一种模型建立方法,其还原了肿瘤转移的多个步骤,如原发肿瘤形成、毛细血管的新生、肿瘤细胞入侵、血流播散和黏附生长等[7-8],更为接近人类肿瘤转移的过程。目前构建术后复发的小鼠模型,多使用皮下注射法和乳垫注射法[9-10]。尽管有相关研究表明骨髓注射法具有高转移效率和较高临床价值,但国内外研究尚少,其使用频率仍较低[11]。故本研究通过比较多种肺转移模型建立,以此为肿瘤转移和治疗提供新的研究基础。
1 材料与方法
1.1 材料
1.1.1 细胞株乳腺癌4T1细胞购自中国科学院细胞库,细胞编号SCSP-5056,稳定传至4~5代。
1.1.2 实验动物
5~6周龄65只SPF级雌性BALB/c小鼠,体重18~20 g,购自北京维通利华实验动物技术有限责任公司上海分公司【SCXK(沪)2017-0011】,饲养于北京维通利华实验动物技术有限责任公司上海分公司【SYXK(沪)2017-0014】。动物饲养在SPF级屏障环境内,屏障内温度为20~26℃,相对湿度为50%~70%,12 h昼夜交替。动物饲养期间,给予齿类动物标准饲料,自由饮水。动物实验开展已获上海中医药大学伦理委员会的同意,伦理编号为PZSHUTCM191129002。
1.1.3 试剂
DMEM培养基,10%胎牛血清,青霉素-链霉素,含0.25%EDTA的胰蛋白酶(Thermo Fisher Scientific公司,批号分别为11995065,10091148,15140122,25200072);Luciferase底物(德国Perkin Elmer公司,K9929PE);4%多聚甲醛(上海翊圣生物科技有限公司,批号36314ES76);罗红霉素(广东恒健制药有限公司,批号80214-83-1)。
1.1.4 仪器
Leica DMi1型显微镜(德国Leica公司),Lumina XR型Caliper精诺真生物发光/荧光活体分子成像系统(IVIS Lumina XR Imaging System,德国PerkinElmer公司),JY2002型电子天平(上海精密科学仪器有限公司)。
1.2 方法
1.2.1 表达Luciferase荧光素酶4T1细胞构建
细胞构建所用慢病毒为GM-2439LV18-CMVluc-PGK-Puro,慢病毒滴度为1E8 TU/mL,该病毒购自吉满生物科技(上海)有限公司,根据制造商说明进行操作。使用10%胎牛血清和1%青链霉素的DMEM培养液培养4T1细胞,病毒感染前将细胞接种于35 mm培养皿中,当细胞融合度达到80%时开始进行感染,感染48 h后加入10μg/mL的嘌呤霉素进行抗性克隆筛选,挑选表达Luciferase阳性细胞,然后用10μg/mL的嘌呤霉素进行维持。
1.2.2 乳垫注射转移模型的建立
将4T1细胞培养于含有1%青霉素-链霉素和10%胎牛血清的DMEM培养液中,置于5%CO2、37℃细胞培养箱内培养至细胞对数生长期,用含0.25%EDTA的胰蛋白酶消化贴壁细胞5 min,使用PBS重悬后并计数,调整至每只小鼠注射浓度为5×105/100μL。将细胞悬液吸入预冷的1 mL注射器。将小鼠麻醉,切开右侧胸壁1 cm,暴露第4对乳垫后缓慢向内注射肿瘤细胞悬液[12]。
1.2.3 皮下注射转移模型的建立
细胞培养、计数、浓度同上所述,小鼠麻醉后俯卧位,定位背侧肩胛骨,将肿瘤细胞悬液缓慢注射入小鼠背侧肩胛骨间[13]。
1.2.4 骨髓注射肺转移模型的建立
细胞培养、计数同上,4T1细胞浓度为每只小鼠注射5×105/50μL、3×105/50μL、1×105/50μL。小鼠麻醉后仰卧位暴露胫骨结节,定位小鼠胫骨结节,用胰岛素注射器穿刺进入骨髓腔内,抽吸出少量髓液以降低骨髓腔压力,用胰岛素注射器缓慢注入细胞悬液,缓慢出针以防悬液溢出。用干棉球擦去胫骨外的肿瘤细胞以避免出现假阳性结果[14]。
1.2.5 尾静脉注射转移模型的建立
细胞培养、计数同上所述,调整4T1细胞浓度为每只小鼠5×105/100μL。小鼠麻醉后,定位尾端静脉,将肿瘤细胞悬液通过尾静脉直接注射到小鼠体内[15]。
1.2.6 术后复发模型的建立
细胞培养、计数同上所述,调整4T1-luc细胞浓度为每只小鼠1×105/50μL。小鼠麻醉后,暴露股动脉,并对其进行结扎。使用手术剪刀在膝关节上方进行截肢,随后使用无菌可吸收缝合线逐层缝合,并在手术处涂抹罗红霉素软膏[11]。
1.2.7 模型小鼠分组与手术
造模后将所有小鼠根据造模方法分为4组,分别为乳垫注射组(mammary fat pad,mfp)、皮下注射组(subcutaneous,sc)、尾静脉注射组(intravenous,iv)和骨髓注射组(intraosseous,io)。骨髓注射组小鼠随机均分为4小组,3个小组分别在造模后第3、7、10天进行手术截肢,切除原发病灶。1个小组不进行手术即假手术,保留原发病灶。
1.2.8 活体成像监测小鼠肿瘤转移
经骨髓注射模型小鼠造模后第7天采用小动物活体成像仪进行活体成像,以观测肿瘤转移,每周1次,共4次。向小鼠腹腔注射Luciferase底物,浓度为15 g/L,剂量为每只150μL,注射底物5 min后予以异氟烷吸入麻醉,放入成像机箱以观察小鼠肿瘤转移。造模第28天,小鼠腹腔注射底物5 min后给予小鼠安乐死,取出肺,立即放入成像机箱以观察肺部转移情况。
1.2.9 病理切片染色
骨髓注射转移模型建立后第28天,给予小鼠安乐死,取小鼠原发肿瘤和肺部组织用多聚甲醛固定液固定进行HE染色。
1.3 统计学分析
所有统计均在Graphpad Prism 5.0中完成,所有数据均使用平均值±标准差(±s)表示,P<0.05为差异具有统计学意义。
2 结果
2.1 骨髓注射法成功建立肺转移模型
小鼠经骨髓注射4T1细胞(图1A),小鼠在接种后第5天出现原发肿瘤,可以观察到小鼠逐渐出现精神萎靡、毛发黯淡和体温偏低等肿瘤恶病质表现。造模第28天给予小鼠安乐死,取小鼠原发肿瘤和肺部组织拍照观察发现小鼠胫骨相应位置和肺部均有明显白色结节,且质地坚硬(图1B、1C)。剥离小鼠原发肿瘤,取出肺,HE染色后,镜下观察可见原发灶和肺部有毛线团样致密的肿瘤组织病灶,如图箭头所指(图1D、1E)。以上结果从解剖学和组织学角度均证实肉眼所见的小鼠肺部结节正是肺部转移肿瘤,表明经骨髓注射成功构建肺转移模型。
2.2 骨髓注射法与其他肿瘤接种方法相比,对原发肿瘤没有影响,但生存期显著缩短
由于尾静脉注射不存在原发病灶,因而使用乳垫注射法(mfp)、皮下注射法(sc)、骨髓注射法(io)向小鼠体内注射5×105个4T1细胞构建肺转移模型。造模第28天给予小鼠安乐死,剥离小鼠原发肿瘤,以观察肿瘤大小(图2A)。结果显示,骨髓注射法与其他注射法相比,对原发肿瘤的生长没有影响(图2B)。但io模型组的小鼠在接种相同细胞数量的情况下,生存期更短(n=5,图2C)(P<0.05);除此之外,io组小鼠较其他模型组小鼠较早出现精神萎靡和体温偏低等肿瘤恶病质表现,且较其他模型组小鼠症状更为严重。提示可能是骨髓注射法对肿瘤的转移产生了促进作用,加重了模型小鼠恶病质表现,缩短了模型小鼠的生存期。

图1 小鼠经骨髓注射肺转移模型的构建Figure 1 Construction of lung metastasis model of mice injected with bone marrow
2.3 骨髓注射法相较于其他接种方式肺转移效率最高
分别使用乳垫注射(mfp)、皮下注射(sc)、尾静脉注射(iv)和骨髓注射(io)向小鼠体内注射5×105个4T1细胞以构建小鼠肺转移模型,并于肿瘤细胞接种后的第28天,给予4个模型组小鼠安乐死处理,分别取其肺部组织拍照观察(图3A),并统计小鼠肺部肿瘤结节数量。结果显示,与mfp组、sc组和iv组相比,io组肺部肿瘤结节数量最多(n=6,图3B)。以上结果说明骨髓注射法相较于其他模型组肺转移效率最高。
2.4 骨髓注射法仅需1×105个细胞数量即可在第12天发生肺转移
使用骨髓注射法向小鼠体内注射5×105、3×105和1×105个4T1细胞,并于肿瘤细胞接种后第28天,给与小鼠安乐死处理,分别取其肺部组织进行HE染色。在注射1×105个细胞数量的情况下,经骨髓注射的模型小鼠同样发生肺转移,且在第12天小鼠肺部即出现少量散在的转移肿瘤。而乳垫注射和皮下注射的模型小鼠,使用3×105和1×105细胞数量时,直至第28天都未出现肺转移。尾静脉注射的模型小鼠,使用1×105细胞数量时,直至第20天,肺部才出现转移。以上结果说明经骨髓注射的荷瘤小鼠发生肺转移所需的细胞数量最少,且发生肺转移时间最早。(图4)

图2 不同注射方法对原发肿瘤生长和小鼠生存期的影响Note.Compared with io group,∗P<0.05.Figure 2 Effects of different injection methods on primary tumor growth and mouse survival
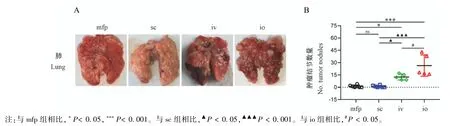
图3 不同注射方法的肺部转移情况Note.Compared with mfp group,∗P<0.05,∗∗∗P<0.001.Compared with sc group,▲P<0.05,▲▲▲P<0.001.Compared with iv group,#P<0.05Figure 3 Lung metastasis by different injection methods
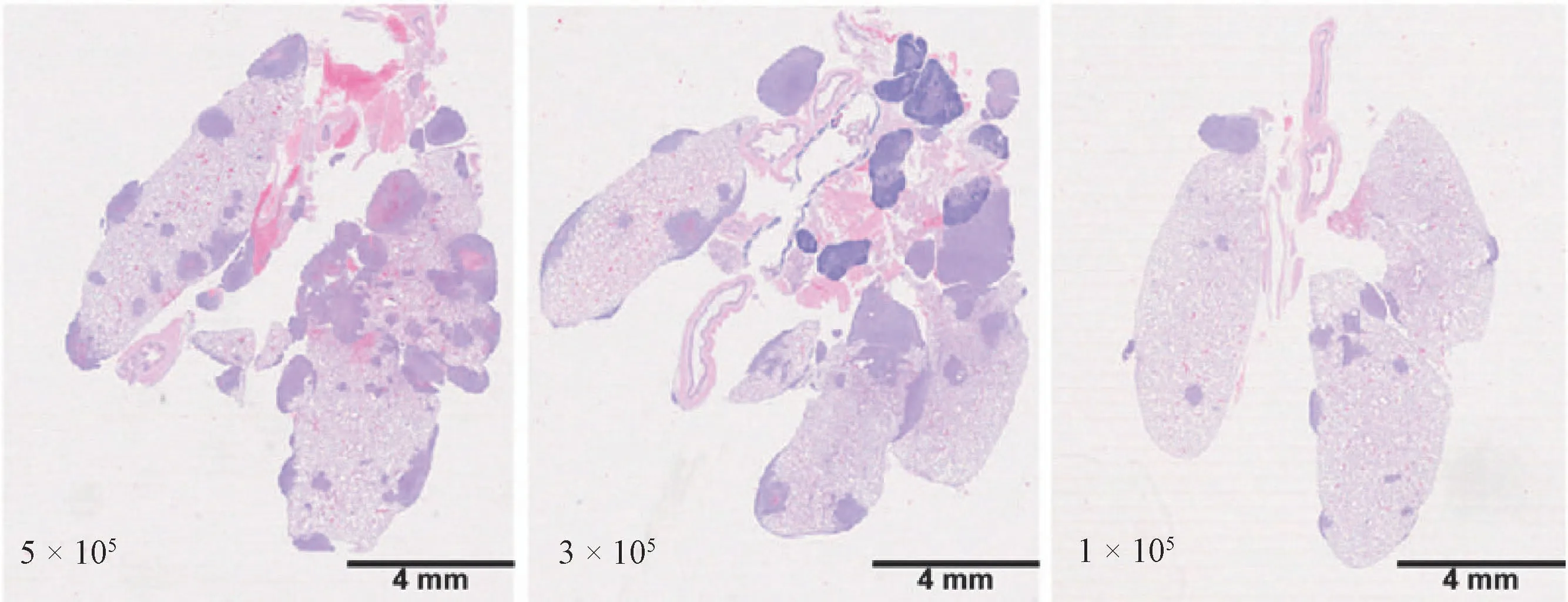
图4 经骨髓注射不同细胞数量肺部转移情况Figure 4 Lung metastasis after injection of different cell numbers through bone marrow
2.5 使用骨髓注射法成功建立术后复发模型
经骨髓接种1×105个4T1-luc细胞,将小鼠随机分为假截肢组、第3天截肢组、第7天截肢组和第10天截肢组。造模后第7天使用活体成像技术监测小鼠转移性肿瘤的发展,每周1次,共4次(图5A)。结果显示,第3天截肢组在原发肿瘤切除后,原发灶和肺部均没有荧光信号;假截肢组和第7天截肢组在造模后第21天肺部均出现荧光信号,原发灶未出现荧光信号;第10天截肢组在造模后第14天原发灶和肺部均有荧光信号(图5B);在第18天,第10天截肢组小鼠出现死亡。假截肢组和第7天截肢组模型小鼠,造模后第28天给予安乐死,取出肺进行成像。实验结果显示,两组肺部均有荧光信号,证实小鼠发生肺部转移(图5C)。以上结果说明切除模型小鼠原发肿瘤仍会出现术后复发,经骨髓注射术后复发模型构建成功。
3 讨论

图5 切除原发肿瘤后转移性肿瘤的发展Figure 5 Development of metastatic tumors after primary lesion resection
建立理想的转移模型是研究恶性肿瘤转移相关机制和药物筛选的基础,目前常用的动物模型包括乳垫注射、皮下注射、尾静脉注射等,乳垫注射法和皮下注射法实验周期较长,肿瘤转移速率慢,模型小鼠通常因原发肿瘤负荷过大而出现死亡,因而研究者对高转移效率和较短实验周期的要求使得尾静脉注射在众多转移模型中脱颖而出。但有学者提出,尾静脉注射诱导转移性肿瘤的发生与临床中肿瘤患者体内发生转移不尽相同。肿瘤的转移包括定植、淋巴细胞浸润、沉默、上皮间质转化和转移等多步骤,而尾静脉注射使大量肿瘤细胞直接释放在血液中,缺少了原发肿瘤的定植、肿瘤细胞入侵血管和毛细血管新生等多个步骤,而骨髓注射法恰好弥补了尾静脉注射法所缺失的步骤[7]。本实验构建骨髓注射法肺转移模型对小鼠伤害小,通过对原发肿瘤和胸腔观察及HE染色证明骨髓注射法肺转移模型构建成功。
模型实验周期和肺转移效率是评价小鼠转移模型的重要指标。在细胞数量相同的情况下,经骨髓注射的荷瘤小鼠的原发肿瘤较其他注射法相比没有显著变化,但其生存期短,其转移效率显著高于其他模型组;同时与其他模型组相比,骨髓注射法发生肺转移所需的细胞数量最少,同时发生肺转移时间最早。局部手术治疗是恶性肿瘤患者常用的治疗手段,但肿瘤复发和转移仍然是特定恶性肿瘤发病率和死亡率的主要原因[16]。经骨髓注射的荷瘤小鼠,在不同时间节点对荷瘤小鼠进行原发肿瘤切除,以此来模拟临床肿瘤患者局部手术治疗。第3天截肢组的小鼠未出现肿瘤的复发和转移,这表明较早截肢的小鼠,肿瘤细胞没有定植,无法形成原发病灶,即没有种子,就没有办法形成循环肿瘤细胞,进而无法形成转移灶,说明肿瘤转移时依赖原发病灶。第7天和第10天截肢组小鼠均出现了肿瘤转移,这表明随着时间推移,当肿瘤细胞定植、原发病灶增大时,“种子”已经形成并且开始播散,变成循环肿瘤细胞,此时即使将原发病灶切除,但转移灶依旧可以出现,这也就解释为什么在临床上即使手术切除原发病灶后,转移灶仍然可以出现,并且也是为什么临床上要提倡肿瘤早发现早诊断早治疗的目的。
乳腺癌是临床中常见会发生转移的癌症,因而在模型中选用了4T1乳腺癌细胞株。肝癌和结肠癌在癌症患者体内同样也易发生转移,课题组在后续的实验中也发现了经骨髓注射的Hep1-6肝癌细胞株和CT26结肠癌细胞株同样会发生转移,说明此模型是广谱的建立肺转移模型的工具,而不是只对乳腺癌肺转移模型敏感。除此之外,本文很好的解释了“种子与土壤”理论在肿瘤转移中发挥的重要作用。随着现代医学与传统医学的不断结合,人们对于肿瘤的态度由“赶尽杀绝”逐渐转向“带瘤生存”,如何才能“带瘤生存”[17-18]?中医药则在其发挥了重要作用,中医药通过重塑肿瘤微环境,使肿瘤生长的“土壤”不再适宜其生长与发展,从而减少肿瘤的复发和转移[19-20]。同时中医药治疗亦具有抑制“种子”活性的功能[21]。因此中医药可以很好的利用该模型进行探索性研究,亦对中医药抗肿瘤发展具有重大意义。
