压力超负荷心衰小鼠模型的心脏结构和功能病理进程特征
2020-11-06谭伟江李想郑双马俊峰任学聪贺天真陈虹华陈建新杨丰华
谭伟江李想郑双马俊峰任学聪贺天真陈虹华陈建新∗杨丰华∗
(1.华南农业大学兽医学院,广州 510642;2.广东省实验动物监测所,广东省实验动物重点实验室,广州 510633)
我国心血管病患者达到2.9亿,死亡率居各疾病之首,已成为严重的公共卫生问题[1]。多种心血管疾病包括高血压、瓣膜病、先天性主动脉狭窄均可导致左室压力超负荷,诱发心室代偿性肥厚、收缩舒张功能障碍,并进而发展为失代偿性心衰[2]。压力超负荷致心衰是基础和转化医学的研究重点。最早由Rockman等[3-4]报道应用小鼠主动脉弓缩窄(TAC)手术来诱导压力超负荷技术,是最常用的心衰疾病机制研究和药物研发的手术诱导模型之一。
目前在应用TAC小鼠心衰模型中普遍只关注某个病理进程点,例如基于心肌肥厚[5-6]或心衰[7]的研究,缺乏对模型多个疾病进程结构、功能和病理变化的完整探索。近年来随着影像学技术的不断发展,特别是超高频高分辨小动物超声影像系统的应用,为无创、连续性动态检测小鼠手术模型的心脏结构和功能变化提供了可能[8-9]。在超声影像数据采集中,较为常用的为B型超声和M型超声,其通过测量心脏室壁厚度,心室内径并计算射血分数和短轴缩短率来评价心脏结构和收缩功能,但结合二尖瓣口血流多普勒和二尖瓣环组织多普勒评价心脏舒张功能的方法较为少用。除了影像学外,病理学技术也为深入了解模型病理变化提供了重要依据。本研究通过结合B型、M型、多普勒超声影像学与病理组织学技术,对小鼠压力超负荷致心衰模型疾病进程做出综合性评价。
1 材料与方法
1.1 材料
1.1.1 实验动物
3月龄无特定病原体(SPF)级雄性C57BL/6J小鼠32只,体重(26±2)g,购买自广东省医学实验动物中心【SCXK(粤)2018-0002】,饲养于广东省实验动物监测所SPF级和AAALAC认证的动物设施【SYXK(粤)2016-0122】,饲养设施环境保持温度22~26℃和湿度40%~60%,12 h日夜周期交替。实验计划由广东省实验动物监测所实验动物伦理委员会审核通过(IACUC2017015)。
1.1.2 试剂与仪器
异氟烷(瑞沃德,中国),直接红80(Sigma,366648),苦味酸(Sigma,197378),伊红(Sigma,14009)苏木素(Sigma,104302),显微镜(Leica DM 2000,德国),Vevo2100超高频高分辨小动物超声影像系统(VisualSonics,加拿大)。
1.2 方法
1.2.1 实验分组
32只小鼠随机分为手术造模前0周(n=8)和手术造模后2周(n=8)、4周(n=8)、8周(n=8)组。实验总体设计见图1。

图1 小鼠心衰模型建模和实验设计Note.A,The overall design of the experiment.B,Surgery thoracotomy.C,Schematic diagram of establishment of TAC model in mice.Blue,the needle for determining the constriction size.Figure 1 Model establishment and experimental design for the murine heart failure model
1.2.2 小鼠压力超负荷心衰模型制备
按已有报道所述建模[10-12],首先,使用2%异氟烷(瑞沃德)混合气体对小鼠进行诱导麻醉,然后转移至手术台保定,行气管插管后连接呼吸机,给予1.5%异氟烷混合气体维持麻醉;其次,小鼠胸部进行消毒及备皮后,第二肋位做纵向切口打开胸腔,暴露主动脉胸段;最后,在主动脉的头臂干与左颈总动脉间下方穿入7-0细线,把26 G细针与主动脉弓共同结扎,结扎后取出细针(图1B,1C)。
1.2.3 主动脉弓血流多普勒超声
主动脉弓血流参数通过多普勒超声技术获取。将超声探头放置于小鼠右侧颈部位置,显示主动脉弓图像后,将多普勒取样容积光标放到头臂干与左侧颈总动脉间的主动脉弓段,获得主动脉血液峰值速度,结合多普勒效应运算获得血液峰值压力。
1.2.4 M型和B型超声
对实验小鼠应用Vevo 2100小动物超声成像仪配合MS-400探头进行B型和M型超声测量。采用已报道的方法进行超声检测[13-15],使用1.5%异氟烷混合气体对小鼠麻醉,取仰卧位保定,探头切迹朝向小鼠右肩与中线成约30°取得水平位胸骨旁左室长轴B型图;顺时针旋转探头约90°,获得乳头肌平面的胸骨旁左室短轴B型图,同时放置M型超声光标,获得左室M型超声图像。记录室间隔收缩末期厚度(interventricular septum thickness,endsystolic,IVS;s),室间隔舒张末期厚度(interventricular septum thickness,end-diastolic,IVS;d),左室收缩末期内径(left ventricular internal dimension,end-systolic,LVID;s),左室舒张末期内径(left ventricular internal dimension,end-diastolic,LVID;d),左室收缩末期后壁厚度(left ventricular posterior wall,end systolic,LVPW;s)和左室舒张末期后壁厚度(left ventricular posterior wall,end diastolic,LVPW;d)。计算反映左室收缩功能指标包括射血分数(ejection fraction,EF)和短轴缩短率(short axis fractional shortening,FS)。
1.2.5 二尖瓣血流和组织多普勒频谱采集
采集二尖瓣口血流和二尖瓣环组织多普勒频谱用于评价心脏舒张功能。将探头移动到胸廊的外侧壁水平放置,得到心尖四腔切面。将多普勒取样容积光标放置在二尖瓣瓣尖上方获得二尖瓣口舒张早期血流E峰值速度和舒张晚期血流A峰值速度,等容收缩时间(isovolumetric contraction time,IVCT),等容舒张时间(isovolumetric relaxation time,IVRT),和射血时间(ejection time,ET)。使用如下公式计算心肌功能指数(myocardial performance index,MPI):MPI=(IVCT+IVRT)/ET。同时,在标准心尖四腔心切面,选取组织多普勒模式显示完整二尖瓣环结构,容积光标至于左室前壁处获得二尖瓣环运动频谱。测量可获得舒张早期瓣环e′峰值速度和舒张晚期瓣环a′峰值速度。
1.2.6 病理学评价
采集0、2、4、8周组小鼠心脏样本,置于4%多聚甲醛溶液中固定24 h,取心脏进行石蜡包埋,4μm厚度切片,HE染色观察心肌细胞形态改变,天狼猩红染色分析心肌纤维化程度。
1.3 统计学分析
数据采用平均值±标准差(±s)表示。采用多功能数据图像分析软件GraphPad Prism 7进行统计分析。结果采用One-way ANOVA单因素方差分析及Tukey’s检验比较0、2、4、8周组之间的指标值的差异。P<0.05认为差异具有统计学意义。
2 结果
2.1 主动脉弓缩窄诱导左室压力超负荷
血流多普勒用于检测血流速度流向及速度(图2)。在造模前0周和造模后2、4、8周对小鼠主动脉弓缩窄部位进行测量。超声结果显示,与0周组相比,2、4、8周组小鼠主动脉弓缩窄部位血流速度和压力均显著性增加。所有测量和计算值见表1。
表1 主动脉弓血流峰值速度及血流峰值压力(±s,n=8)Table 1 Peak velocity and pressure at the aortic arch stenosis(±s,n=8)

表1 主动脉弓血流峰值速度及血流峰值压力(±s,n=8)Table 1 Peak velocity and pressure at the aortic arch stenosis(±s,n=8)
注:与0周组比较,∗P<0.05。Note.Compared with the 0 week group,∗P<0.05.
组别Groups血流峰值速度(mm/s)Peak velocity(mm/s)血流峰值压力(mmHg)Peak pressure(mmHg)0周0 week 689.42±45.92 1.91±0.26 2周2 weeks 4773.00±622.71∗ 92.48±23.25∗4周4 weeks 4395.57±572.69∗ 78.43±21.21∗8周8 weeks 4553.73±644.53∗ 84.40±25.03∗

图2 B型图和血流多普勒频谱Figure 2 B-mode and blood flow Doppler indices at the aortic arch stenosis
2.2 小鼠心衰病理进程中心脏结构的改变
胸骨旁B型长轴和短轴以及M型超声显示造模后2、4、8周心脏结构发生显著性的阶段性改变(图3A)。与造模前0周组相比,造模后2周心脏室间隔(图3A,3B)和左室后壁(图3A,3D)在收缩和舒张末期均显著性增厚,而左室内径显著性缩小(图3A,3C),表现为代偿性心肌肥厚的结构特征。随着疾病进程进入过渡期,造模后4周的心脏室间隔和左室后壁收缩末期的代偿性肥厚消失(图3B,3D,红线);同时,左室内径开始扩大,指标值由显著性缩小恢复到与造模前0周组一致(图3C)。当疾病发展至第8周时,室间隔和左室后壁进一步变薄,与2周组和4周组比较均有显著性差异(图3B,3D),在收缩期甚至显著性低于造模前0周组(图3B,3D,红线)、在舒张期与造模前0周组接近(图3B,3D,蓝线);第8周内径进一步扩大,与2、4周均有显著性差异(图3C)。第8周的心脏结构结果指示了扩张型心衰的结构特征。所有测量和计算值见表2。
表2 心脏结构测量值(±s,n=8)Table 2 Structural indices in the pathological process(±s,n=8)

表2 心脏结构测量值(±s,n=8)Table 2 Structural indices in the pathological process(±s,n=8)
注:分别与0、2、4周组比较,∗,#,&P<0.05。(下图/表同)Note.Compared with 0 week,2 weeks,and 4 weeks respectively,∗,#,&P<0.05.(The same in the following Figures and Tables)
#
2.3 小鼠心衰病理进程中左室收缩功能变化特征
射血分数(图4A)和短轴缩短率(图4B)分别反映了左室心肌缩短和左室排空功能,是整体评价心脏收缩功能的两个主要指标。结果显示,与造模前相比,手术造模2周后,心脏射血分数和短轴缩短率显著性升高,提示左室收缩功能因压力超负荷导致代偿性功能增强。4周时,心脏射血分数和短轴缩短率与2周时相比显著性降低,但与造模前无显著性差异,提示了左室代偿性增加的收缩功能逐渐丧失。当疾病持续至8周,心脏射血分数和短轴缩短率进一步降低,与2,4周相比均有显著性差异。另外,造模后小鼠心脏每搏输出量持续性下降。综上所述,在压力超负荷诱导小鼠心衰的病理过程中,心脏收缩功能首先代偿性增强,随着疾病发展,心脏收缩功能不断丧失,直至失代偿。术后各周心脏射血分数和短轴缩短率值,见表3。
表3 心脏收缩功能测量值(±s,n=8)Table 3 Assessment results of the left ventricular systolic function(±s,n=8)

表3 心脏收缩功能测量值(±s,n=8)Table 3 Assessment results of the left ventricular systolic function(±s,n=8)
组别Groups心输出量(mL/min)Cardiac output per beat(mL/min)射血分数(%)Ejection fraction,EF(%)短轴缩短率(%)Short axis fractional shortening,FS(%)0周0 week 17.46±1.86 66.08±2.68 35.84±1.91 2周2 weeks 16.56±2.52 77.44±5.97∗ 45.57±5.48∗4周4 weeks 15.95±1.95 61.13±2.69# 32.31±1.89#8周8 weeks 13.66±2.46∗# 35.89±2.48∗#& 17.10±1.31∗#&

图3 病理进程中M-型和B-型超声结果Note.A,Parasternal long-axis B-mode ultrasound,short-axis B-mode ultrasound,and short-axis M-mode ultrasound images of the left ventricle at 0,2,4,and 8 weeks,a-Left ventricular septal end-systolic thickness IVS;s and b-Left ventricular septal thickness IVS;d,c-Left ventricular endsystolic diameter LVID;s and d-Left ventricular end-diastolic diameter LVID;d,e-Left ventricular end-systolic thickness LVPW;s And f-Left ventricular end-diastolic thickness LVPW;d.B-D,end-systolic(red)and end-diastolic(blue)interventricular septal thickness,left ventricular diameter,and left ventricular posterior wall thickness.Compared with 0 week,2 weeks,and 4 weeks respectively,∗,#,&P<0.05.Figure 3 B-mode and M-mode ultrasonic images in the pathological process

图4 病理进程中左室收缩功能评价Figure 4 Systolic function of left ventricle in the pathological process
2.4 小鼠心衰病理进程中左室舒张功能的评价
采用二尖瓣口血流多普勒结合二尖瓣环组织多普勒整体评价左室的舒张功能(图5A,表4,5)。血流多普勒结果显示,与造模前比较,二尖瓣口血流等容收缩时间在2、4周有延长趋势但无显著性差异,8周显著性延长,等容舒张时间在2、4、8周均显著性延长;射血时间在各时间点均无显著性改变。以上结果提示心功能受损。
二尖瓣口舒张早期血流E峰值速度在2、4周组显著性下降,其中4周组有回升趋势;E峰值流速8周组无显著性改变。舒张晚期血流A峰值速度只在8周组显著性下降。计算血流峰值速度比E/A,可见先下降,随后回升到增加的趋势,其中,2周组表现为显著性下降、4周组表现为回升到接近正常值、8周组表现为显著性上升(图5B)。二尖瓣环组织多普勒e′和a′分别代表舒张早期和晚期的二尖瓣环运动速度(图5A)。结果显示,与0周相比,2、4、8周e′,a′及e′/a′均显著性降低(图5A,5B),表明心脏舒张功能受损。所有测量和计算值见表4,5。
结合二尖瓣血流多普勒结合二尖瓣环组织多普勒测量结果,分析E/e′值显示,此指标0周与2、4、8周值均显著性改变,表明三个心衰进程心脏舒张功能受损,并提示了4周过渡期的E/A值为假性正常(图5B,表4,5)。

图5 二尖瓣的血流多普勒和组织多普勒频谱Note.A,0,2,4 and 8 weeks group mitral valve orifice blood flow Doppler and mitral valve annulus tissue Doppler spectrum.E-mitral peak E wave velocity in diastole,A-mitral peak A wave velocity in diastole,a-isovolumic contraction time,b-isovolumic relaxation time,c-ejection time.e′-mitral annular e′velocity in diastole,a-mitral annular e′velocity in diastole.B,The cardiac diastolic function changes during the pathological process.a,E/A,ratio of early diastolic blood flow peak E and late diastolic peak A.b,Ratio of early diastolic annular e′velocity and late diastolic annular a′velocity.c,Ration of early diastolic blood flow peak E velocity to early diastolic annular e’velocity.Figure 5 Blood flow and tissue Doppler spectrum of mitral valve
表4 二尖瓣的血流多普勒测量值(±s,n=6)Table 4 Measurement of blood Doppler of mitral valve(±s,n=6)

表4 二尖瓣的血流多普勒测量值(±s,n=6)Table 4 Measurement of blood Doppler of mitral valve(±s,n=6)
?
表5 二尖瓣的组织多普勒测量值(±s,n=6)Table 5 Measurement of tissue Doppler of mitral valve(±s,n=6)
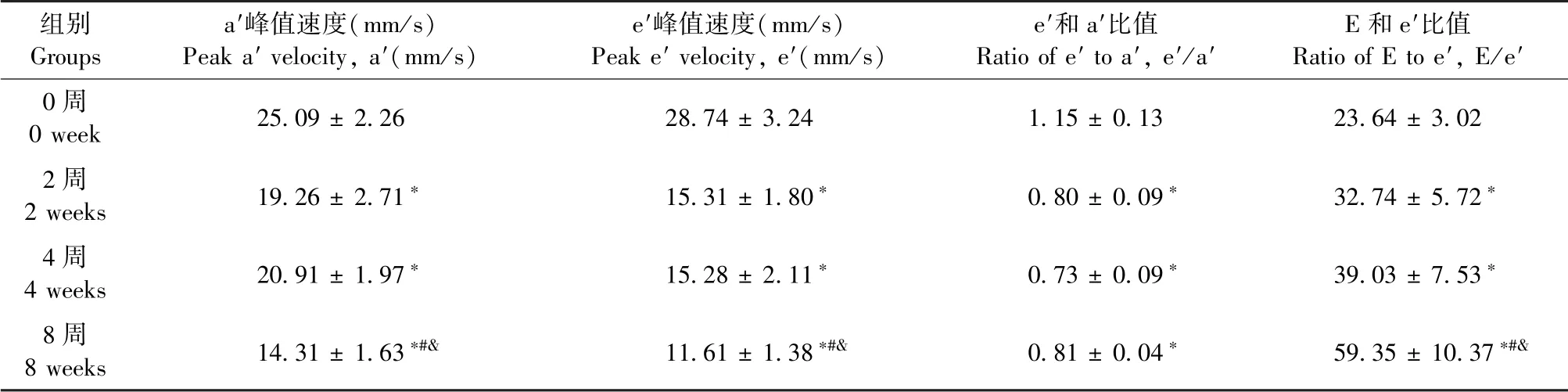
表5 二尖瓣的组织多普勒测量值(±s,n=6)Table 5 Measurement of tissue Doppler of mitral valve(±s,n=6)
组别Groups a′峰值速度(mm/s)Peak a′velocity,a′(mm/s)e′峰值速度(mm/s)Peak e′velocity,e′(mm/s)e′和a′比值Ratio of e′to a′,e′/a′E和e′比值Ratio of E to e′,E/e′0周0 week 25.09±2.26 28.74±3.24 1.15±0.13 23.64±3.02 2周2 weeks 19.26±2.71∗ 15.31±1.80∗ 0.80±0.09∗ 32.74±5.72∗4周4 weeks 20.91±1.97∗ 15.28±2.11∗ 0.73±0.09∗ 39.03±7.53∗8周8 weeks 14.31±1.63∗#& 11.61±1.38∗#& 0.81±0.04∗ 59.35±10.37∗#&
2.4 小鼠心衰病理进程中左室病理组织学改变
对0、2、4、8周组小鼠进行心脏病理切片分析(图6)。低倍镜下显示造模前心脏形态正常,造模2周心肌增厚、心腔减小,造模4周心脏内径增大,8周心腔持续性扩张(图6A,a-d),与B型及M型超声显示的结果一致。高倍镜下显示造模前心肌细胞结构完整、细胞排列整齐(图6A,e);造模2周细胞增大,但仍能看到完整细胞结构(图6A,f);造模4周时,心肌细胞肥大、细胞结构排列紊乱(图6A,g);造模8周后,心脏细胞核固缩、细胞溶解、细胞间隙明显增大(图6A,h)。同时,天狼猩红染色显示,心肌组织纤维化随着小鼠心衰进程逐步增加(图6B,6C)。

图6 心脏组织病理评价(n=8)Figure 6 Pathological evaluation of cardiac tissue(n=8)
3 讨论
在本研究中,我们应用影像学多种超声模式和病理学技术,展示了小鼠TAC模型的病理进程代偿性心肌肥厚、过渡期到失代偿扩张型心衰等三个主要阶段的特征。研究结果多方位可视化的展示了压力超负荷至心衰疾病中心脏功能逐步加剧恶化的过程,并通过HE染色观察组织病理改变和天狼猩红染色观察心肌纤维化,显示心肌组织经历从肥大到坏死阶段,心肌胶原纤维含量从少到多的积累过程,与现有研究报道结果相类似[16]。这些实验数据综合性地评价了心衰疾病过程中心脏的改变,为此模型在心血管疾病领域研究的应用提供了可靠的理论依据。
目前,已有研究人员开始关注压力超负荷心衰小鼠模型引起的疾病变化[16-17],但评价指标较少,往往只能集中在疾病发展过程中的某个时间点[18-19]。我们对左室压力超负荷诱发心衰的从代偿性心肌肥厚、过渡期和失代偿扩张型心衰三个进程的结构和功能特点进行的分析。在影像学功能特征分析方面,我们在造模2周发现心脏射血分数和短轴缩短率显著性上升,到4周后下降至正常水平,并且至第8周失代偿性扩张期,射血分数和短轴短缩率持续下降。此外,我们发现造模八周后心脏等容收缩期显著性延长。等容收缩时间是反映收缩能力的重要指标,结合在M-型超声结果发现的小鼠收缩功能显著受损(EF值显著降低),我们判定心衰期左室收缩功能不足导致了血液不能快速冲开主动脉瓣流出左室,表现为等容收缩时间延长。综上结果表明,心脏收缩功能在压力超负荷诱发心衰的疾病进程中呈现先增强后持续性下降的倒“V”形变化趋势。我们的研究结果支持了临床上认为预防心衰需要尽早干预心脏收缩功能障碍的策略[20],为科学探索心衰发生发展机制和防治药物研发提供参考依据。
有研究表明舒张功能的异常也是导致心脏疾病发展的重要因素[21-22],但是当前压力超负荷致心衰模型的评价常集中在心脏结构和心脏收缩功能方面,缺乏心脏舒张功能的多方面评价。目前关于心脏舒张功能评价时常使用二尖瓣血流多普勒作为单一评价方式,通过核心指标二尖瓣血流E/A比值作为主要参考依据,这样容易造成诊断误差。研究证实,舒张期二尖瓣环的心肌运动和二尖瓣血流多普勒频谱相互呼应,代表舒张早期瓣环运动速度e′和舒张晚期瓣环运动速度a′可作为舒张期心肌运用的直接指标,具有更高的敏感性和特异性[23]。因此,我们除了关注二尖瓣血流核心指标E/A值外,还选择二尖瓣环组织多普勒e′/a′比值以及二者结合参数E/e′作为重要参考指标进行评价依据,从而能够多方面完整评价心脏舒张功能。
第2周舒张功能评价显示E/A显著下降,e′/a′和E/e′的改变显示舒张功能受损,第4周时发现E/A上升至接近正常值,但e′/a′和E/e′显示舒张功能受损,当疾病持续至第8周,E/A显著性上升e′/a′和E/e′的显著性改变均一致提示心脏舒张功能受损的进一步加剧,测量值表明e′/a′和E/e′与M型超声和病理组织检测结果完全一致。另外,我们结合e′/a′和E/e′的变化也揭示心脏舒张功能的假性正常化,与临床上的舒张不全导致的假性正常化特征一致[24]。因此,二尖瓣环的各项指标在舒张功能评价中必不可少。
综上所述,通过影像学和病理学展示压力超负荷的心衰模型经历了代偿性心肌肥厚,过渡期到失代偿扩张型心衰的疾病进程中各项功能结构的改变,为日后小鼠主动脉弓缩窄模型的使用提供理论基础。
