敲降Prx V抑制A549肺癌细胞的增殖和迁移
2020-11-06任晨曦宫伊希谢丹萍刘悦郭晓宇申贵男孙虎男
任晨曦,宫伊希,谢丹萍,刘悦,郭晓宇,申贵男,孙虎男
(黑龙江八一农垦大学生命科学技术学院,大庆 163319)
在癌症的发生发展过程中,原癌细胞会在原发部位增殖生长,当生长到一定大小后,会侵润周围组织的血管和淋巴,进入血液后,随血液循环转移到其他部位,继续增殖生长形成转移性肿瘤。近年来,肺癌(Lung Cancer)的发病率与致死率居高不下,每年约有超过1 000 000人死亡,人类的生命健康受到严重的威胁[1]。肺癌在发展过程中,癌细胞的高增殖性与易转移性导致肺癌细胞极易发生转移,病情发展较快,患者确诊时已到癌症晚期,导致肺癌患者的存活率极低。依据组织病理学的标准,肺癌可分为两种类型:一种为小细胞肺癌(small cell lung cancer,SCLC),另一种为非小细胞肺癌(non-small cell lung cancer,NSCLC)[2]。临床上最为常见的肺癌多为非小细胞肺癌,非小细胞肺癌患者约占肺癌患者总数的80%,非小细胞肺癌的快速增殖能力和高转移性是最常见的致死原因[3]。然而传统的手术治疗和化学疗法皆存在着副作用强、治疗经费昂贵等一系列不足,因此,寻找一种可以有效抑制肺癌细胞增殖和转移的新方法迫在眉睫。
过氧化物还原酶(Peroxiredoxins,Prxs)是细胞内的一类过氧化物酶[4-6],哺乳动物细胞表达六种Prx亚型:PrxI~VI。根据半胱氨酸残基类型不同分为:含有两个半胱氨酸残基的典型Prx I~IV与非典型Prx V和含有一个半胱氨酸残基的Prx VI[7]。在生理条件下,它们负责保护细胞免受DNA氧化损伤和基因组不稳定,调节与H2O2相关的细胞信号,影响细胞的分化和增殖,免疫反应和凋亡[18]。过氧化物酶V(Peroxiredoxin,Prx V)是Prx家族中的一个成员。Prx V在细胞质、线粒体以及过氧化物酶体中广泛存在,能够还原细胞内过氧化氢,烷基氢过氧化物以及过氧亚硝酸盐,清除细胞内的活性氧等[8-9],对细胞质、线粒体具有抗氧化的保护功能[10]。有研究发现,Prx V在肝癌细胞[11]、结肠癌细胞[12]、胃癌细胞[13-14]凋亡过程中均具有调控作用,过量表达Prx V会通过上调Snail增加胃癌细胞的增殖和侵袭性[15];在结肠癌细胞内过量表达Prx V会促进结肠癌细胞的增殖、迁移和侵袭能力,在抑制Prx V后可以有效降低细胞的EMT(Epithelial-to-mesenchymal transition)特性[16]。同时也有研究发现,Prx V的高表达与肿瘤细胞病灶形成、浸润、淋巴结转移、晚期TNM分期有显著的负相关性[17]。但是,Prx V对A549人肺癌细胞的各种生理活性的影响现今并无研究。
研究利用慢病毒载体转染A549人肺癌细胞系,构建Prx V敲降的A549细胞系,对构建的细胞系利用荧光显微镜和蛋白免疫印迹法进行鉴定,通过MTT实验、细胞划痕实验、群落形成实验及蛋白质印迹法检测两种细胞的增殖、迁移、群落形成能力和相关蛋白表达水平间的差异,初步阐明Prx V对A549肺癌细胞的生理活性的影响,为肺癌的治疗提供新的思路与理论依据。
1 材料与方法
1.1 材料
1.1.1 细胞
A549细胞系购自大庆市鸿图生物科技有限责任公司(中国,黑龙江)。
1.1.2 试剂及仪器
DMEM/高糖培养基购自HyClone公司;胎牛血清购自四季青公司;PBS购自HyClone公司;MTT试剂购自Amreso公司;DMSO试剂购自天津市富宇试剂公司;丽春红试剂购自Solarbio公司;0.25%胰蛋白酶购自Solarbio公司;抗mouse anti-Prx V、vimentin、PCNA、P21、抗 rabbit-actin、E-cadherin、Cyclin D1、cleaved-caspase 3的一抗单克隆抗体购自美国Santa Cruz公司;硝酸纤维素膜购自BIO-RAD公司;ECL购自Thermo Scientific公司;细胞培养皿均购于NEST公司;蛋白免疫印迹系统购自美国Amersham Bioscience公司。
1.2 细胞培养
A549肺癌细胞用DMEM/高糖培养基放置于37℃、5%CO2及湿度适宜的培养箱中培养,DMEM/高糖培养基含有10%灭活的新生胎牛血清(FBS),1%青霉素/链霉素((penicillin/streptomycin,P/S)。
1.3 Prx V基因敲降的A549细胞的构建
对Prx V的基因序列进行查询,设计针对Prx V基因的 siRNA序列(5′-GGAATCGACGTCTCAAGAGGT-3′)和阴性对照(negative control)siRNA 序列(5′-TTCTCCGAACGTGTCACGT-3′),送至苏州吉玛基因公司进行构建和包装,将构建的目的慢病毒载体命名为shPrx V和mock。培养A549肺癌细胞,待细胞汇合率达60%左右,加入相应病毒悬液,每隔12 h进行细胞状态观察,24 h后停止转染。根据转染的病毒将转染后的A549细胞分别命名为shPrx V组和mock组。扩增两组细胞,换用含有2 g·mL-1嘌呤霉素(Puromycin)、20%FBS和1%P/S的DMEM 高糖培养液对转染后的细胞进行抗性筛选。培养至相同培养条件下未转染细胞全部悬浮时,筛选结束,检测细胞转染情况。
1.4 荧光显微镜检测细胞转染情况
将未转染con组A549细胞、转染空载体mock组A549细胞以及转染目的基因shPrx V组A549细胞分别接种于6孔板中,待细胞生长稳定后,去掉6孔板培养皿中原有的液体,PBS溶液清洗2遍,在培养箱中培养10 min,在荧光显微镜下观察明视野及绿色荧光条件下的视野,拍照成像。每组实验均做3次重复。
1.5 MTT法检测细胞增殖能力
在96孔板中接种两组浓度为3×103的A549细胞。细胞贴壁后,加入10 L MTT溶液,敲打混匀,培养箱中孵育2 h,弃去培养液,加入100 L DMSO(二甲基亚砜)敲打混匀,溶解10 min,利用酶标仪在490 nm测定吸光度(OD)的值。连续检测7 d,绘制两组A549细胞的生长曲线。每组实验均做3次重复。
1.6 划痕试验检测细胞迁移能力
将两组A549细胞以2×105个细胞每孔均匀的接种到24孔板内,过夜培养。待细胞贴壁后,每孔用灭菌的白枪头垂直划线,PBS洗2~3次。用无血清的培养液培养,利用荧光显微镜分别在0、24 h固定位置拍照。每组实验均做3次重复。
1.7 群落形成实验检测细胞群落形成能力
将两组A549细胞以5×103个细胞每孔接种到6孔板内,培养至肉眼可见密集的细胞群落后弃去培养液。3.7%多聚甲醛固定10 min,弃去3.7%多聚甲醛,PBS洗一遍,甲醛溶液固定10 min,弃去甲醛溶液,PBS洗一遍,结晶紫染色40 min,PBS洗两遍,晾干,扫描成像。每组实验均做3次重复。
1.8 蛋白质印迹法检测相关蛋白表达量
收取成功转染的两组A549细胞,PBS洗一遍,8 000 rpm离心3 min,弃净上清液,冰上操作,加入适量细胞裂解液,每隔5 min敲打一次,共敲打5次。4℃,12 000 rpm离心30 min,取上清液,通过分光光度计测得两组样品在595 nm处蛋白质浓度。配制为20μg/15μL的蛋白质试样,沸水煮样5 min,取15μL进行12%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)分离,转膜,5%脱脂乳封闭 1 h,用含有 10 mmol·L-1的 Tris-HCL(TBS)、15 mmol·L-1的NaCl、0.2%Tween-20 的 TBST 洗涤 5 次,5 min·洗一次,抗 mouseanti-Prx V、vimentin、PCNA、P21、抗rabbitactin、E-cadherin、Cyclin D1、cleaved-caspase 3 单克隆一抗,以1∶2 000进行稀释,4℃孵育过夜。回收一抗,TBST洗涤5次,5 min。洗1次,5%脱脂乳封闭10 min,与 HRP 标记的鼠或兔二抗(1∶5 000)孵育 1 h,洗膜30 min,5 min更换一次TBST,ECL底物作用。用蛋白质免疫系统进行曝光、显影、定影及结果分析。每组实验均做3次重复。
1.9 统计学分析
以均值±标准差来表示所有的实验结果,t检验检测两组间比较,*P<0.05表明差异有统计学意义。每组实验均做3次重复。
2 结果
2.1 Prx V在肺癌中的表达差异
为了探究Prx V与肺癌存在的关系,通过http://gepia.cancer-pku.cn网站对The Cancer Genome Atlas(TCGA)数据库的肺癌患者肿瘤组织与正常人肺组织中的Prx V表达量检索结果显示,肺癌患者肿瘤组织中的Prx V表达量高于正常组织;同时Prx V高表达的肺癌患者生存比率明显低于Prx V低表达的肺癌患者(图1A和图1B),但肺癌发展不同时期Prx V表达含量无明显差异(图1C)。这些结果表明,在肺癌发生、诊断以及治疗中Prx V可能会发挥重要的临床意义。
2.2 Prx V基因敲降A549细胞的构建及其对A549细胞增殖能力的影响
为了检测Prx V对A549肺癌细胞的影响,通过荧光显微镜的明视野与绿色荧光视野观察,结果显示细胞已成功转染了慢病毒载体(图2A)。同时蛋白免疫印迹也进一步证明了shPrx V组Prx V蛋白表达水平明显下降,并与mock组具有显著性差异(图2B和图2C)。通过MTT法检测并绘制两种细胞的生长曲线,结果显示shPrx V组细胞的增殖能力显著低于mock组(图2D)。初步研究发现敲降Prx V显著降低A549细胞的增殖能力,因此为了进一步检测Prx V对A549细胞的其他生理活性是否有影响,我们接着进行了划痕和群落形成实验的研究。

图1 Prx V在肺癌肿瘤中的表达和患者预后存活率的数据分析Fig.1 The Prx V expression levels and survival rate analysis in lung cancer patient
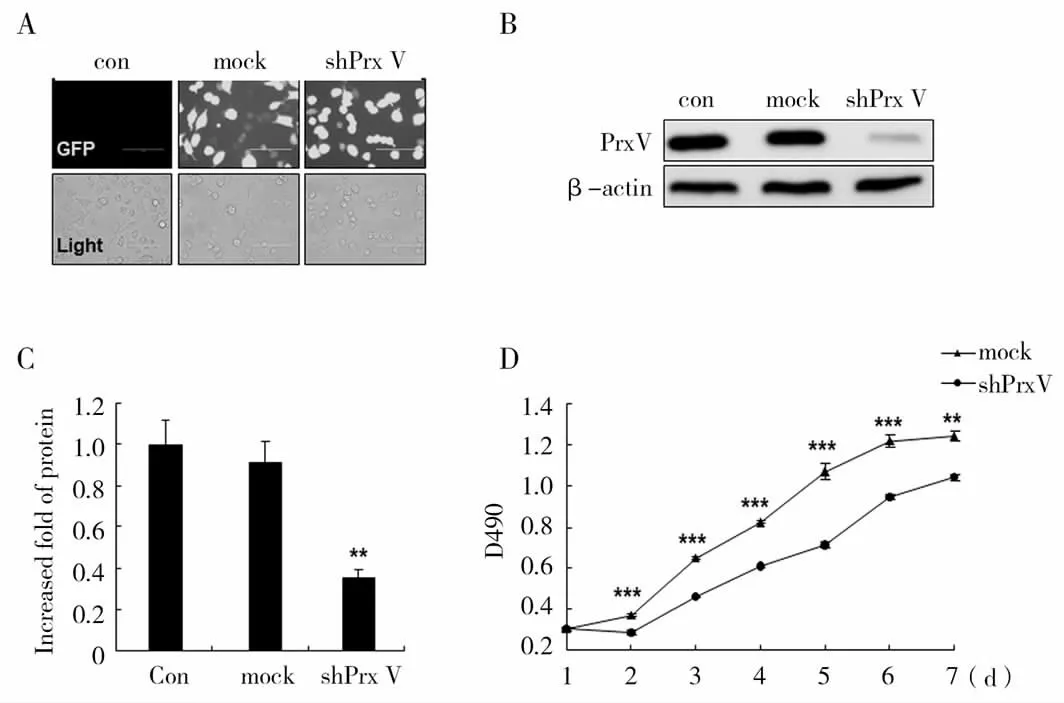
图2 敲降Prx V后对A549细胞增殖能力的影响Fig.2 Effect of Prx V knockdown on the proliferation of A549 cells
2.3 敲降Prx V对A549迁移和群落形成能力的影响
为了检测敲降Prx V对A549细胞迁移能力的影响,通过划痕实验检测发现,与mock组细胞相比,shPrx V组细胞的迁移能力明显被抑制(图3A和图3B)。同时,群落形成实验证明,Prx V基因敲降后,A549细胞的群落形成能力明显下降(图3C和图3D)。为了更进一步验证上述实验结果的准确性,我们利用蛋白免疫印迹实验进行更深一步的研究。

图3 敲降Prx V后对A549细胞迁移和群落形成能力的影响Fig.3 Effect of Prx V knockdown on the migration ability and plate cloning ability of A549 cells
2.4 敲降Prx V对A549增殖和迁移相关蛋白水平的影响
为了明确Prx V对A549细胞的调控作用。通过蛋白免疫印迹法检测两组细胞增殖、迁移和群落形成相关蛋白水平的变化。结果显示:shPrx V组A549细胞中的增殖相关蛋白PCNA表达量明显低于mock组A549细胞;与mock组相比,波形蛋白Vimentin表达量下降、E-caderin表达量升高;细胞周期相关蛋白 P21、Cyclin D1表达量上升;凋亡相关蛋白cleaved-Capase 3表达量增加(图4A和图4B)。以上结果说明,Prx V基因敲降后A549细胞发生G1期阻滞,细胞发生凋亡,进而抑制A549细胞增殖。敲降Prx V也通过改变迁移相关蛋白的表达抑制A549细胞迁移。同时证明了上述MTT实验、划痕实验和群落形成实验的准确性。

图4 敲降Prx V后A549细胞中增殖、迁移相关蛋白的表达情况Fig.4 Expression of markers associated with migration and proliferation in A549 cells after knockdown of Prx V
3 讨论
在2018年,大约有170多万名患者死于肺癌[22],肺癌对人类幸福生活产生了严重的威胁。由于肺癌患病初期无明显症状,转移到其他部位后,患者感觉不适才会被发现。当发生增殖转移从而扩散后,患者存活的时间仅有几年或几个月。其中非小细胞肺癌最初对化疗和放疗均有耐受性[23],并且化疗和放疗都具有强烈的毒性反应,导致非小细胞肺癌患者的存活时间被极大缩短,因此找寻抑制肺癌细胞增殖和转移,减缓肺癌患者病情的发展,延长肺癌患者存活时间的新方案迫在眉睫。
有研究证明,Prx V是一种多功能蛋白,在卵巢癌中Prx V是阴性生存预测因子[18]。在CRC结肠癌细胞中Prx V可以调控两种标志性的EMT蛋白Ecadherin和Vimentin的表达,以及EMT相关转录因子Snail和Slug的表达,显著促进了CRC结肠癌细胞的增殖、迁移和侵袭[16]。β-拉帕醌能够下调SW480结肠癌细胞中Prx V的表达水平,使细胞内ROS水平升高,并通过线粒体依赖性凋亡途径,诱导细胞凋亡[12]。Prx V可能通过上调Snail的表达,增强间充质表型而导致胃癌预后不良[15]。以线粒体膜间隙为靶点的Prx V能减弱缺氧诱导的活性氧信号[19]。SY5Y神经母细胞瘤细胞中MPP+线粒体凋亡通路是由线粒体Prx V调控的[20]。在肺癌细胞U1810中,Prx V通过影响线粒体凋亡通路、线粒体跨膜电位、钙负荷能力以及线粒体形态对抗抗癌药物诱导的细胞凋亡[21]。Prx V参与了促进胃癌细胞EMT和致瘤表型的多功能机制。此外,Prx V是可能导致预后不良的重要诊断因素。最后,对于各种过表达Prx V的癌症,Prx V是一个公认的治疗靶点和临床策略[15]。
研究中,利用shPrx V组与mock组A549细胞进行对比,发现shPrx V组细胞增殖、迁移和群落形成能力明显低于mock组,结果显示Prx V对A549肺癌细胞的生理活动有着显著的影响。为了进行更深一步的研究,经查阅论文发现增殖性细胞核抗原(PCNA)是DNA复制过程中的一种辅助蛋白。PCNA与DNA复制密切相关,癌细胞增殖能力强,导致患者癌组织内的PCNA蛋白水平较正常组织多[24]。E-钙黏蛋白(E-caderin)的表达促进同种细胞之间连接和黏附,使癌细胞不易从原发灶脱离,能抑制肿瘤细胞的转移。E-caderin表达量减少时细胞迁移和侵袭能力增加[26]。波形蛋白(Vimentin)主要表达于上皮组织和基底膜组织中,与上皮细胞形态以及细胞间紧密连接密切相关[27]。P21与细胞周期蛋白Cyclin D1等密切相关,能调节细胞周期,当P21被激活时则可促进凋亡因子的表达,从而诱导细胞凋亡[25]。因此,利用蛋白质印迹法检测两组细胞增殖、迁移等相关蛋白水平的变化情况发现,与mock组相比,shPrx V组A549细胞中的增殖相关蛋白PCNA表达量下降;迁移相关蛋白Vimentin表达量下降、E-caderin表达量升高;细胞周期相关蛋白P21、Cyclin D1表达量升高;细胞凋亡相关蛋白cleaved-Capase 3表达量增加。以上研究结果表明,敲降Prx V可以有效抑制A549细胞的增殖、迁移和群落形成能力,导致细胞周期阻滞,细胞凋亡。这一研究结果表明了Prx V对调控A549肺癌细胞增殖和迁移能力的重要性。但Prx V对A549细胞增值、迁移过程中所参与的具体信号通路并没有明确的阐明,这将成为我们后续的研究重点。
综上所述,敲降Prx V能有效抑制A549细胞的增殖、迁移以及群落形成能力,同时引起细胞周期阻滞,发生细胞凋亡。这一研究结果为临床抑制肺癌细胞增殖、转移,延长患者存活时间提供了新的治疗方案。
