黑龙江省某规模化牧场BVDV病毒分离鉴定及生物学信息分析
2020-11-06王梦心周玉龙贾伟强李旭阳翟海瑞靳广杰胡林杰孟野盛守志
王梦心,周玉龙,贾伟强,李旭阳,翟海瑞,靳广杰,胡林杰,孟野,盛守志
(黑龙江八一农垦大学动物科技学院,大庆 163319)
牛病毒性腹泻/黏膜病(Bovine viraldiarrhea/mucosal disease,BVD)的病原体是牛病毒性腹泻病毒(Bovine viral diarrhea virus,BVDV)。BVDV 是一种全球分布的病毒,由于其致病机制复杂,且缺乏有效的防控技术,因此BVDV在世界范围内广泛流行[1],除了可导致患病动物呼吸、消化和生殖系统的临床症状外,宫内感染BVDV的胎儿可导致免疫耐受性、持续性感染(PI)动物的出生。这些PI动物会释放大量的病毒,是传播BVDV的主要来源,因此在自然界中很难将其彻底消灭,给养殖业造成重大的经济损失[2]。在BVDV基因组中,5’-UTR是瘟病毒最保守的基因,约由360~386个核苷酸组成,通过自身折叠形成特殊的二级结构可调节BVDV的基因组的翻译和复制[3],是病毒基因组中高度保守的部分,包括一个内核糖体进入位点,本质上与病毒多蛋白的翻译有关[4],E2基因为DVBV病毒的囊膜糖蛋白,是瘟病毒中一种高度可变的免疫性糖蛋白,是中和抗体的主要靶点[5]。因此5’-UTR和E2基因均可用于瘟病毒及BVDV的遗传多样性分析[6]。近年来,黑龙江省地区的流行病学调查显示,BVDV的感染率正在逐年增加[7],实验对黑龙江省某集约化牛场采集到的奶牛呼吸道样本进行PCR检测和遗传进化分析,希望为本地区的牛病毒性腹泻粘膜病的防治提供一定的理论依据。
1 材料
1.1 样本采集
2018年黑龙江省某规模化牧场爆发牛呼吸道综合征,临床症状表现为咳嗽,结膜发炎,体温在41~42℃,鼻中流出黄色脓样鼻液,精神沉郁和消瘦,发病率为45%,致死率为20%。实验室从一头育成牛身上采集到1份肺部组织作为实验样本。
1.2 主要试剂
马达氏—牛肾细胞(MDBK)、双抗、细胞培养液(含10%的胎牛血清)、PBS缓冲液、0.25%胰蛋白酶、维持液、FITC标记羊抗鼠IgG二抗(购自英国Abcam公司)、Trizol(购自Roche公司),反转录酶(购自TOYOBO公司),Quick Taq(购自 TaKaRa公司),DL2 000 maker(购自TaKaRa公司),胶回收试剂盒(购自OMEGA公司),琼脂糖(购自BIOWESTE公司),其余试剂均为国产分析纯配制。
1.3 引物
(1)实验所用引物 5’UTR 引物 324/326(324:ATGCCC(T/A)TAGTAGGACTAGCA;326:TCAACTCCATGTGCCATGTAC)是针对高度保守的5’-UTR序列设计的一对BVDV的特异性引物,预计扩增片段为 300 bp 左右[8]。
(2)所用E2引物E2R/E2F(E2F:TGGTGGCCTTATGAGAC;E2R:CCCATCATCACTATTTCACC)则是利用Primer5以及Oligo7软件,在参考Genbank中已发表的全基因组序列,在进行比对后完成引物设计,预计扩增片段为1 400 bp左右[9]。两种引物均由上海生物工程公司合成。
1.4 5’UTR和E2参考毒株信息
2 实验方法
2.1 病毒分离
2.1.1 细胞培养
(1)从液氮罐中取出冻存的MDBK细胞,浸于37℃温水中,快速搅拌使冻存细胞快速融化。
(2)将冻存管放入离心机中离心1 000 r,5 min后取出放入超净台。吸出上清液,加入新配好的营养液轻轻吹吸混匀。用移液器吸出细胞悬液,加入10 mL的细胞瓶中,然后加入5 mL的配好的细胞培养液,将细胞吹吸均匀,放入37℃,2.5%的CO2恒温培养箱中。
(3)24 h内观察细胞生长情况,细胞基本长满一层后,倾弃瓶内的旧营养液,加入PBS洗涤2~3遍后,加入1 mL 0.25%胰酶放入37℃恒温箱内进行消化,加入新的营养液终止消化,用吸管反复吹吸没有脱落的细胞,直到细胞吹散,进行传代,37℃CO2培养箱内继续培养细胞。
2.1.2病毒样本处理
将收集到的病料进行处理,病料组织3次冻融之后,加维持液进行研磨,收集研磨液,离心12 000 r,5 min,吸取上清液,使用 0.22μm 进行过滤,-80℃保存。
2.1.3 病毒分离
(1)将长满单层细胞的细胞瓶取出,倾倒旧液,用PBS洗涤2~3次,将收集到的BVDV样本处理液取1 mL接到MDBK细胞,37℃吸附1 h,期间每隔15 min轻轻摇晃细胞瓶,确保样本处理液均匀接触细胞。
(2)处理将接种的病毒液倒入废液缸中,加入5 mL DMEM维持液,放入37℃CO2培养箱中继续培养。将病毒盲传三代,每天对接毒细胞和对照组进行观察,看是否出现病变,120 h后对接毒细胞进行收毒。
2.2 病毒鉴定
2.2.1 CPE观察
观察细胞病变情况,根据观察到的细胞是否病变进行分类,在接毒后120 h或病变超过70%进行收毒,没有病变的细胞也收毒,做后续提取RNA的实验的样本。
2.2.2 间接免疫荧光鉴定
(1)将收毒后的病毒接种到长满单层细胞的MDBK的12孔板中,接种3孔,同时设立MDBK阴性对照,约48 h后,用预冷的50%丙酮固定30 min,PBS冲洗3遍。
(2)按100μL·孔-1加入BVDV单克隆抗体为一抗(稀释 1∶100),37 ℃恒温箱孵育 1 h,PBS洗 3遍,5 min一次,轻轻摇匀,充分清洗。
(3)按200μL·孔-1加入荧光素FITC标记的羊抗小鼠IgG二抗(1∶200),37℃孵育 1 h后,PBS洗涤3次,于荧光显微镜下观察。
2.2.3 5’UTR PCR 鉴定
2.2.3.1 样本RNA的提取和转录
使用Trizol提取法提取出样本RNA,之后进行cDNA转录。
转录扩增程序:37℃ 15 min,50℃ 5 min,98℃5 min,4℃冷却后取出,将cDNA放-20℃保存备用。
2.2.3.2 5’UTR的PCR扩增
(1)将合成的cDNA作为模板,在PCR管中加入试剂,cDNA 模板 2 μL,ddH2O 8.5 μL,Quick Taq,12.5μL,5’UTR上游引物1μL,5’UTR下游引物1μL。
(2)按反应体系加入试剂后,放入PCR仪中进行反应。程序如下:预变性94℃,5 min;变性94℃,30 s,退火 56 ℃,30 s,延伸 72 ℃,45 s,35个循环,延伸72℃,10 min;4℃保存。
将胶板放入电泳仪中,取25μL PCR产物,加样,设置400 V 200 A开始电泳。电泳液为1×TAE缓冲液。在紫外灯下观察PCR结果,拍照留图并进行胶回收实验。
2.2.3.3 PCR产物纯化回收
按照OMEGA胶回收试剂盒使用说明对PCR产物进行纯化回收。
2.2.3.4 目的片段的测序
将胶回收产物进行PCR鉴定后,进行测序。
2.2.3.5 测序结果的拼接及筛选
使用MEGA X64软件中对Genbank下载的相关已知病毒基因序列进行整理,再用MEGA X64软件中的Clustal W程序进行序列比对,将序列前后多余部分删除,使所需对比序列保持整齐。从NCBI上下载5’UTR Genbank号,保存所需数据,详细见表1。
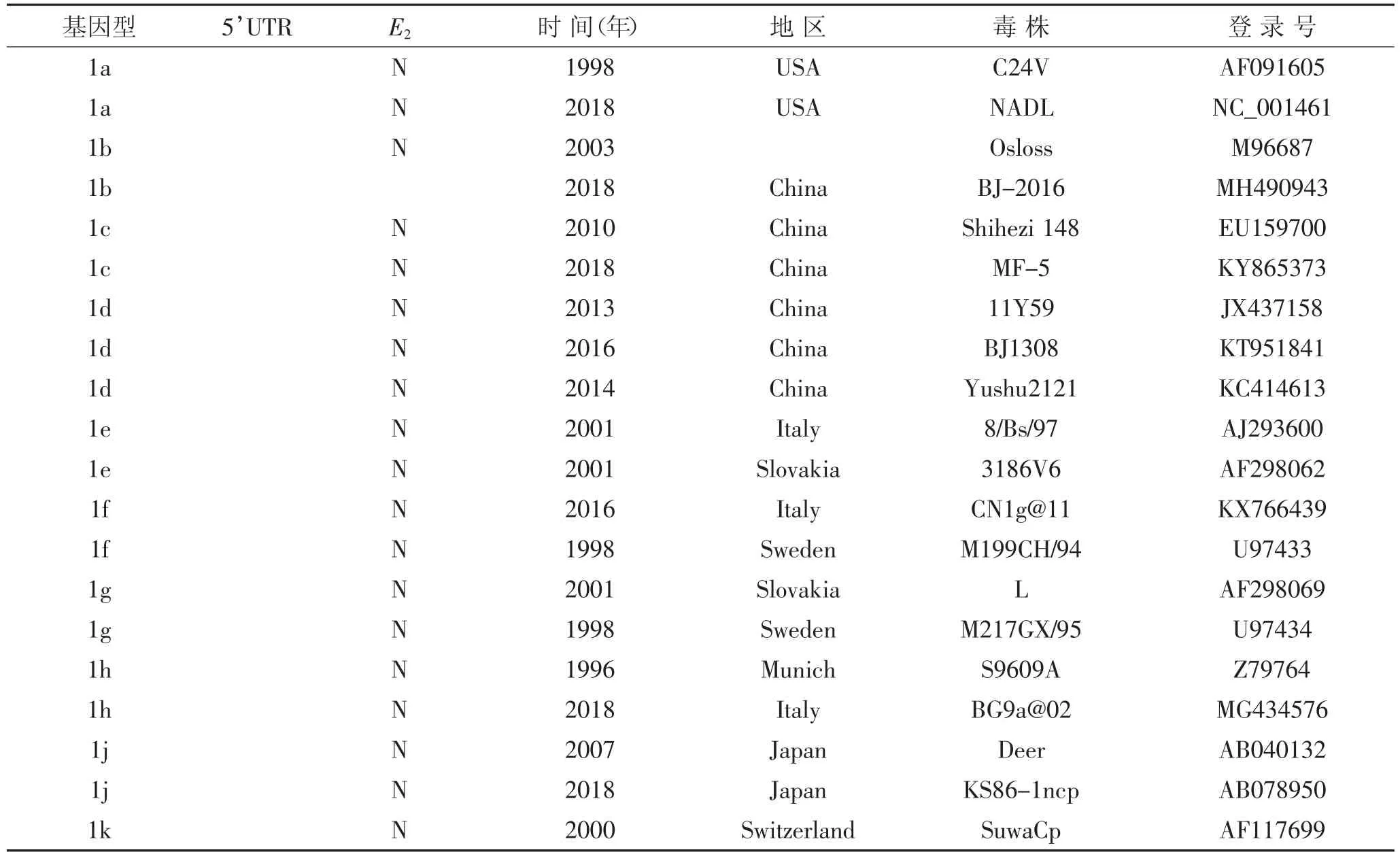
表1 5’UTR和E2参考毒株信息表Table 1 5’UTR and E2 reference strain information table

续表1 5’UTR和E2参考毒株信息表Continued table 1 5’UTR and E2 reference strain information table
2.2.4 BVDVE2基因鉴定
2.2.4.1 BVDVE2基因PCR扩增
(1)将合成的cDNA作为模板,在PCR管中加入试剂,具体如下:cDNA模板,2 μL;ddH2O,8.5 μL;Quick Taq,12.5 μL;E2上/下游引物各 1 μL。
(2)按以上扩增体系加完试剂后,放入仪器中进行扩增,具体反应体系如下预变性94℃,5 min;变性95 ℃,30 s;退火 59 ℃,45 s;延伸 72 ℃,90 s;共35个循环;延伸72℃,10 min;保存4℃。
2.2.4.2 PCR产物纯化回收
按照胶回收试剂盒说明书进行纯化回收。
2.2.4.3 目的片段的测序
将胶回收产物进行PCR鉴定后,进行测序。
2.2.4.4 测序结果的拼接及筛选
使用MEGA X64软件对Genbank下载的相关基因序列进行整理,再用MEGA X64中的Clustal W程序进行序列比对,截取序列保持整齐。从NCBI上下载E2基因的Genbank号,保存所需数据,详细见表1。
2.2.5 BVDV 5’UTR同源性比较和系统进化分析结果
我们对使用5’UTR引物检测出片段在300 bp左右的样本的测序结果,使用BLAST将所得序列与Genbank中公布的BVDV基因序列进行对比,确定样本的基因型,使用DNAStar中Meglign软件对序列的同源性进行比对,使用Mega X64软件构建进化树。
2.2.6 BVDVE2基因序列分析
2.2.6.1 BVDVE2基因的遗传进化分析
使用DNAstar软件中Megalign程序,Clustal W法对实验中得到的E2基因序列进行核苷酸水平以及推导氨基酸序列水平上进行同源性分析。使用MEGA X64生物信息学分析软件对E2基因扩增序列和Genbank中的参考序列进行了进化树分析,使用了常见方法邻近法(NJ法)进行比对。
2.2.6.2 BVDVE2基因理化性质分析
使用在线分析软件 https://web.expasy.org/protscale/对实验中推导氨基酸序列进行疏水性、柔性以及跨膜趋势进分析。
2.2.6.3 BVDVE2基因抗原表位分析
使用Protean软件中Jameson Wolf方法对实验中样本序列和参考序列所推导的氨基酸序列进行抗原表位预测分析。
3 结果
3.1 病毒分离鉴定结果
3.1.1 CPE观察结果
经过盲传3代后观察,24 h内未发现细胞发生病变,在120 h时在20倍光学显微镜下观察,细胞瓶内出现死亡细胞,细胞出现空泡和拉丝的现象,判断阳性的样本生物型为致细胞病变型(CP型)[10]。
3.1.2 间接免疫荧光鉴定结果
采用单抗对分离株AD-1进行IFA检测,可以观察到病毒在MDBK细胞中出现的荧光,对比组的MDBK细胞均未出现荧光。
3.1.3 5’UTR鉴定结果
以 BVDV 5’UTR 特异性引物(BVDV 324/326)扩增出的目的片段,片段大小约为300 bp,与预期的目的片段大小相符。确定所提取RNA为BVDV。(图1)
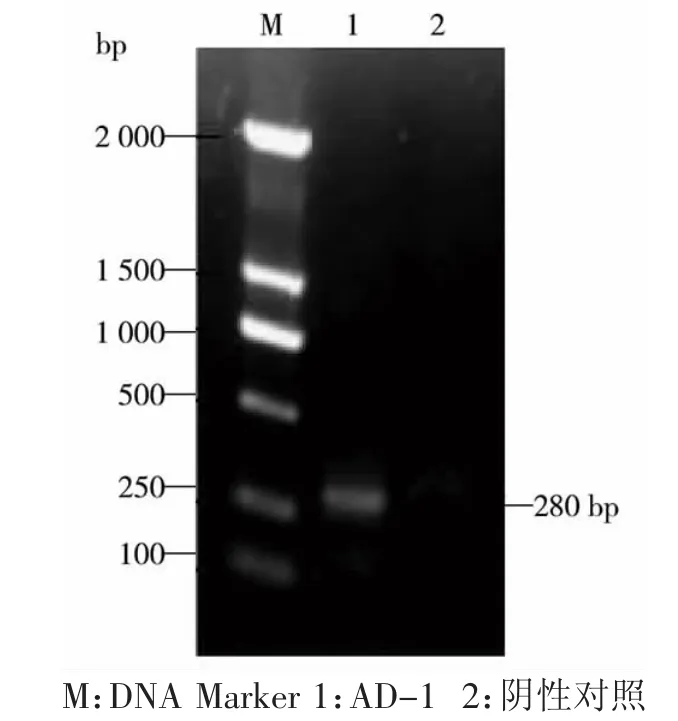
图1 5’UTR PCR结果Fig.1 5’UTR PCR results
3.1.4 BVDV 5’UTR同源性比较和系统进化分析结果

图2 BVDV 5’UTR基因核苷酸同源性结果Fig.2 BVDV 5’UTR nucleotide homology results
通过在BLAST对比结果显示,样本株AD-1基因型为BVDV-1d。将所得序列使用MegaX64与Genbank中公布的36株BVDV基因序列进行核苷酸、氨基酸同源性比较,结果显示,5’-UTR测序结果的AD-1与所有参考毒株的同源性为70.8%~99.5%。与BVDV-1型的同源性为75.4%~99.5%,与BVDV-2型的参考株同源性为76.4%~77.9%,与BVDV-3型的参考株同源性为70.8%。样本株AD-1的同源性最高同为北京株 BJ1023(Genbank:KF925509)同源性为 99.5%,其次是玉树株 Yushu2121(Genbank:KC414613)同源性为95.9%、宁夏株11Y59(Genbank:JX437158)同源性为94.9%。从进化树上可以看出,与北京株BJ1023处于同一进化分支。(图2、图3)
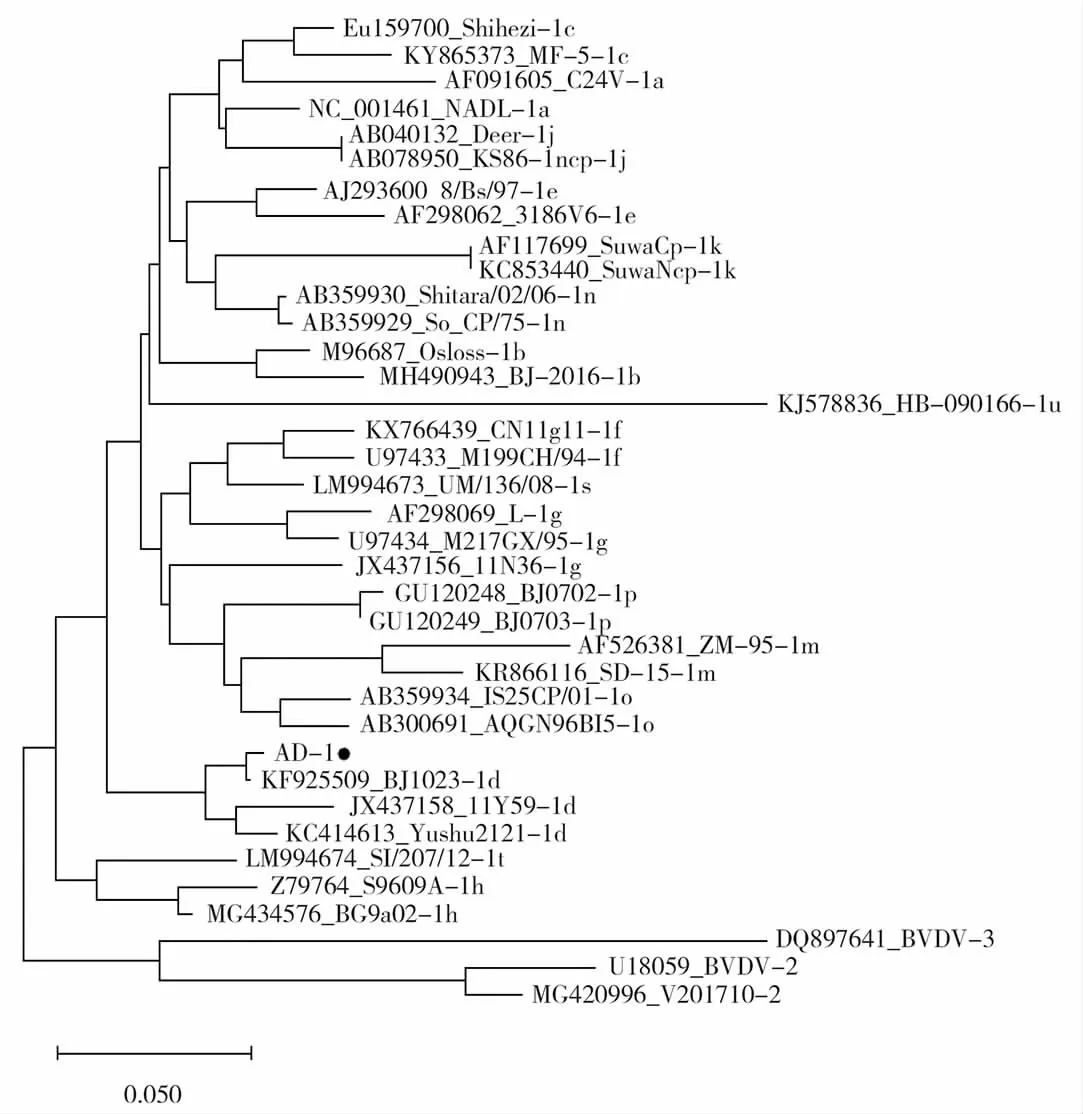
图3 BVDV 5’UTR基因核苷酸树状分析结果Fig.3 Nucleotide tree analysis of BVDV 5’UTR gene
3.2 BVDV E2基因分离鉴定
3.2.1E2基因PCR鉴定结果
以BVDVE2基因特异性引物(E2F/E2R)扩增出目的片段,片段大小约为1 400 bp,与预期的目的片段大小相符。确定所提取RNA为BVDV。(图4)
3.2.2 BVDVE2同源性分析结果
通过样本株AD-1E2基因序列与参考序列的比对可知,与BVDV-1的同源性为72.5%~97.3%,与BVDV-2的同源性为64.2%,与BVDV-3的同源性为61.8%。样品株AD-1与参考毒株中国北京株BJ1308(Genbank:KT951841)同源性最高为 97.3%,与其余1d两株参考毒株,中国兰州株ISO122(Genbank:KF048844) 和 韩 国 株 10JJ-SKR(Genbank:KC157383)的同源性均为97.1%。从进化树上可以看出,与北京株 BJ1308(Genbank:KT951841)同属一组,亲缘性较近(图5、图6)。

图4 E2基因PCR扩增结果Fig.4 E2 PCR results

图5 BVDV E2基因同源性分析结果Fig.5 BVDV E2 homology analysis results

图6 BVDV E2基因核苷酸树状分析结果Fig.6 Nucleotide tree analysis of BVDV E2 gen
3.2.3 BVDVE2基因推导氨基酸的理化性质分析
亲水/疏水性是黄病毒科病毒E2基因的一个重要特性[13]。对毒株AD-1的E2基因全长序列进行理化分析,从结果可知,E2亲水性与疏水性为整齐的间隔分布,亲水性与疏水性相邻排列。20~50、310~330为较大的疏水区,110~130、350~370这两个区段亲水性最大,总亲水性为-0.186,说明亲水性不强,不稳定性为33.62,该蛋白质可以分类为稳定的蛋白质。BVDV的含有很多带电荷的氨基酸残基,在病毒二聚体的形成中起着重要的作用[14]。此次分析中我们发现两个潜在的跨膜信号区域:30~50和410~420。负电荷残基总数(Asp+Glu):44个,带正电残基总数(Arg+Lys):47 个。(图 7、图 8、图 9)
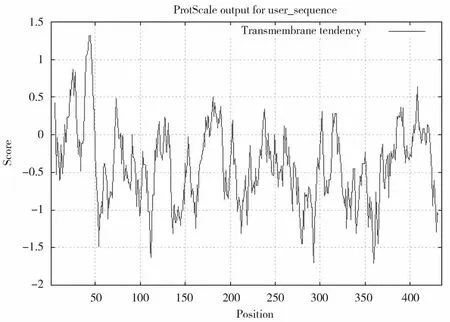
图7 分离株AD-1推导的氨基酸跨膜性分析Fig.7 Analysis of amino acid transmembrane deduced from isolate AD-1

图8 分离株AD-1推导的氨基酸柔性分析Fig.8 Amino acid flexibility analysis derived from isolate AD-1
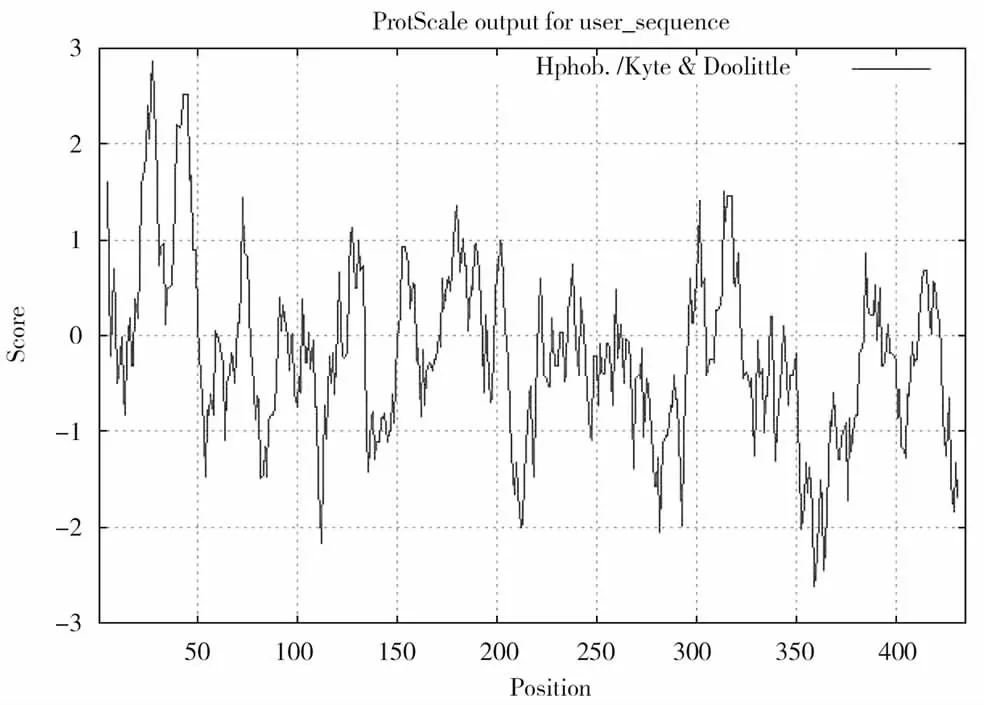
图9 分离株AD-1推导的氨基酸疏水性分析Fig.9 Amino acid hydrophobicity analysis derived from isolate AD-1
3.2.4 BVDVE2基因抗原表位分析
利用DNAStar软件中的Protean分析软件,对病毒株AD-1的E2核苷酸序列所推导的氨基酸序列进行抗原表位预测分析,并与其他参考株的氨基酸序列(其他参考株包括 BVDV-1、BVDV-2、BVDV-3)进行比对,来分析比较样本株和各毒株之间的差异。在分析结果中可知AD-1的E2基因的抗原表位与国际标准株 BVDV-1 NADL和 BVDV-2 890、BVDV-3 LVRI/cont-1的抗原表位存在一定差异。与瑞士毒株SuwaCp(Genbank:KC853441)的抗原表位部分优势走势一致[15]。(图 10)

图10 AD-1株与参考株E2基因抗原表位优势分析Fig.10 Epitope dominance analysis of E2 protein between AD-1 strain and reference strain
4 讨论
引起牛的症状比较复杂具有多样性,表现为持续感染(PI)、黏膜病、急性感染和繁殖障碍、免疫抑制[20]。将其概括为消化道型、呼吸道型、隐性感染和败血型。收集到的病料为肺部组织,生物型为致细胞病变型。通过IFA试验,使用FITC标记的羊抗鼠IgG为二抗进行荧光可以间接检测到病毒存在,进一步证明该毒株为BVDV阳性毒株。
对AD-1的5’UTR产物进行测序,将得到的序列进行同源性分析和进化树分析,结果显示,分离株AD-1的基因型为BVDV-1d型,与2018年北京株BJ1023(Genbank:KF925509)核苷酸同源性最高为99.5%,有着较近的进化距离,亲缘性最高。选取的5’UTR参考序列主要为中国地区已发表序列,国外序列作为补充。同时,扩增E2基因进行测序分析,根据分离株E2基因的同源性分析显示,样品株AD-1与参考毒株中国北京株 BJ1308(Genbank:KT951841)同源性最高为97.3%,进化树显示二者在参考序列中亲缘性最近,5’UTR与E2基因结果一致,均与BVDV-1d的同源性最高,所以进一步佐证毒株AD-1为BVDV-1d型。2014年郎一飞[9]在血清及细胞培养物中分离出了9种BVDV基因亚型,分别为1a、1b、1c、1d、1m、1o、1p、1q 及 2a,基本上涵盖了国内流行的基因亚型。
传统的生物学认为,蛋白质的序列决定了它的三维结构,也就决定了它的功能[16]。因此我们对E2基因序列进行理化性质分析,了解其亲/疏水性、柔性和是否存在跨膜,便于我们进一步了解E2基因的结构和功能。
目前,随着对BVDV基因组结构及功能的深入研究,有关 BVDV 基因分型、E2、NS2、NS3、Npro 等蛋白生物学功能以及BVDV影响宿主细胞基因表达机制的研究,都取得了一定程度的进展,为世界病毒学进一步研究BVDV的致病机制奠定了理论基础[12]。E2基因作为BVDV的主要保护性抗原蛋白,能够诱导动物机体产生中和抗体,且E2基因序列与其他蛋白相比也较为保守,因此有关BVDV的疫苗研究也主要以E2基因为核心来展开的[13-14]。瘟病毒科的主要抗原E2,其N端含有较多的种间共同抗原表位和种内特异抗原表位,通过对抗原表位分析图可以看到,BVDV-1和BVDV-2在抗原表位上差异性很大,而同一亚型的病毒在抗原表位的差别也不尽相同,说明在氨基酸排列上的差异很可能是造成不同分型的原因之一。
研究通过对爆发牛呼吸道型综合症的牧场采集到的样本,进行分子生物学方法检测,提取出了一株BVDV-1d毒株,可以为黑龙江地区BVDV毒株库的构建提供理论支持和参考依据。随着南方养殖业北移,黑龙江省近年来牛只流动量较大,这也意味着在黑龙江省没有检测出的基因型也许会因此途径进入,这对我们防控产生了更大的困难,而黑龙江省原有的主要流行毒株是否会因此发生改变还是未可知的,所以有必要对BVDV进行追踪了解,为进一步的防控提供数据支持。
