miR-10a-5p通过靶向RORA促进胃癌细胞侵袭、迁移
2020-11-06丁晓娇章海斌殷文博王子安
丁晓娇,章海斌,赵 报,殷文博,陈 莹,王子安*
(1蚌埠医学院第一附属医院肿瘤内科,蚌埠 233000;2蚌埠医学院第一附属医院耳鼻咽喉头颈外科;*通讯作者,E-mail:wangzian118@sina.com)
胃癌(gastric cancer,GC)是常见的消化道恶性肿瘤之一,全球肿瘤发病率中位居第六,死亡率位居第四[1]。目前胃癌治疗方式主要包括手术辅助化疗以及靶向治疗等,然而晚期胃癌患者总体预后仍旧较差,术后5年生存率不足30%[2],这与肿瘤的易复发、易转移特性密不可分。因此,寻找新的生物标志物和治疗靶点对胃癌的治疗具有重要意义。
微小RNA(microRNAs,miRNA)是一类内源性、进化保守的非编码RNA,通过与靶RNA的3′-UTR结合,导致靶mRNA的降解及其翻译抑制,调节细胞的多种基本生理过程如细胞增殖、细胞凋亡及肿瘤的发生发展[3-5]。多项研究证明,miR-10a-5p在胆管癌[6]、乳腺癌[7]、宫颈癌[8]等多种肿瘤中表达异常,参与调控其恶性生物学行为。然而,对于miR-10a-5p在胃癌侵袭迁移中的作用及其分子机制,研究仍旧较少。维甲酸受体相关孤儿受体A(RAR-related orphan receptor A,RORA)基因在人类染色体定位于15q22.2,是孤儿受体ROR子家族的成员之一。研究表明,RORA在肺癌[9]、肝癌[10]、卵巢癌[11]、皮肤黑色素瘤[12]等多肿瘤的发生发展中起着重要作用。本研究旨在探讨miR-10a-5p在胃癌的侵袭迁移中扮演的角色,为胃癌临床治疗寻找新的靶点。
1 材料与方法
1.1 细胞株与主要试剂
正常人胃黏膜上皮细胞GES-1、人胃癌细胞株(AGS、SGC-7901、BGC-823)购自IBS细胞资源中心;RPMI-1640培养基购自Hyclone公司;胎牛血清购自浙江天杭生物科技股份有限公司;BCA蛋白定量试剂盒及蛋白印迹(Western blot)试剂盒、100 U/ml青霉素和100 U/ml链霉素双抗均购自碧云天生物技术公司;miR-10a-5p inhibitor、NC、RORA过表达序列均购自上海吉玛基因有限公司;转染试剂Lipofectamine®2000购自ThermoScientific公司;一抗(β-actin、RORA、E-cadherin、N-cadherin、Snail)及辣根过氧化物酶标记的羊抗兔/鼠二抗均购于武汉三鹰生物技术公司;ECL显影液购于Abbkine公司;GAPDH引物、U6引物、miR-10a-5p、RORA引物均购自上海生工生物工程股份有限公司;Trizol、RNA逆转录试剂盒购自Thermo Scientific有限公司;TB Green TM Primix Ex Taq TM试剂盒购自日本TaKaRa公司;四甲基偶氮唑盐(MTT)购自Biofroxx公司。
1.2 细胞培养及实验分组
正常人胃黏膜上皮细胞GES-1、人胃癌细胞株(AGS、SGC-7901、BGC-823)培养于含100 U/ml青霉素、100 μg/ml链霉素、10%FBS的RPMI-1640培养基中,在37 ℃、5% CO2、饱和湿度培养箱中培养。倒置显微镜下观察细胞生长情况,48 h更换培养液。当细胞融合达到90%时,0.25%胰酶消化后传代,取传3代细胞进行后续实验。取传3代的SGC-7901细胞,胰酶消化后计数,细胞铺板,待细胞融合50%-80%时进行转染,转染步骤严格按照转染说明书进行。为了探讨miR-10a-5p是否通过靶向RORA对胃癌细胞侵袭、迁移产生影响及其机制,将SGC-7901细胞分为control组(只转染Lipofectamine®2000)、NC组(转染Lipofectamine®2000及NC序列,序列5′-CAGUACUUUUGUGUAGUACAA-3′)和miR-10a-5p inhibitor组(Lipofectamine®2000及miR-10a-5p inhibitor,序列5′-CACAAA-UUCGGAUCUACAGGGUA-3′)。通过qRT-PCR检测转染miR-10a-5p inhibitor后miR-10a-5p及RORA的相对表达水平;通过克隆形成实验检测miR-10a-5p inhibitor对细胞增殖能力的影响;Western blot检测β-actin、RORA、E-cadherin、N-cadherin、Snail蛋白的表达;miR-10a-5p对细胞侵袭和迁移的影响由Transwell实验检测。同时对SGC-7901转染RORA过表达序列,方法如上,实验分为control组(只转染Lipofectamine®2000)、NC组(转染Lipofectamine®2000及NC序列)和RORA过表达组(转染Lipofectamine®2000及RORA过表达序列)。通过Transwell实验检测RORA对细胞侵袭和迁移的影响。
1.3 实时荧光定量PCR检测miR-10a-5p及RORA相对表达
0.25%胰酶消化收集实验组及对照组细胞,用Trizol提取细胞内总RNA,将提取的RNA用RNA反转录试剂盒说明反转录RNA为cDNA,合成的cDNA用TB GREEN试剂盒通过PCR仪进行PCR扩增,以U6为内参检测miR-10a-5p在正常胃黏膜细胞GES-1及GC细胞株AGS、SGC-7901、BGC-823中的表达水平。分别以U6与GAPDH为内参检测miR-10a-5p及RORA相对表达量,最终Ct值采用2-ΔΔCt进行分析,引物序列见表1。

表1 PCR扩增引物序列
实时荧光定量PCR采用两步法PCR扩增标准程序。stage 1:预变性(95 ℃,30 s),Stage 2:PCR反应(95 ℃,5 s;60 ℃,30 s),共40个循环,采用2-ΔΔCt法计算miR-10a-5p相对表达量,所有试验均重复3次。
1.4 Western blot检测β-actin、RORA、E-cadherin、N-cadherin、Snail蛋白的表达
0.25%胰酶消化收集SGC-7901细胞,分别加入适量RIPA细胞裂解液(含0.1%蛋白酶抑制剂),置于冰上裂解30 min,将细胞裂解液转移至1.5 ml离心管中,-20 ℃冰箱过夜,次日4 ℃、12 000 r/min离心30 min,收集上清液,BCA法进行蛋白定量。分别取50 μg蛋白进行SDS-PAGE,恒压100 V 70 min,冰浴转膜至PVDF膜上;快速封闭液封闭15 min;加入按1 ∶1 000稀释的一抗(β-actin、RORA、E-cadherin、N-cadherin、Snail),4 ℃摇床孵育过夜;次日,TBST洗膜3次,加入辣根过氧化物酶标记的羊抗兔/鼠二抗(1 ∶5 000)室温孵育2 h;TBST洗涤3次,ECL化学发光显像。以β-actin为内参,采用Image J图像分析软件计算目的蛋白相对表达量。
1.5 靶基因检测及验证
根据生物信息学软件Target Scan预测miR-10a-5p和RORA 3′ UTR存在结合位点,提示RORA可能是miR-10a-5p的直接靶基因。为证实该推测,研究通过qRT-PCR及Western blot分别检测RORA mRNA及蛋白表达水平,实验分组及方法如1.2-1.4。
1.6 克隆形成实验检测增殖能力
收集转染后control组、NC组、转染miR-10a-5p inhibitor组细胞,胰酶消化后用RPMI-1640培养基重悬,以1 000个/孔密度接种于6孔板中,37 ℃、5% CO2、饱和湿度培养箱中培养2周。弃去培养基,用PBS洗涤2遍,加入4%多聚甲醛,-20 ℃固定10 min,结晶紫染色,静置20 min,使用4 ℃预冷的双蒸水洗涤,室温下晾干,拍照并记录结果。
1.7 Transwell实验检测miR-10a-5p对细胞侵袭和迁移的影响
Transwell实验用来分别检测miR-10a-5p对胃癌细胞侵袭及迁移能力的影响。检测侵袭能力时,将Materigel胶与Opti按1 ∶8的比例稀释,每孔加入60 μl的Materigel胶均匀覆盖Transwell小室底部,培养60 min。取转染后control组、NC组、转染miR-10a-5p inhibitor组细胞,胰酶消化后用无血清1640培养基重悬,调整至5×104个/孔密度加入到Transwell小室上室中,下室加入600 μl含10% FBS的1640培养基,37 ℃培养48 h。用润湿的棉签小心擦去小室上层细胞并用双蒸水洗涤,在24孔板中每孔加入600 μl的4%多聚甲醛固定15 min,结晶紫染色20 min,双蒸水洗涤后室温晾干,100倍显微镜下随机选取5个视野拍照记录,Image J软件进行计数,细胞数取平均值。迁移实验不铺胶,其余操作同侵袭实验相同。
1.8 转染RORA过表达序列对细胞侵袭和迁移的影响
为进一步验证miR-10a-5p靶向调控RORA的表达是否影响SGC-7901细胞增殖、侵袭和迁移,本研究设RORA OE转染组control组(只转染Lipofectamine®2000)、RORA NC转染组(转染Lipofectamine®2000及NC序列)、RORA过表达组(Lipofectamine®2000及RORA过表达序列)。转染48 h采用Transwell实验检测RORA对SGC-7901细胞侵袭和迁移能力的影响,方法同1.7。
1.9 统计学分析
所有试验重复3次,采用SPSS 21.0软件进行统计分析,结果以均数±标准差表示,多组间比较采用单因素方差分析,组间两两比较则采用LSD-t检验。P<0.05表示差异有统计学意义。
2 结果
2.1 miR-10a-5p在GC细胞中的表达
qRT-PCR检测结果显示,与正常人胃黏膜上皮细胞GES-1相比,miR-10a-5p在不同GC细胞(AGS、SGC-7901、BGC-823)中的表达量有不同程度的升高,其中在SGC-7901细胞中表达量最高,差异具有统计学意义(P<0.05,见图1),故选择该细胞株进行后续实验。
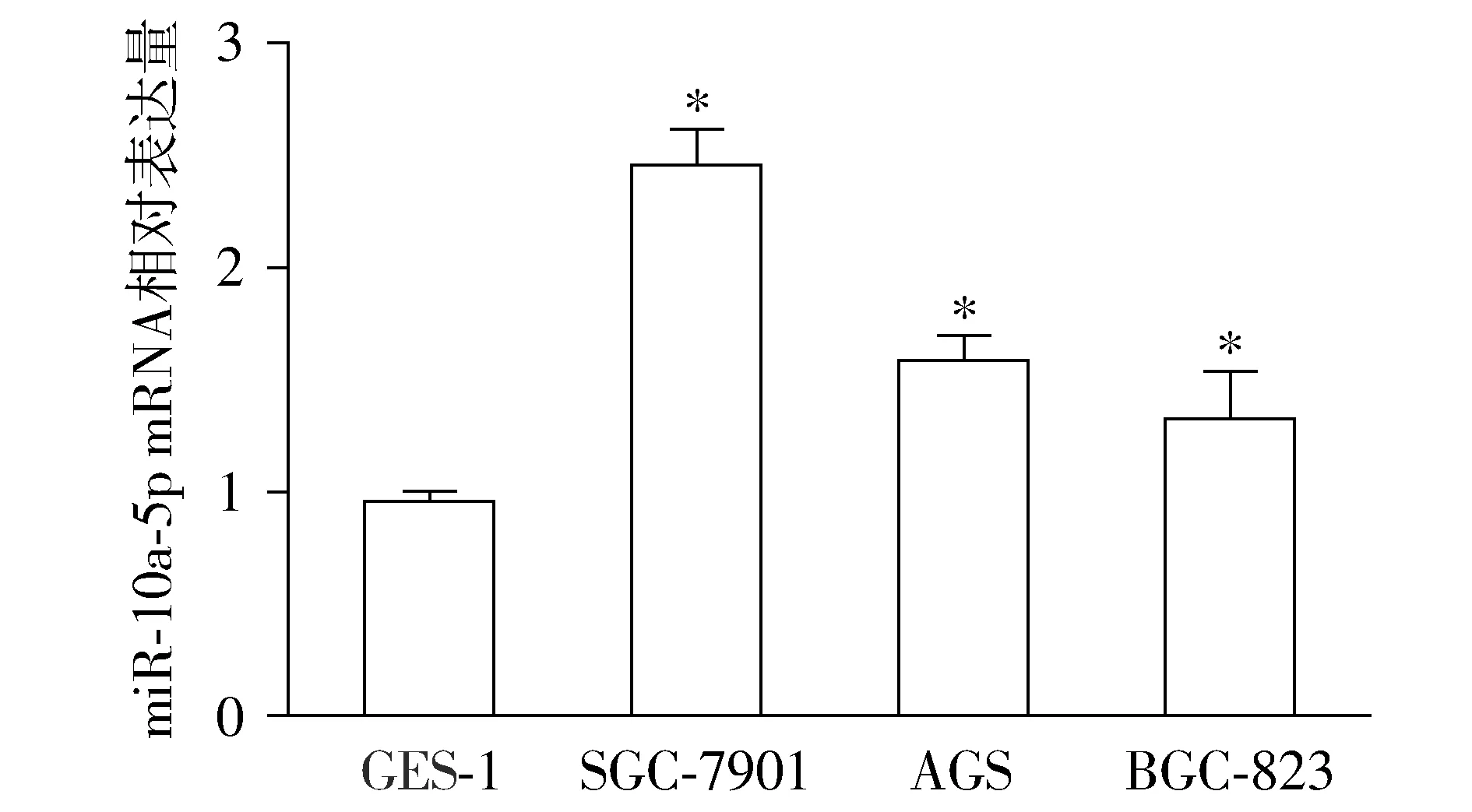
与GES-1细胞相比,*P<0.05图1 miR-10a-5p在不同胃癌细胞株中表达量的比较Figure 1 Expression of miR-10a-5p in different gastric cancer cell lines
2.2 转染miR-10a-5p inhibitor对SGC-7901细胞中miR-10a-5p表达的影响
qRT-PCR检测结果显示,miR-10a-5p inhibitor转染组SGC7901细胞中miR-10a-5p的表达量显著低于control组和NC组,差异具有统计学意义(P<0.05,见图2)。

与control组及NC组比较,*P<0.05图2 转染miR-10a-5p inhibitor对SGC-7901细胞中miR-10a-5p表达的影响Figure 2 Effect of miR-10a-5p inhibitor on miR-10a-5p expression in SGC-7901 cells
2.3 miR-10a-5p靶向调控RORA
生物信息学软件Target Scan预测结果显示,RORA 3′UTR上存在潜在的与miR-10a-5p靶向结合的位点(见图3A),说明RORA可能是miR-10a-5p的靶基因。qRT-PCR结果显示,在胃癌细胞SGC-7901中RORA mRNA表达水平miR-10a-5p inhibitor转染组相较于control及NC组升高,差异具有统计学意义(P<0.05,见图3B)。Western blot结果显示,相较于control及NC组,miR-10a-5p inhibitor转染组SGC-7901细胞中RORA蛋白表达水平升高,差异具有统计学意义(P<0.05,见图3C)。
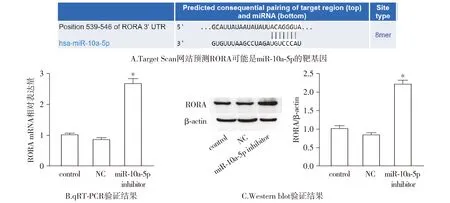
与control组及NC组相比,*P<0.05图3 RORA是mir-10a-5p的靶基因Figure 3 RORA is the target gene of mir-10a-5p
2.4 转染miR-10a-5p inhibitor对SGC-7901细胞迁移能力的影响
为了解下调miR-10a-5p对SGC-7901细胞侵袭迁移能力的影响,实验分为control组、NC组、miR-10a-5p inhibitor组,Transwell实验结果显示,转染48 h时miR-10a-5p inhibitor组穿膜细胞数目显著低于control组和NC组,差异有统计学意义(P<0.05,见图4)。结果表明,下调miR-10a-5p能抑制SGC-7901细胞侵袭、迁移能力。

与control组及NC组比较,*P<0.05图4 miR-10a-5p对胃癌细胞SGC-7901侵袭、迁移能力的影响 (×100)Figure 4 The effect of miR-10a-5p on invasion and migration abilities of gastric cancer cell line SGC-7901 (×100)
2.5 转染miR-10a-5p inhibitor对SGC-7901细胞增殖的影响
集落克隆结果显示,相对于control组及NC组,miR-10a-5p inhibitor组集落形成数目下降,差异具有统计学意义(P<0.05,见图5),证明下调miR-10a-5p可抑制SGC-7901细胞增殖能力。

与control组及NC组比较,*P<0.05图5 miR-10a-5p对胃癌细胞SGC-7901增殖能力的影响Figure 5 The effect of miR-10a-5p on the proliferation ability of gastric cancer cell SGC-7901
2.6 过表达RORA对SGC-7901侵袭、迁移能力的影响
Transwell实验结果显示,过表达RORA后48 h RORA过表达组穿膜细胞数少于control组和NC组,差异有统计学意义(P<0.05,见图6)。结果提示,过表达RORA能够显著抑制SGC-7901细胞侵袭、迁移能力。

与control组及NC组比较,*P<0.05图6 过表达RORA对胃癌细胞SGC-7901侵袭迁移能力的影响 (×100)Figure 6 Effect of overexpressing RORA on invasion and migration of gastric cancer cell line SGC-7901 (×100)
2.7 下调miR-10a-5p对SGC-7901细胞EMT相关蛋白E-cadherin、N-cadherin、Snail蛋白表达的影响
Western blot结果显示,miR-10a-5p inhibitor组N-cadherin、Snail的蛋白表达低于control和NC组。相反,E-cadherin在miR-10a-5p inhibitor组中的表达高于control和NC组,差异具有统计学意义(P<0.05,见图7)。
3 讨论
目前,胃癌治疗仍旧首选以手术为主的综合治疗,然而其死亡率仍旧较高,这与胃癌的复发与转移有着密不可分的关系[13]。因此,寻找胃癌治疗的新靶点,进而减少或者抑制侵袭与转移是改善胃癌患者预后,提升患者生存率的重要条件。
近年来研究发现同时靶向关键调节基因和异常表达的miRNA可能是预防恶性肿瘤转移的有效策略,因此miRNA可充当一种有效的分子靶向药物对肿瘤进行治疗[14]。据报道,miR-10a-5p在多种癌症的发生进展中起着重要的作用。有研究证明miR-10a-5p在胰腺导管腺癌(pancreatic ductal adenocarcinoma,PDAC)中过表达并作为转移形成的重要介质[15]。Yu等[16]发现miR-10a-5p在非小细胞肺癌(non-small cell lung cancer,NSCLC)中呈过表达并靶向PTEN促进肿瘤的增殖、侵袭和迁移。Gao等[17]提出抑制miR-10a-5p可通过下调Akt途径抑制胆管癌细胞的生长,而miR-10a-5p在胃癌中的表达及作用有待研究。
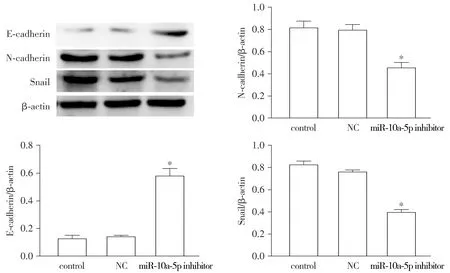
与control组及NC组比较,*P<0.05图7 SGC-7901细胞下调miR-10a-5p对EMT相关蛋白E-cadherin、N-cadherin、Snail蛋白表达的影响Figure 7 Effect of down-regulating miR-10a-5p on the expression of EMT-related proteins E-cadherin, N-cadherin and Snail in SGC-7901 cells
本实验通过qRT-PCR检测结果显示,与正常人胃黏膜上皮细胞GES-1相比,miR-10a-5p在不同GC细胞中的表达量显著上调。研究证明,miRNA参与肿瘤生物学行为取决于其下游靶点[18]。通过生物信息学软件Target Scan预测RORA可能为miR-10a-5p的潜在靶基因。后续通过qRT-PCR及Western blot验证结果显示,转染miR-10a-5p inhibitor可在蛋白水平及mRNA水平负向调控RORA。本研究集落克隆和Transwell实验结果显示,下调SGC-7901细胞中的miR-10a-5p能够显著抑制SGC-7901细胞的增殖、迁移与侵袭。然而其作用机制尚不清晰。同时,本研究在SGC-7901中过表达RORA发现,过表达RORA可抑制胃癌细胞SGC-7901的侵袭与迁移能力。因此,我们认为miR-10a-5p能够靶向RORA调控SGC-7901侵袭、迁移。RORA是孤儿受体ROR子家族的成员,在各种生物过程中(包括小脑发育,细胞增殖和昼夜节律控制)以及自身免疫、肥胖、肿瘤中充当核受体转录因子[19-21]。RORA已被报告在人胃癌组织与胃癌细胞系中低表达,而且RORA的减少与肿瘤进展和胃癌预后不良有关[22]。研究证明,在胶质瘤中RORA是miR-10a的靶基因,并通过激活NF-κB通路进一步增强髓系来源的抑制性细胞(myeloid-derived suppressor cells,MDSC)活性[23]。
EMT(epithelial-mesenchymal transition,EMT)指上皮细胞特性逐渐消失,而逐渐表现出间质细胞特性的过程。研究证明,EMT与癌细胞的高侵袭性和转移密切相关[24]。越来越多的证据表明miRNAs通过调节EMT过程,在某些肿瘤的发生发展过程中,发挥促癌基因或抑癌基因的作用,参与侵袭和转移过程[25-27]。为了确定下调miR-10a-5p抑制SGC-7901细胞侵袭和迁移的机制,本研究采用Western blot法检测下调miR-10a-5p后与EMT相关的蛋白E-cadherin、N-cadherin和Snail的表达,结果显示,E-cadherin表达显著升高,而N-cadherin、Snail表达显著降低,提示下调miR-10a-5p可通过EMT途径抑制胃癌细胞SGC-7901侵袭和转移。
综上所述,下调miR-10a-5p可通过上调靶基因RORA表达抑制胃癌细胞的迁移和侵袭能力,其机制为通过EMT途径促进胃癌细胞侵袭和转移,所以miR-10a-5p可能是胃癌治疗的潜在分子靶点,因此在此基础上探索新型核酸药物的研发,可能为胃癌的诊断和治疗带来积极的意义。
