ANCA相关血管炎并发肥厚性硬脊髓膜炎6例临床特点
2020-11-06承飞周佳鑫彭琳一赵久良张莉曾小峰田新平
承飞,周佳鑫,彭琳一,赵久良,张莉,曾小峰,田新平
肥厚性硬膜炎(hypertrophic pachymeningitis, HP)是一类以硬脑膜/硬脊髓膜慢性炎性肥厚性病变为突出表现的罕见疾病。HP可根据病因分为特发性和继发性;按受累部位分类,HP可分为肥厚性硬脑膜炎(hypertrophic cranial pachymeningitis, HCP)和肥厚性硬脊髓膜炎(hypertrophic spinal pachymeningitis, HSP)。目前已报道可导致HSP的疾病包括感染性疾病(梅毒螺旋体、结核分枝杆菌、1型人T细胞淋巴病毒等)[1-3],自身免疫性疾病(IgG4相关疾病、ANCA相关血管炎、结节病、系统性红斑狼疮、干燥综合征)[4-9]和其他疾病(重链病、粘多糖病等)[10-11]。
ANCA相关血管炎(ANCA-associated vasculitis, AAV)是一类以小血管炎为主的多系统自身免疫性疾病,中枢神经系统受累相对少见,累及硬脊髓膜者极罕见[12-15]。AAV累及硬脊髓膜,表现为硬脊髓膜肥厚压迫脊髓节段,进而出现脊髓功能受损。本文回顾性分析2014年1月至2020年1月北京协和医院风湿免疫科收治的6例AAV并发HSP患者的临床特点,以指导临床诊断和治疗。
1 对象与方法
1.1 研究设计及研究对象
回顾性分析2014年1月至2020年1月于北京协和医院风湿免疫科住院患者,诊断均符合2012年Chapel Hill系统性血管炎分类标准[16],且同时符合HSP诊断的患者,均排除了其他常见继发HP的病因,例如梅毒、结核、IgG4相关疾病、肿瘤等。收集患者的临床症状、实验室检查、影像学检查(增强核磁共振、正电子发射计算机断层显像)与治疗资料,并对患者进行随访,随访时间截至2020年2月。HSP临床诊断包括患者存在相关硬脊髓膜病变所致神经系统症状,增强MRI提示节段性硬脊髓膜增厚伴强化。同时应用伯明翰血管炎活动度评分(Birmingham Vasculitis Activity Score, BVAS)对血管炎的疾病活动度进行评价[17]。
1.2 临床疗效
治疗反应评价基于临床症状(完全缓解,部分缓解,病情稳定,病情进展),实验室检查[血沉(ESR)、C反应蛋白(CRP)、抗中性粒细胞胞浆抗体(ANCA)]及影像学改变(好转、稳定、进展)(表1)。
1.3 统计学分析
按描述性统计学方法进行资料分析,非正态分布资料用中位数及四分位数表示,正态分布资料用平均值及标准差表示。应用SPSS26.0软件进行数据分析。
2 结果
2.1 一般情况
入选的6例患者均为女性,AAV起病年龄中位数为50.5(26~66)岁,病程(从首次出现症状到确诊AAV)中位数18(4.5~39.7)个月,均为初次诊断的HSP。4例患者以HSP相关神经系统症状起病,另2例患者由AAV起病到出现HSP的时间分别为19个月和4个月。6例患者中肉芽肿性多血管炎(GPA)1例,未分类AAV 5例。2例患者并发甲状腺功能亢进,有长期服用丙硫氧嘧啶(propylthiouracil,PTU)史。患者一般情况见表2。
2.2 临床特点
主要临床表现:发热(4/6),乏力(4/6),神经系统症状(6/6)。神经系统症状中以颈肩及腰背部疼痛(5/6)、感觉麻木(5/6)最多见,少数患者可出现排尿排便困难(1/6)、不完全性截瘫(1/6)。50%(3/6)的患者有肺间质病变,33%(2/6)的患者有肾脏受累,眼、耳鼻喉、皮肤/黏膜等受累情况见表3。
2.3 实验室检查
就诊时5例患者有炎症指标显著升高。6例患者ANCA均阳性,间接免疫荧光法均提示为核周型ANCA(pANCA),酶链免疫吸附法(ELISA)均为髓过氧化物酶(MPO)-ANCA,其滴度平均值为(81±61)RU/mL,其中1例患者同时合并蛋白酶3(PR3)-ANCA升高(滴度30 RU/mL)。6例患者血清IgG4水平均正常,抗核抗体(ANA)谱及抗可溶性核抗原(ENA)抗体谱均为阴性。6例患者均进行了脑脊液检查,结果显示脑脊液压力中位数为152.5(120~185)mm H2O,脑脊液蛋白中位数为13.95(1.36~36.08)g/L,脑脊液细胞学分析提示白细胞中位数为1 066(650~1 400)/0.5mL,其中以淋巴细胞为主82.5(77.5~91.25)%,5例患者存在脑脊液异常淋巴细胞激活现象,4例患者送检脑脊液寡克隆区带均为阳性。脑脊液检查均未见感染及肿瘤疾病征象(表2、3)。
2.4 影像学及病理检查
6例患者均进行了受累脊髓节段增强核磁共振检查,结果显示受累脊髓节段硬脊髓膜异常增厚伴强化,增厚的硬脊髓膜在T1WI主要呈低或等信号,在T2WI主要呈低或等信号,受累节段多位于颈胸椎,受累范围4~14个节段不等(图1、2)。2例患者行正电子发射计算机断层显像(PET/CT)检查显示受累脊髓节段硬脊髓膜异常摄取增高(图3)。1例患者行脊髓C1~C3水平椎管内占位性病变切除术,病变组织病理提示为慢性炎症伴肉芽肿形成。
2.5 治疗及转归
6例患者均接受了大剂量糖皮质激素[相当于泼尼松≥1 mg/(kg·d)]治疗。3例患者接受甲泼尼龙1 g/d×3 d冲击治疗,其中1例患者因病程
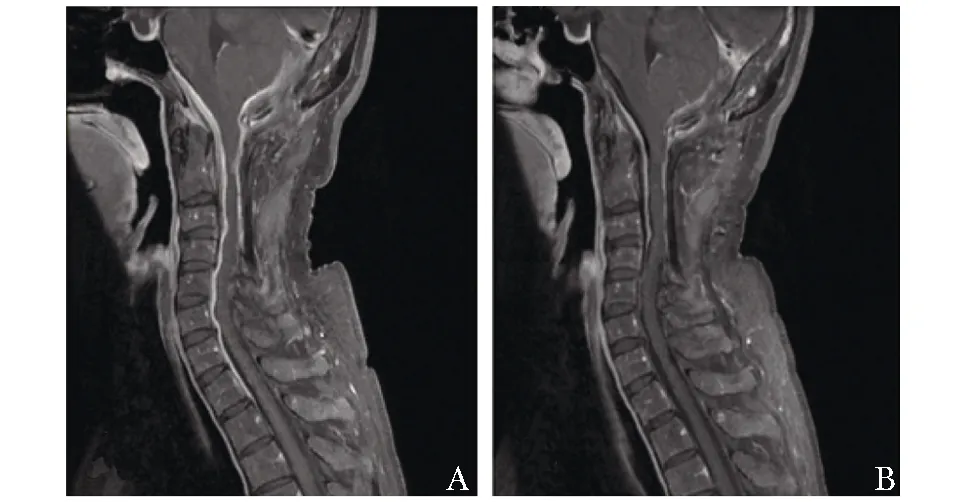
图 1 患者1颈椎增强MRI图像Fig 1 Contrast-enhanced MRI image of patient 1 A:治疗前; B:治疗后
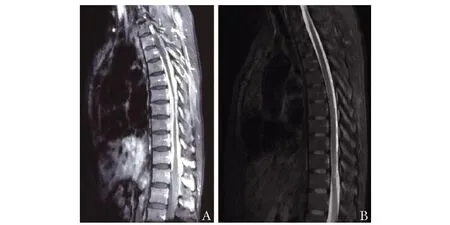
图 2 患者4胸椎MRI图像Fig 2 MRI image of patient 4 A:治疗前; B:治疗后
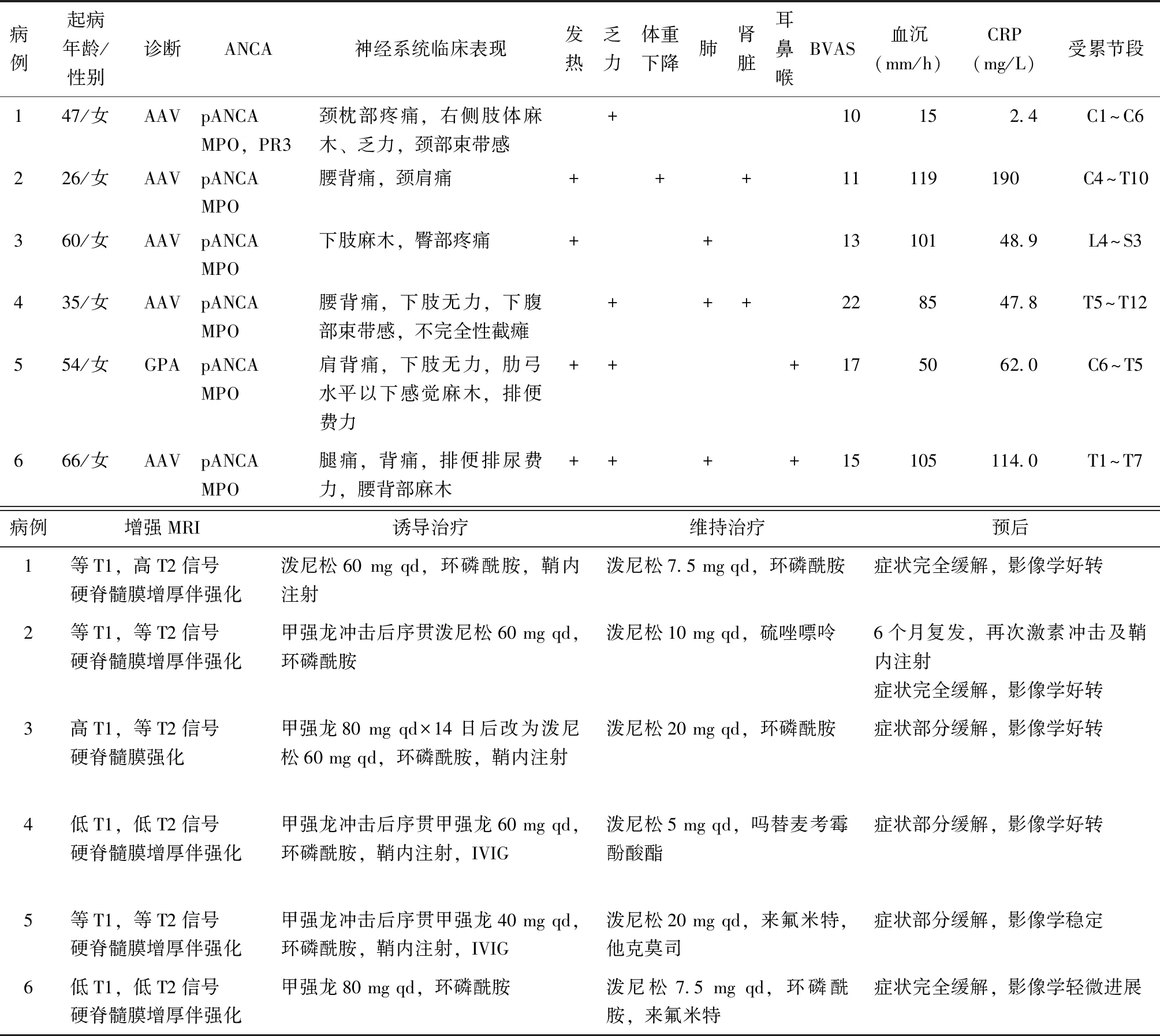
表3 AAV并发HSP患者临床资料Table 3 Clinical manifestation, spinal imaging, treatment and prognosis of 6 patients of AAV with HSP
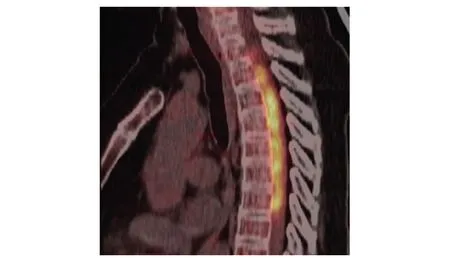
图 3 患者6治疗前PET/CT图像Fig 3 PET/CT image of patient 6
3 讨论
AAV是一类以小血管炎症为病理基础、以多器官受累为特征的自身免疫性疾病,以血中可检测到抗中性粒细胞胞浆抗体(ANCA)为突出的血清学特征。AAV可分为肉芽肿性多血管炎(GPA),显微镜下多血管炎(MPA),嗜酸性肉芽肿性多血管炎(EGPA)和未分类AAV[18]。AAV可累及多个系统,包括皮肤、肾脏、呼吸道、外周神经、胃肠道等,较少累及中枢神经系统[16]。AAV中枢神经系统受累多表现为肥厚性硬脑膜炎,但累及脊髓者罕见。日本一项针对肥厚性硬膜炎的全国性调查研究显示,继发性肥厚性硬膜炎中,AAV和IgG4相关疾病是主要病因(分别占34%和8.8%)[19],但该研究未涉及仅累及硬脊髓膜患者。
因AAV并发HSP病例极罕见,目前国际报道仅13例[8,12-15,20-21,34],多为个案报道。本研究为该类患者首个单中心病例系列报道,入选的6例患者均通过2007年EMA的AAV诊断流程得以确诊。患者均出现显著的神经系统受累症状,增强核磁共振提示存在硬脊髓膜增厚伴强化。虽然病变组织活检病理是诊断HSP的金标准,但因行硬脊髓膜活检风险高,可行性低。本研究仅1例患者行病变组织活检,其他患者均通过无创检查的方法在充分除外了感染性疾病、肿瘤性疾病及其他自身免疫性疾病后确诊。本研究中的患者经过激素和免疫抑制剂治疗后情况好转,且在长期随访过程中未发现感染、肿瘤等其他疾病的证据,支持AAV继发HSP的诊断。2例患者接受了PET/CT检查,硬脊髓膜病变部位存在异常代谢摄取增高,提示炎症状态。虽然PET/CT对于鉴别硬脊髓膜良恶性病变存在一定局限性,但仍不失为较好的无创检查手段,现有报道利用PET/CT协助诊治的HSP患者多为IgG4相关疾病并发HSP[22-23]。本研究首次描述了AAV相关HSP患者硬脊髓膜病变的PET/CT特点,有助于HSP的诊断及鉴别诊断。既往鲜有研究报道AAV并发HP同时出现HCP和HSP[19,24],本研究中仅有1例患者同时并发有硬脑膜炎(幕下硬脑膜强化增厚),受累部位与颈椎硬脊髓膜炎病变处相连续,该例患者MPO-ANCA、PR3-ANCA均阳性,椎管内病变病理示慢性炎症伴肉芽肿形成。
本研究中6例患者均为女性,多为中老年起病,较少出现其他AAV常见受累系统受累表现,全部6例患者ANCA检查均为pANCA阳性及MPO-ANCA升高(1例并发PR3-ANCA升高),与既往研究结论[20,25]一致。有研究显示GPA并发HP患者中MPO-ANCA阳性率高于PR3-ANCA[19,25],仅MPO-ANCA阳性的HP患者有硬脊髓膜受累,提示可能存在一类以MPO-ANCA阳性为特征的局限中枢神经系统受累的血管炎亚型[25]。既往研究显示AAV并发硬脊髓膜炎患者中GPA最多见(61%)[15,20-21],本研究以未分类AAV最多见(83%),可能的原因为此类患者起病时除中枢神经系统外其他系统受累不显著,且硬脊髓膜病变活检率偏低(17%),因此进一步明确AAV亚型可行硬脊髓膜病变组织活检并长期随诊观察。脑脊液检查提示患者均存在明显的非特异性炎症表现。脑脊液蛋白升高突出(最高可达42g/L),偶见脑脊液呈胶冻状,考虑由椎管受压脑脊液循环不畅所致。全部6例患者对激素及免疫抑制剂治疗反应良好,不同于特发性HSP[26],AAV并发HSP多数患者不需要进行手术治疗且长期疗效稳定。该类患者症状集中于神经系统,起病时炎症反应明显,提示临床医生在遇到硬脊髓膜受累的患者时,应注意筛查炎症指标和ANCA,以除外AAV的可能性。
PTU是诱导产生AAV的最常见药物[27]。有研究纳入260例抗甲状腺药物相关AAV患者,应用PTU患者的ANCA抗体谱阳性率在4%到64%[28]。应用抗甲状腺药物后出现ANCA阳性患者中约15%会出现血管炎相关临床表现,其中肾脏受累最常见。本研究中2例患者有甲状腺功能亢进病史,分别服用PTU 8年和9年,均存在肾脏受累,考虑PTU诱导AAV诊断明确。停用PTU,并予AAV相关治疗,患者AAV病情可长期控制稳定。针对AAV患者应当注意有无抗甲状腺药物长期应用史,治疗时应注意去除诱发AAV的药物因素。
AAV存在重要组织脏器受累时常选用激素联合环磷酰胺或激素联合利妥昔单抗治疗,严重危及生命时可联合血浆置换[29-30]。对于AAV并发HP患者,有研究认为大剂量激素联合环磷酰胺有助于改善预后,减少复发[25,31-32]。另有研究显示,应用利妥昔单抗对于病情复发患者有利于实现病情缓解[33]。本研究全部6例患者均接受大剂量激素联合环磷酰胺治疗,其中5例患者同时接受了鞘内注射地塞米松单药或联合甲氨蝶呤治疗。1例患者随访过程中有影像学进展,无临床症状复发,该患者未行激素冲击治疗,且因腰椎穿刺困难未行鞘内注射治疗,可能影响了治疗效果。从随访情况看,对于这类患者在经过积极诱导缓解治疗后,预后相对良好,提示大剂量激素联合环磷酰胺治疗仍为这类患者治疗的首选,诱导缓解阶段可联合鞘内注射治疗。
既往文献报道了3例AAV并发HSP患者行硬脊髓膜病变切除减压术联合激素+免疫抑制剂药物治疗实现病情缓解[8,12,14];另有报道中2例未进行减压手术仅予激素+免疫抑制剂治疗,1例患者病情得到缓解,另1例则出现病情复发[13,34]。本研究纳入的6例患者均未行减压术,通过给予及时合理的药物治疗(激素+免疫抑制剂)可实现病情长期控制稳定,提示对于这类患者内科治疗效果良好,手术并非优先的选择,但对于诊断困难且神经系统症状进行性加重时可考虑手术治疗。
综上,HSP可为AAV的罕见表现。对于临床出现硬脊髓膜受累并发炎症指标显著升高的患者,应注意排除AAV。大剂量糖皮质激素联合环磷酰胺治疗仍为AAV并发HSP的一线方案,鞘内注射地塞米松联合甲氨蝶呤有助于控制病情,经积极激素和免疫抑制剂治疗后患者的预后整体良好。
