B型药物不良反应的发病机制
2020-11-06曾霓骆丹
曾霓,骆丹
药物不良反应(adverse drug reactions,ADRs)在临床工作中十分常见,发病率约为6%~10%。药理学上分为两种基本类型:A型和B型。A型是由药物的药理学作用引起的不可预测的反应,包括毒性作用、副作用和药物相互作用。B型药物不良反应主要由寄主遗传学因素决定,是不依赖剂量、不可预测的药物超敏反应,由免疫介导的药物不良反应和非免疫介导药物不良反应组成。免疫介导的药物不良反应(immune-mediated adverse drug reactions, IM-ADR)属于B型药物不良反应,占所有药物不良反应的20%以下[1],涉及IgE或T淋巴细胞的参与。根据Gell和Coombs分类将免疫介导的药物过敏分为B细胞介导(抗体介导, Ⅰ~Ⅲ型)和T细胞介导(迟发型超敏反应, Ⅳ型)反应[2](图1)。Ⅰ型反应是由IgE介导的即刻反应,通常在给药后1 h内发生,主要引起荨麻疹、血管水肿、支气管痉挛、瘙痒和过敏[3]。Ⅳ型反应由T淋巴细胞介导,可分为4个亚型(Ⅳa~Ⅳd型)。Ⅳa型的超敏反应涉及单核细胞活化,通常表现为湿疹或接触性皮炎;Ⅳb型包括嗜酸性粒细胞增多伴多器官受累;Ⅳc型包括CD4+或CD8+T细胞介导的细胞毒性导致组织坏死,表现为史蒂文斯约翰逊综合征/中毒性表皮坏死松解症(Stevens-Johnson syndrome/toxic epidermal necrolysis SJS/TEN);Ⅳd型是由中性粒细胞浸润和活化引起的,表现为急性泛发性发疹性脓疱病(acute generalized exanthema-tous pustulosis,AGEP)。本文对B型药物不良反应的发病机制、遗传因素以及临床应用进展进行综述,旨在更好地预防和管理药物不良反应。

图 1 药物不良反应分类
1 B型药物不良反应发病机制
1.1 IgE介导的速发型药物过敏反应
IgE型ADRs是由药物通过半抗原/载体复合物引起的免疫脱颗粒反应。药物过敏原与肥大细胞、嗜碱性粒细胞表面的特异性IgE结合,导致细胞脱颗粒,从而释放各种炎症介质如组胺、白三烯、前列腺素和细胞因子。脱颗粒主要以逐步脱颗粒和过敏性脱颗粒两种形式出现[4]。逐步脱颗粒是通过嗜碱性粒细胞上CD203c的上调介导的,从含有组胺的颗粒中形成小囊泡迅速到达质膜上,从而引起更加严重的药物不良反应。过敏性脱颗粒是通过嗜碱性粒细胞表面CD63介导的,含有组胺的颗粒与质膜融合后,将颗粒的全部内容物释放到细胞。这两种脱颗粒形式均与药物不良反应的严重程度有关。
1.2 T细胞介导的迟发型药物过敏反应
T细胞介导的迟发型药物过敏反应病理机制主要包括:在抗原识别或Fas/FasL相互作用下激活特异性T淋巴细胞或自然杀伤细胞,以及各种细胞毒蛋白,包括穿孔素/颗粒酶B和颗粒溶素,然后释放攻击角质形成细胞或其他细胞,导致皮疹或表皮坏死。此外,一些其他细胞因子/趋化因子,包括TNF-α、IFN-γ、GM-CSF、TARC/CCL17、IL-6、IL-8/CXCL8、IL-15和IL-36也参与药物超敏反应的免疫反应[5]。药物作为外来抗原,通常因其分子量太小而无法引起免疫应答,故需与组织形成复合物(the major histocompatibility complex,MHC)来发生免疫应答反应。目前已知3种关于药物-组织复合物相互作用的假说模型,用于解释药物作为抗原如何与人类白细胞抗原(human leukocyte antigen, HLA)和T细胞受体(T cell receptor,TCR)相互作用[6]。
(1)半抗原/半抗原前体模型:半抗原通常是由小分子药物与蛋白质结合,而半抗原前体分子需通过代谢与蛋白质成为化学活性化合物,它们均通过HLA分子形成复合物提呈给抗原交给细胞处理、加工后, 启动免疫反应。青霉素过敏就属于半抗原模型,它与血清白蛋白结合,经过细胞内处理产生肽类复合物引发免疫反应。
(2)药物与免疫受体间的直接药理学作用模型:该模型是指药物以天然形式与抗原提呈细胞的免疫受体(TCR或HLA)非共价结合,不经过抗原提呈,直接导致免疫反应。在卡马西平诱导的SIS/TEN模型中[7],卡马西平直接与HLA-B*15∶02等位基因编码的蛋白质结合;别嘌呤醇通过与HLA-B*58∶01直接作用,激活药物特异性T细胞[8]。利多卡因、拉莫三嗪都是通过该途径直接激活T细胞诱导产生免疫反应。
(3)改变的肽库模型:药物直接连接到 MHC蛋白的共价槽上,这种结构上的改变可导致细胞毒性T细胞的活化,继而引发一系列免疫应答反应。在阿巴卡韦诱导的超敏反应中,阿巴卡韦与HLA-B*57∶01形成复合物,改变了抗原的形态和化学结构,从而改变了与HLA-B*57∶01结合的肽库,导致多克隆T细胞活化和诱导超敏反应[9-10]。
2 遗传因素引发的药物超敏反应
在IM-ADRs发生的遗传因素中,HLA等位基因起着重要作用。HLA由Ⅰ类和Ⅱ类MHC分子组成,Ⅰ类MHC分子(HLA-A,HLA-B,HLA-C)存在于所有有核细胞上,并激活CD8+细胞毒性淋巴细胞。Ⅱ类MHC分子(HLA-DP、HLA-DQ和HLA-DR)仅存在于抗原提呈细胞,如B细胞、树突状细胞、巨噬细胞和活化的CD4+辅助性T淋巴细胞上。有10~13种药物与SCARs有关,但最常见的致病药物还是别嘌呤醇、芳香抗惊厥药、抗菌药、抗逆转录病毒药和非甾体类抗炎药。不同的研究表明,一些HLA等位基因与阿巴卡韦、卡马西平和别嘌呤醇等药物引起T细胞介导的免疫反应密切相关,且在不同人群种族之间HLA也有差异[15-16](表1)。
除了HLA等位基因外,HLA和其他基因组之间的相互作用在IM-ADRs的发生发展中也起着关键作用。在中国汉族人群中观察到在苯妥英钠引起的SJS/TEN中,与HLA-B*15∶02相关性较弱,而细胞色素P450(Cytochrome P450,CYP)清除延迟,认为HLA基因降低了药物代谢酶细胞色素P450的活性导致苯妥英钠在体内堆积[17]。另外奈韦拉平诱发的SJS/TEN还受HLA-C*04∶01与内质网氨基肽酶2基因(ERAP2)相互作用的影响,未来还需重视非HLA因素参与的IM-ADRs发生发展的机制研究[18]。
3 IM-ADRs诊断方法
适用于Ⅰ型变态反应的诊断方法包括药物特异性IgE检测、嗜碱性粒细胞活化实验(basophil activation test,BAT)、药物皮内/点刺试验;适用于Ⅳ型变态反应的诊断方法包括药物斑贴试验、淋巴细胞增殖试验(the lymphocyte transformation test,LTT)、淋巴细胞活化试验(the lymphocyte activate test,LAT)、药物酶联免疫吸附试验以及酶促免疫吸附试验[19],药物激发试验是目前诊断药物过敏的金标准[5]。可在急性过敏反应和斑丘疹型药疹中进行,鉴于本试验有可能诱发严重过敏反应,建议最好在皮肤试验、斑贴试验和体外药物诊断试验均为阴性的情况下进行,因其可能危及生命,药物激发试验并未在实际临床工作中开展。目前患者源性诱导多能干细胞技术被认为是一种测定患者特异性药物超敏反应的方法,这一过程类似于IgE介导的ADRs的嗜碱性粒细胞活化试验,该试验已被用于鉴别包括抗生素、麻醉剂和化疗药物的多种药物致敏的患者[20]。其他新兴的方法包括TCR测序、HLA检测、蛋白和核酸生物标记物以及对肠道菌群的研究[21]。
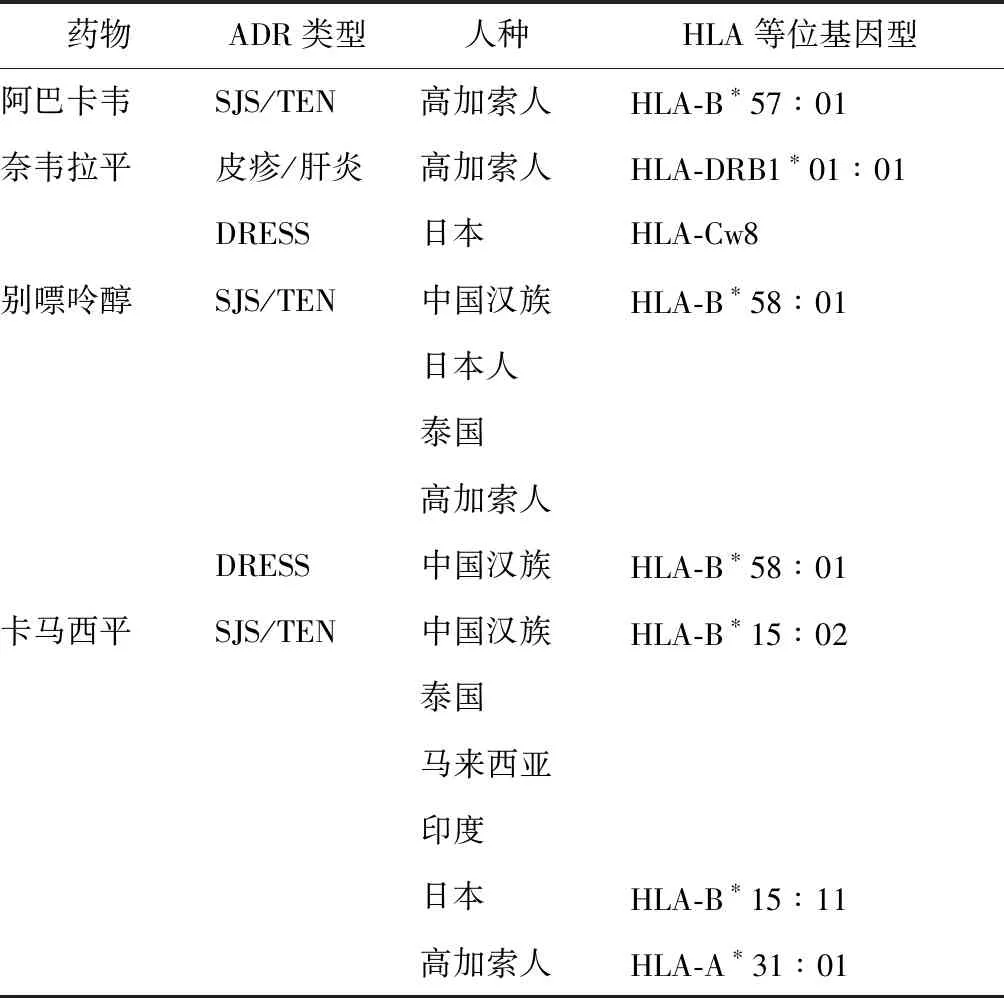
表1 HLA相关药物不良反应Table 1 HLA association with adverse drug reactions
3.1 HLA检测
目前HLA已广泛用于预测和诊断IM-ADRs。欧洲药品管理局和美国食品药品管理局建议在高危人群中使用卡马西平治疗前进行HLA-B*15∶02基因筛查[22];在使用别嘌呤醇前需要对HLA-B*58∶01进行检测[23]。美国食品药品监督管理局已将HLA-B*57∶01筛查写入阿巴卡韦用药指南当中,但应该注意这种筛查并不能提示其他类型的阿巴卡韦ADRs的发生[24]。另外在东南亚国家要求使用苯妥英钠前需对细胞色素P450超家族CYP2C9*3、HLA-B*15∶02、HLA-B*13∶01进行联合筛查[25]。
3.2 TCR测序
TCR测序是利用高通量测序技术来检测靶向扩增后的T细胞抗原去识别表面分子,揭示机体在生理和病理状态下T细胞介导的细胞免疫应答改变。TCR克隆型是由Vβ、Dβ、Jβ、Vα和Jα基因在β和α链可变结构域上随机体细胞重排产生,它们重组形成互补决定区3(CDR3)识别抗原。克隆型分析可用于检测疾病相关T细胞,评估致病性T细胞的表达谱,并确定TCR克隆型之间的相关性[26]。在卡马西平诱导的SJS/TEN的研究中,HLA-B*15∶02相关的SJS/TEN患者T细胞中携带一个共同的CD8+T细胞克隆型,在对照组中没有发现CDR3序列,这表明发生卡马西平介导的SJS/TEN药物不良反应可能依赖于HLA等位基因和TCR克隆型的存在[22]。但在IM-ADRs反应前后外周血中很少存在抗原驱动的T细胞,因此该方法临床存在一定的局限性。
3.3 蛋白和核酸标记物检测
蛋白和核酸生物标记物也适用于ADRs的全身组织损伤生物标记物,并在某些情况下可用于判断预后[27]。传统用于诊断ADRs的生物标记物如血浆丙氨酸转氨酶(ALT)和天冬氨酸转氨酶(AST)用于诊断肝损伤,血清肌酐用于诊断肾损伤。这些组织损伤标志物在灵敏度方面有一定的局限性。最新研究表明血清miR-122是诊断药物性肝病的最新生物标记物,是对乙酰氨基酚过量的急性肝细胞损伤的高度特异性标志物[28],且敏感度更高,可用于早期毒性检测。miR-124和miR-18a-5p在SJS/TEN中也有一定的诊断价值[29-30],但需进一步了解miRNA如何升高以及何时升高,也为深入了解损伤的发病机制提供理论依据。
3.4 肠道菌群研究
肠道菌群可以影响多种药物的代谢,在许多情况下会改变其功效和/或副作用[31]研究发现41种药物中有19种与微生物特征有关,其中质子泵抑制剂、二甲双胍、抗生素与微生物组的关系最为密切[32]。例如非甾体类药物产生的肠道损伤是由于肠道菌群中的β-葡萄糖醛酸苷酶释放糖苷配基进入肠上皮细胞产生毒性作用,抑制肠道菌群的β-葡萄糖醛酸苷酶可防止糖苷配基的形成,可防止NSAID诱导的肠道毒性[33]。药物中的化合物也会影响肠道细菌,因此药物与微生物组间的复杂相互作用的相关性还需进一步研究。
3.5 单细胞测序
单细胞测序技术(single cell sequencing)是指在单个细胞水平上,对基因组、转录组、表观组进行高通量测序分析的一项新技术。单细胞RNA测序(single-cell RNA sequencing method,scRNA-seq)技术能提供每个细胞的RNA表达谱,并鉴定异质细胞群中的稀有细胞。这项技术已被广泛用于多个方面的生物医学研究,包括肿瘤异质性研究、新细胞类型的鉴定、组织发育与细胞分化过程研究、基因调控网络研究、不同等位基因表达研究等。Doyoung Kim等[34]治疗一例难治性DRESS患者时利用scRNA-seq技术对患者皮肤和血液样本进行检测,确定了JAK-STAT信号通路为潜在靶标,使用托法替尼后该患者病情得到了有效的控制,这为治疗难治性药疹提供了新的思路,未来 scRNA-seq可能会帮助医生找到相关疾病的潜在靶点,并提供个性化的治疗方案。
4 总结
随着对B型药物不良反应的深入研究,我们加深了对药物、基因以及免疫反应之间相互作用的认识。未来有可能通过应用不同的组学技术整合的多个生物标记物,提供有关易感基因、早期诊断、预后判断和机制研究的信息。综合利用这些数据评估疾病风险,推进快速准确的诊断,并预测治疗的安全性和有效性,推动B型药物不良反应的精准治疗。
