RS3型芡实抗性淀粉的制备及纯化工艺研究
2020-11-05杨玥熹曹一丹俞安珍顾振宇
杨玥熹 曹一丹 俞安珍 陈 晴 顾振宇
(浙江工商大学食品与生物工程学院1,杭州 310018)(国家级食品工程与质量安全实验教学中心2,杭州 310018)
RS3型抗性淀粉,即回生淀粉,糊化淀粉在冷却过程中形成结晶,从而抗消化性增强。RS3型抗性淀粉应用较为广泛的制备工艺主要有以下3种[1-3]:热液处理、脱支处理和挤压处理。热液处理是目前最常见的抗性淀粉制备方法,通过控制淀粉乳浓度及处理温度达到增抗效果[4];脱支处理主要通过酶法或酸法处理将长链淀粉分子切割成长度适宜的直链淀粉分子,淀粉分子依靠分子间的缔结作用形成稳定的抗酶解结构[5];挤压处理主要是淀粉分子在高温高压的作用下,部分糖苷键断裂所产生的线性淀粉分子相互聚合形成抗酶解结构[6]。为提高抗性淀粉得率与制备效率,目前也有通过将多种方法结合使用,以达到将淀粉分子 “解构”并“重构”的目的。
目前,工业化的RS3型抗性淀粉多选用高直链玉米淀粉为原料,循环老化过程中能耗大,生产成本高,纯度在50%左右。在功能淀粉加工领域,抗性淀粉纯化工艺的改良以及抗性淀粉生产的新原料的筛选受到持续关注。
芡实中淀粉质量分数达70%~80%,体外消化过程中还原糖及可溶性糖的释放率均低于米淀粉[7]。目前关于芡实的研究多集中在微量营养成分(如黄酮、多酚)提取和功能评价,而忽略了对主要营养成分淀粉的研究。我国的芡实加工还处于初级阶段,具有很大的开发潜力与市场前景。本研究可为芡实等特种谷物杂粮类为原料的抗性淀粉生产和结构调控提供参考。
1 材料与方法
1.1 材料与试剂
干芡实(产地:苏州);中温α-淀粉酶 (10 000 U/g)、普鲁兰酶(1 500 U/mL)、耐高温α-淀粉酶(4 000 U/g)、糖化酶(100 000 U/mL)、低温α-淀粉酶(2 000 U/g)、胃蛋白酶(10 000 U/g);氢氧化钠、盐酸、柠檬酸、柠檬酸钠均为分析纯。
1.2 仪器与设备
Five Easy Plus pH计,G8X-9140MBE电热鼓风干燥箱,DSX-280B手提式压力蒸汽灭菌器,DFY-1000高速摇摆粉碎机(旋转刀片转速25 000 r/min),SCIENTZ-10N冷冻干燥机,Q2000差式量热扫描仪,SU8010场发射扫描电镜 (FESEM)。
1.3 方法
1.3.1 芡实淀粉的制备
将干芡实用高速摇摆粉碎机粉碎(15 s × 3次)后过100目筛,得芡实粉,密封后于室温保存。
芡实淀粉(ES)参照赵梅[8]的方法制备。制得芡实淀粉纯度为86.4%,蛋白质质量分数为2.3%,含水量为9.2%。
1.3.2 增抗芡实淀粉制备工艺优化
1.3.2.1 酶-压热法增抗芡实淀粉制备工艺优化
酶-压热法增抗芡实淀粉(EA-ERS)的制备参照燕玲娟[9]的方法,并对工艺参数进行优化。单因素实验条件为:淀粉乳浓度20%;普鲁兰酶反应条件为pH 4.6,60 ℃,2 h,4 U/g;压热温度120 ℃,时间20 min。保持其余条件不变,以RS质量分数为评价指标,分别改变淀粉乳质量分数(10%、15%、20%、25%、30%)、普鲁兰酶用量(1、2、3、4、5 U/g)、普鲁兰酶作用时间(1、1.5、2、2.5、3 h)、压热温度(95、100、105、110、115、120、125 ℃)、压热时间(10、20、30、40、50 min)。
1.3.2.2 压热法-增抗芡实淀粉的制备
压热法-增抗芡实淀粉(A-ERS) 的制备参照张涛铄等[10]的方法。淀粉乳质量分数12%,121 ℃压热处理30 min,4 ℃冷藏时间15 h。
1.3.2.3 双酶法-增抗芡实淀粉的制备
双酶法-增抗芡实淀粉(DE-ERS)的制备参照周颖等[11]的方法。淀粉乳质量分数24.5%,4 U/g(干基淀粉)的中温α-淀粉酶作用25 min,4 U/g(干基淀粉)普鲁兰酶作用1.5 h。
1.3.3 增抗芡实淀粉纯化的工艺优化
纯化步骤:酶-压热增抗淀粉(EA-ERS)与水按1∶9配制悬浊液,于90 ℃水浴糊化30 min后冷却至40 ℃。酶解,后进行灭酶处理(100 ℃,15 min)。待淀粉糊冷却至室温后离心(4 000 r/min,5 min)取沉淀,加入4倍体积的洗剂,搅拌均匀后于室温下静置1 h后离心取沉淀,重复洗涤操作3次后干燥,用高速摇摆粉碎机粉碎(15 s × 3次),过100目筛。
酶解过程中使用的酶包括:胃蛋白酶(pH 2.0,40 ℃,2 h,15 U/g干基淀粉);高、中、低温α-淀粉酶(pH 6.0,最适酶解温度下酶解,2 h,10 U/g 干基淀粉);糖化酶(pH 4.6,60 ℃,2 h,50 U/g干基淀粉)。若未特殊说明,洗剂为95%乙醇,干燥方式为50 ℃鼓风干燥。
通过单因素实验探究不同酶组合、淀粉酶种类、洗剂对芡实抗性淀粉纯度及得率的影响,以确定最优的芡实抗性淀粉纯化工艺及参数。抗性淀粉纯度采用1.3.3中抗性淀粉含量测定方法进行测定,所得抗性淀粉含量即为抗性淀粉纯度。RS得率为纯化后所得抗性淀粉质量占纯化前增抗淀粉质量的百分比。
1.3.3.1 不同酶解实验
改变酶的种类及添加顺序,其余条件不变。(A1)依次加入胃蛋白酶、耐高温α-淀粉酶;(A2)依次加入胃蛋白酶、糖化酶;(A3)依次加入耐高温α-淀粉酶、糖化酶;(A4)依次加入胃蛋白酶、耐高温α-淀粉酶和糖化酶。
1.3.3.2 不同α-淀粉酶
采取A4组的酶解方式,胃蛋白酶酶解后分别加入(B1)低温α-淀粉酶(酶解温度40 ℃);(B2)中温α-淀粉酶(酶解温度70 ℃);(B3)耐高温α-淀粉酶(酶解温度90 ℃);(B4)不添加α-淀粉酶。
1.3.3.3 不同洗剂
采取A4组的酶解方式,洗剂分别选择(C1)蒸馏水;(C2)85%乙醇溶液;(C3)95%乙醇溶液;(C4)不进行洗涤处理。
1.3.3.4 不同增抗方法
采取A4组的酶解方式,分别对(D1)芡实淀粉(ES);(D2)酶-压热增抗芡实淀粉(EA-ERS);(D3)压热法增抗芡实淀粉(A-ERS);(D4)双酶法增抗芡实淀粉(DE-ERS)进行纯化。
1.3.3.5 不同干燥方式
将A4组干燥方式由鼓风干燥换为冷冻干燥。
1.3.4 抗性淀粉(RS)含量测定
参照AOAC 2002.02的方法进行[12]。
1.3.5 直链淀粉含量的测定
参考戴双等[13]的方法,采用双波长法确定直链淀粉含量。测定波长λ1为595 nm,参比波长λ2为430 nm。
1.3.6 热特性的测定
样品按料液比1∶3配制淀粉悬浊液并置于铝盒中,将盖子密封后放入差式量热扫描仪(DSC)样品槽中,以空白样品池作为参比,通入氮气,以10 ℃/min的升温速率从 40 ℃升至160 ℃ 进行扫描测定[14]。利用配套分析软件计算淀粉样品的熔融态起始温度(To),峰值温度(Tp),终止温度(Tc)和焓变ΔH。
1.3.7 表面颗粒形态的测定
将样品干燥至恒重后,固定于样品台上喷金,然后采用扫描电镜对样品进行表面颗粒形态观察,电镜放大倍数为2 000×和5 000×。
1.3.8 数据统计与分析
实验数据是3次平行实验的平均值,采用SPSS 21.0软件中的单因素方差分析(one-way,ANOVA)检验显著性水平(检验水平P选择为 0.05)。
2 结果与分析
2.1 酶-压热增抗淀粉(EA-ERS)制备工艺优化
2.1.1 单因素实验
由图1可知,淀粉乳质量分数、普鲁兰酶作用时间、压热时间对抗性淀粉含量的影响较为显著;当普鲁兰酶用量为4 U/g时效果最佳。普鲁兰酶主要通过切断淀粉分子中的α-1,6 糖苷键,从而增加淀粉中直链淀粉的比例,以利于形成更多的RS3型抗性淀粉;而当普鲁兰酶过量时,再增加酶用量对EA-ERS的RS含量无明显影响[15]。在一定范围内,压热温度对RS含量的影响较小,且当压热温度为120 ℃时效果最佳。适宜的酶解时间可极大程度上提高淀粉RS含量,但酶解时间过长反而会降低淀粉RS含量[16]。
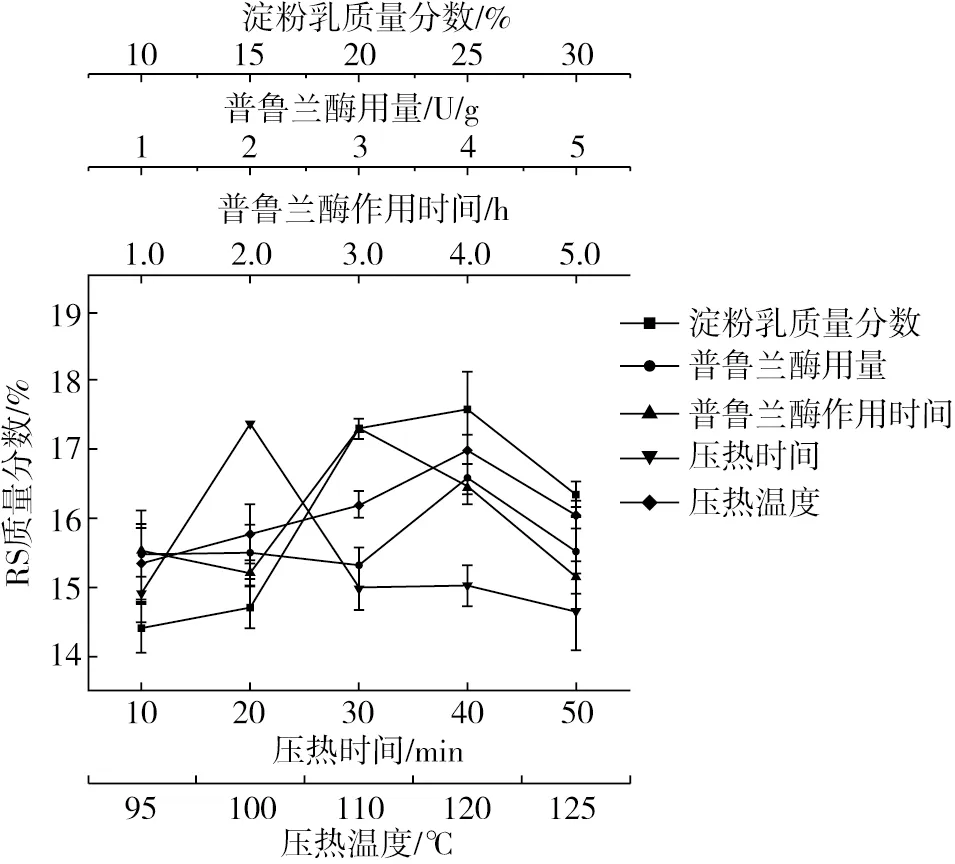
图1 酶-压热法单因素对抗性淀粉含量的影响
2.1.2 响应面法优化
2.1.2.1 响应面实验设计及结果
由单因素实验结果分析可知,选取淀粉乳质量分数、普鲁兰酶作用时间、压热时间这3个对抗性淀粉得率影响较大的因素进行响应面实验设计,其因素水平见表1,实验设计及结果见表2。
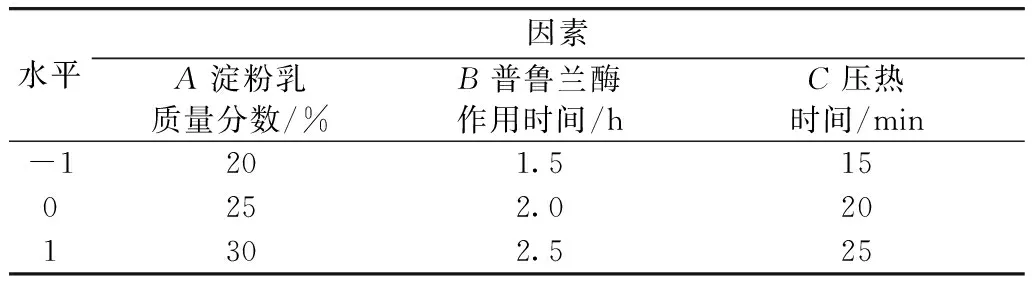
表1 酶-压热法制备芡实增抗淀粉响应面因素水平表
2.1.2.2 响应面回归模型及方差分析
响应面回归模型方程为:抗性淀粉含量=18.21+1.11A+0.64B+0.71C+0.42AC-0.44AB+0.47BC-1.92A2-0.67B2-1.06C2。

表2 酶-压热法制备增抗芡实淀粉的实验设计及结果
由表3可知,所建模型P<0.000 1,失拟项P>0.05,二次模型成立。且A2>C2>B2,说明EA-ERS中RS含量的影响因素主次为淀粉乳质量浓度>压热时间>普鲁兰酶作用时间。在酶-压热法中,控制压热时间是提高RS含量最关键的因素。

表3 酶-压热法制备增抗芡实淀粉的回归方程方差分析
2.1.2.3 响应面分析与工艺优化
由图2a可知,淀粉乳质量分数与压热时间两因素对抗性淀粉含量的交互作用较为显著,等高线图呈椭圆形,曲面图比较陡峭;由图2b可知,淀粉乳质量浓度与普鲁兰酶作用时间两因素对抗性淀粉含量的交互作用并不显著,曲面较为平坦由。由图2c可知,随着普鲁兰酶作用时间和压热时间的增加,响应值呈现先增高后下降的趋势,等高线呈椭圆形,曲面图比较陡峭,两者交互作用较为显著。


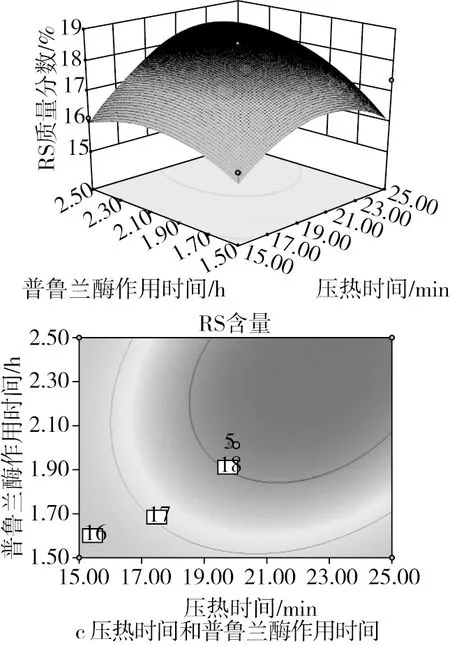
图2 响应面和等高线图
综上所述,根据响应面分析预测的最佳条件,并综合考虑实际生产及能源损耗等因素,确定了酶-压热增抗工艺的最优条件为:淀粉乳质量分数26.5%,普鲁兰酶作用时间2.3 h,压热时间23 min,可得到RS质量分数为(18.34±0.21)% (n=3)的酶-压热增抗淀粉(EA-ERS),与模型预测值18.74%的相对误差小于3%,说明2.1.2.2中回归模型与实际情况拟合较好,具有实际应用价值。
2.2 芡实抗性淀粉纯化工艺优化
去除非抗性部分是提高抗性淀粉纯度的常见方式。由图3可知,对于不同的酶解方案,依次加入胃蛋白酶、耐高温α-淀粉酶和糖化酶(A4组)后芡实RS3纯度最高,为(57.76±0.01)%。这可能是由于胃蛋白酶酶解了部分包裹在EA-ERS表面的蛋白质,使得淀粉能够更好地暴露并与淀粉酶接触发生水解[11]。α-淀粉酶与糖化酶的协同作用,可使淀粉分子中的α-1,4和α-1,6 糖苷键快速断裂,从而提升了纯化效果[17]。
根据酶解最适温度的不同,α-淀粉酶可以分为高温、中温和低温型。由图3所示,分别经过高温、中温和低温α-淀粉酶作用所得芡实RS3得率无明显差异(P>0.05)。经低温α-淀粉酶 (B1组)处理的芡实RS3纯度最高,达(73.66±0.85)%。这可能是由于低温α-淀粉酶分子内基团相互作用较弱,分子柔韧度较高[17],使其与淀粉分子之间的接触面积增大,提高了酶解效率。
为进一步提高芡实RS3的纯度,需要除去淀粉酶解后产生的小分子糖和无机盐。由图3可知,蒸馏水作为洗剂得到芡实RS3纯度最高。这可能是由于乙醇在可溶解小分子糖的同时也会抑制淀粉颗粒吸水膨胀;且随着乙醇质量分数的增加,这种抑制作用也增强[18,19];经乙醇处理后的淀粉分子中双螺旋结构可能会瓦解,并转变为单螺旋结构与乙醇结合形成V型复合体[20]。

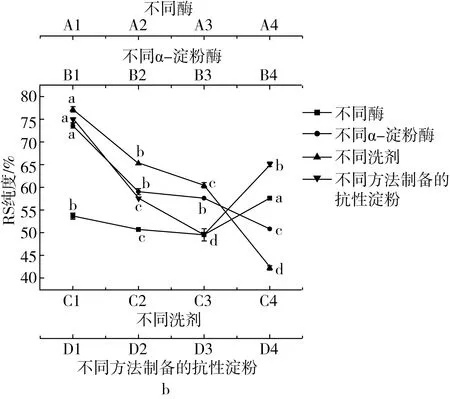
注:不同字母表示有显著性差异 (P<0.05)。图3 不同处理方式对芡实抗性淀粉纯度(a)及得率(b)的影响
不同方法制备的增抗淀粉纯化后得率没有显著性差异(P>0.05),而纯度差异显著(P<0.05),主要由于不同增抗方法制备的增抗淀粉分子微观结构与结晶的差异所致。已有研究表明,冷冻干燥可有效保留淀粉原有结晶结构,保持淀粉颗粒完好[21];鼓风干燥时淀粉样品表面水分快速蒸发,内部水分迁移速率较慢,造成淀粉颗粒表面皱缩,结晶结构有一定破坏[22,23]。冷冻干燥处理后的芡实RS纯度为(67.75±0.60)%,显著高于鼓风干燥A4组(P<0.05)。
芡实抗性淀粉纯化的优选条件为:依次进行胃蛋白酶(pH 2.0,40 ℃,1 h,15 U/g干基淀粉)、低温α-淀粉酶(pH 6.0,45 ℃,2 h,10 U/g干基淀粉)和糖化酶(pH 4.6,60 ℃,2 h,100 U/g 干基淀粉)酶解,离心,蒸馏水洗涤3次后冷冻干燥。
2.3 抗性淀粉和直链淀粉含量分析
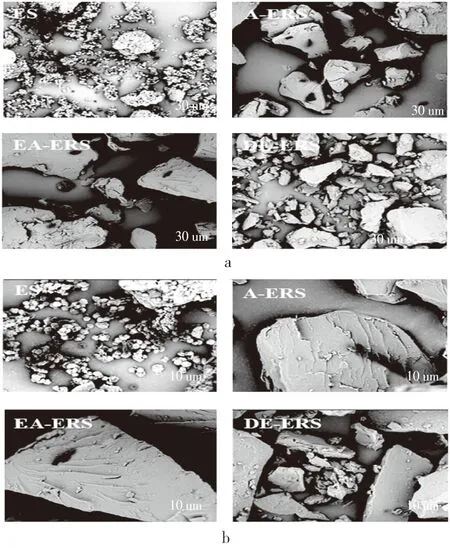
表4展示了酶-压热法(按照2.1.2.3中确定的最优条件)、压热法(按照1.3.2.2所示方法)、双酶法(按照1.3.2.3所示方法)制备的芡实增抗淀粉A-ERS、EA-ERS、DE-ERS,以及根据2.2中的优选条件进一步纯化后的芡实抗性淀粉P-A-ERS、P-EA-ERA、P-DE-ERS中直链淀粉含量和抗性淀粉(RS)含量。三种增抗芡实淀粉中RS含量没有显著性差异P>0.05),三种抗性淀粉中RS含量P-A-ERS 表4 不同淀粉样品中抗性淀粉和直链淀粉质量分数/% 淀粉受热过程中的焓变(ΔH)与淀粉双螺旋解构有关,可以反映结晶形成的质量和程度[25];淀粉颗粒中To、Tp、Tc的升高表示淀粉颗粒中有更多的双螺旋结构和结晶体[26],糊化温度范围(Tc~To)表示颗粒内淀粉微晶的均匀程度[27]。相比于芡实淀粉(ES),增抗淀粉的To、Tp、Tc、ΔH均有显著提高(P<0.05),说明在增抗过程中形成了更加紧密的晶型结构高,热稳定性提升[27]。压热处理的A-ERS由于未经酶解,分子链较长,回生过程中形成的结晶结构更紧密[28],因此其To、Tp、Tc、ΔH高于其它两种增抗芡实淀粉。相比于对应的增抗淀粉,纯化后芡实抗性淀粉的To、Tp、Tc、(Tc~To)显著下降,ΔH显著上升,表明纯化中的酶解过程对芡实抗性淀粉结晶有一定的降解,但是结晶质量更高,更为均匀。P-EA-ERS糊化温度范围最窄,表示其淀粉颗粒结构最均匀。 如图4所示,未经增抗处理的ES颗粒呈规则多面体状,表面光滑。酶-压热处理的EA-ERS经过压热与酶解,颗粒形态与A-ERS与DE-ERS均有类似,整体呈不规则碎片状,表面出现片层褶皱。表明芡实淀粉的增抗过程破坏了原有淀粉结构,并在回生阶段重新聚集形成了结构较为紧密稳定的新晶体[29]。 如图5所示,经纯化后所得芡实抗性淀粉颗粒均呈现蜂窝状,表面粗糙。双酶处理使得淀粉分子片段较小,从而增大了其可酶解成分与淀粉酶的接触面积[30],是纯化效果较好的原因之一。 表5 不同淀粉的热力学参数 注:ES 芡实淀粉; A-ERS 压热法芡实增抗淀粉; EA-ERS 酶-压热法芡实增抗淀粉; DE-ERS 双酶法芡实增抗淀粉, a 2 000×,b 5 000×。图4 不同淀粉样品的扫描电镜图 注:P-A-ERS 压热法芡实抗性淀粉;P-EA-ERS 酶-压热法芡实抗性淀粉;P-DE-ERS 双酶法芡实抗性淀粉,a 2 000×,b 5 000×。图5 不同纯化样品的扫描电镜图 通过单因素和响应面实验优化了酶-压热法芡实淀粉的增抗工艺,得到与实际情况拟合良好的响应面回归模型。芡实淀粉最优增抗工艺为:淀粉乳质量分数26.5%,4 U/g干基淀粉普鲁兰酶酶解2.3 h,120 ℃压热23 min。通过单因素实验,优选的芡实抗性淀粉纯化工艺为:依次进行胃蛋白酶(pH 2.0,40 ℃,1 h,用量15 U/g干基淀粉)、低温α-淀粉酶(pH 6.0,45 ℃,2 h,用量10 U/g干基淀粉)和糖化酶(pH 4.6,60 ℃,2 h,用量100 U/g干基淀粉)酶解,蒸馏水洗涤3次后冷冻干燥。经上述条件纯化后,所得三种芡实抗性淀粉(P-A-ERS、P-EA-ERS、P-DE-ERS)得率无显著性差异(P>0.05),纯度高低依次为P-DE-ERS>P-EA-ERS>P-A-ERS,均大于80%,颗粒呈现多孔状;酶-压热法芡实抗性淀粉(P-EA-ERS)直链淀粉含量最高,糊化温度范围最窄。本研究可为高纯度、结构可控的RS3型抗性淀粉的生产提供借鉴。
2.4 热特性分析
2.5 淀粉颗粒表面形态分析

3 结论
