鸭肠炎病毒感染对鸭肠道菌群多样性的影响
2020-11-05蒲翠敏胡安东程振涛
杨 霞,蒲翠敏,胡安东,张 飘,杨 颖,程振涛,文 明
(贵州大学动物科学学院/贵州大学动物疫病研究所/贵州省动物生物制品工程技术研究中心,贵州 贵阳 550025)
鸭肠炎病毒(Duck enteritis virus,DEV)又称鸭瘟病毒(Duck plague virus,DPV),属疱疹病毒科疱疹病毒亚科成员,可引起鸭、鹅及多种雁行目禽类发生一种急性、败血性、高度接触性传染病,其病变特征为血管损伤、消化道黏膜出血坏死、淋巴器官和实质性脏器退行性病变,是目前严重威胁养鸭业发展的重要病原之一[1]。目前,国内外学者对DEV 开展多方面深入研究,取得了诸多进展,但有关DEV 感染对宿主肠道菌群多样性影响研究鲜有报道。
动物肠道菌群在正常情况下处于动态平衡,对维持动物机体健康具有重要作用[2]。当动物机体受到病原微生物侵害时,引起动物免疫系统功能以及其它生理功能下降或紊乱,影响肠道内菌群平衡状态,导致病情进一步加重。DEV 感染的主要病变是肠道黏膜出血坏死,这势必造成鸭肠道菌群平衡紊乱。因此,本研究采用Illumina 高通量测序技术,开展DEV 感染对鸭肠道菌群多样性的影响研究,探索DEV 感染后鸭肠道菌群结构变化规律,为DEV 感染的微生态防控提供科学依据。
1 材料与方法
1.1 病毒与实验动物DEV-GZ 株[3],由贵州省动物疫病与兽医公共卫生重点实验室提供,TCID50=3.16×10-9/0.1 mL。1 日龄三穗麻鸭60 只,购自贵州省贵阳绿源禽业有限公司,经血清学和病原学检测均为DEV阴性。将1 日龄三穗麻鸭转入贵州大学动物疫病研究所动物饲养房,按常规方法饲养至35日龄。
1.2 主要试剂HiPure Stool DNA Kits 购自QIAGEN公司;ABI Step One Plus Real-Time PCR System 购自Life Technologies 公 司;AMPure XP Beads 购 自Beckman Coulter 公司;无水乙醇购自广州化学试剂公司;琼脂糖(Agarose)购自Invitrogen 公司。
1.3 人工感染及样品采集取35 日龄健康三穗麻鸭,随机分成2 组,即感染组和对照组,每组30只。感染组鸭腿部肌肉注射DEV病毒液0.1 mL,对照组鸭腿部肌注灭菌生理盐水0.1 mL,于注射后24 h、48 h、72 h、96 h 和120 h 时分别迫杀各组实验鸭,每次5 只,迅速采集肠内容物,由广州基迪奥生物科技有限公司进行鸭肠道菌群高通量测序。
1.4 基于16S rRNA 基因高通量测序取适量肠道内容物,加入Buffer SSL 缓冲液充分混匀,以Hi-Pure Stool DNA Kits 提取肠道细菌DNA,采用扩增16S rRNA 基因V3+V4 区的PCR 试剂盒进行扩增,PCR 产物经AMPure XP Beads 试剂盒纯化后以ABI Step One Plus Real-Time PCR System 定量,然后于Hiseq2500 系统PE250 模式下进行pooling 测序。
1.5 测序数据处理与分析将测序得到的DNA 序列去除低质量序列、Tags 拼接、Tags 过滤和Tags 嵌合体去除,得到有效数据(Effective Tags)后,应用Uparse 9(usearch v9.2.64)软件进行Effective Tags 序列聚类(OTUs),QIIME 和SPSS 23.0 软件进行鸭肠道菌群Alpha 多样性分析,经Muscle(v3.8.31)和TreeBeST(v1.9.2)软件进行Beta 多样性分析,RDP classifier 软件进行肠道菌群物种注释分类,LEFse 软件进行肠道菌群物种差异性分析。
2 结 果
2.1 DEV 感染鸭肠道菌群Alpha 多样性分析经QIIME 软件计算OTU 种类数,绘制OTU 稀释曲线,结果显示:随着测序深度增加,所测样本相应OTU数目也相应增加(图1)。表明所有样本的测序数据量足够大,能够充分反映实验鸭肠道菌群结构的真实情况。
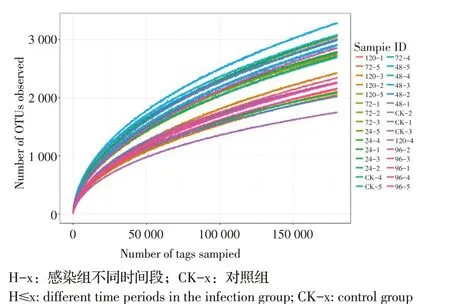
图1 感染组和对照组鸭肠道样本菌群OTU 稀释曲线Fig.1 OTU dilution curve of duck intestinal flora of control and infection groups
Alpha 多样性分析结果显示:感染组和对照组鸭肠道样本菌群Coverage 指数均大于99%,提示其测序结果可代表所测鸭肠道样本菌群结构的真实情况;与对照组比较,感染组鸭肠道菌群的Alpha 多样性指数(Observed species、Shannon、Simpson、Chao1和ACE)均呈先升高后降低的趋势,即在DEV 感染后24 h、48 h 和72 h 时Alpha 多样性指数升高,随后96 h 和120 h 呈下降趋势(图2)。表明感染后24 h、48 h 群落较丰富和群落多样性较好,提示感染后一段时间正常菌群也开始大量生长,以维持肠道稳态。
2.2 DEV 感染鸭肠道菌群Beta 多样性分析经Beta多样性分析,制作Weighted Unifrac 指数热图,结果显示,感染组或对照组各时间段间样本Weighted Unifrac 指数距离较近即相似度较高;感染组24 h、48 h 和72 h 时样本Weighted Unifrac 指数与对照组距离差异显著(p<0.05),而在96 h 和120 h 时与对照组距离差异极显著(p<0.01)。表明随着DEV 感染时间的延长,样本间具有显著的微生物群落差异。

图2 Alpha 多样性分析结果Fig.2 The results of Alpha diversity analysis
2.3 DEV 感染鸭肠道菌群在不同分类水上的物种分布应用RDP classifier 软件对DEV 感染鸭肠道菌群物种注释分类,结果如图3 所示。
2.3.1 DEV 感染鸭肠道菌群在门水平上物种分布在门水平上,对照组和感染组不同时间段鸭肠道菌群均可注释到15 个门细菌上,即厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)、梭杆菌门(Fusobacteria)、蓝藻门(Cyanobacteria)、疣微菌门(Verrucomicrobia)、放线菌门(Actinobacteria)、 软壁菌门(Tenericutes)、 黏胶球形菌门(Lentisphaerae)、浮霉菌门(Planctomycetes)、 异常球菌-栖热菌门(Deinococcus-Thermus)、螺旋体菌门(Saccharibacteria)、迷踪菌门(Elusimicrobia)、 芽单胞菌门(Gemmatimonadetes)、Parcubacteria 门和绿弯菌门(Chloroflexi),其中优势菌门主要是厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)和梭杆菌门(Fusobacteria)。与对照组比较,感染组24 h、48 h 和72 h 时厚壁菌门细菌数量升高,但差异不显著(p>0.05),而在96 h 和120 h时下降,差异显著(p<0.05);感染组各个时间段变形菌门细菌呈逐渐下降趋势,差异显著(p<0.05);感染组各个时间段梭杆菌门细菌呈升高趋势,但在24 h、48 h 和72 h 时差异不显著(p>0.05),而在96 h和120 h 时差异显著(p<0.05);感染组各个时间段拟杆菌门细菌呈升高趋势,其中48 h 和72 h 时差异显著(p<0.05)。
2.3.2 DEV 感染鸭肠道菌群在纲水平上物种分布在纲水平上,感染组和对照组不同时间段鸭肠道菌群均可注释到44 个纲细菌上,其中优势菌纲为梭菌纲(Clostridia)、拟杆菌纲(Bacteroidia)、梭杆菌纲(Fusobacteriia)、丙型变形菌纲(Gammaproteobacteria)、Negativicutes 纲、丹毒丝菌纲(Erysipelotrichia)和芽孢杆菌纲(Bacilli)。与对照组比较,感染组24 h、48 h 和72 h 时梭菌纲(Clostridia)和Negativicutes 纲细菌数量升高,而在96 h 和120 h 时下降,但差异均不显著(p>0.05);感染组拟杆菌纲(Bacteroidia)细菌均呈升高趋势,其中在48 h 和72 h 时差异显著(p<0.05);感染组梭杆菌纲(Fusobacteriia)细菌也呈升高趋势,其中在96 h 和120 h 时差异显著(p<0.05);感染组丙型变形菌纲(Gammaproteobacteria)和芽孢杆菌纲(Bacilli)细菌均呈下降趋势,差异显著(p<0.05)。
2.3.3 DEV 感染鸭肠道菌群在目水平上物种分布在目水平上,感染组和对照组不同时间段鸭肠道菌群均可注释到59 个目细菌上,其中优势菌目为梭菌目(Clostridiales)、拟杆菌目(Bacteroidales)、梭杆目(Fusobacteriales)、肠杆菌目(Enterobacteriales)、月牙单胞菌目(Selenomonadales)、丹毒丝菌目(Erysipelotrichales)和乳杆菌目(Lactobacillales)。与对照组比较,感染组鸭肠道梭菌目(Clostridiales)和月牙单胞菌目(Selenomonadales)细菌数量在24 h、48 h 和72 h时升高,而在96 h 和120 h 时下降,但差异均不显著(p>0.05);感染组拟杆菌目(Bacteroidales)和梭杆目(Fusobacteriales)细菌均呈升高趋势,其中拟杆菌目(Bacteroidales)细菌在48 h 和72 h 时和梭杆目(Fusobacteriales)细菌在96 h 和120 h 时差异显著(p<0.05);感染组丹毒丝菌目(Erysipelotrichales)细菌呈下降趋势,其中在96 h 和120 h 时下降显著(p<0.05);感染组肠杆菌目(Enterobacteriales)和乳杆菌目(Lactobacillales)在各个时间段均呈下降趋势,且差异显著(p<0.05)。

图3 对照组和感染组鸭肠道样本菌群物种分布堆叠图Fig.3 Stacking diagram of the horizontal species distribution
2.3.4 DEV 感染鸭肠道菌群在科水平上物种分布感染组和对照组不同时间段鸭肠道菌群均可注释到109 个科细菌上,其中优势菌科为拟杆菌科(Bacteroidaceae)、梭杆菌科(Fusobacteriaceae)、消化链球菌科(Peptostreptococcaceae)、瘤胃菌科(Ruminococcaceae)、肠 杆 菌 科(Enterobacteriaceae)、理 研 菌 科(Rikenellaceae)、毛螺菌科(Lachnospiraceae)、梭菌科(Clostridiaceae_1)、丹毒丝菌科(Erysipelotrichaceae)和韦荣球菌科(Veillonellaceae)。与对照组比较,感染组鸭肠道拟杆菌科(Bacteroidaceae)、梭杆菌科(Fusobacteriaceae)、瘤胃菌科(Ruminococcaceae)、理研菌科(Rikenellaceae)、毛螺菌科(Lachnospiraceae)和韦荣球菌科(Veillonellaceae)细菌均呈升高趋势,其中拟杆菌科(Bacteroidaceae)在48 h 和72 h 时、梭杆菌科(Fusobacteriaceae)在96 h 和120 h 时、瘤胃菌科(Ruminococcaceae)在120 h 时、理研菌科(Rikenellaceae)在72 h 时和毛螺菌科(Lachnospiraceae)在48 h 和72 h 时升高显著(p<0.05);感染组消化链球菌科(Peptostreptococcaceae)、肠杆菌科(Enterobacteriaceae)和丹毒丝菌科(Erysipelotrichaceae)细菌均呈下降趋势,其中肠杆菌科(Enterobacteriaceae)在各个时段和消化链球菌科(Peptostreptococcaceae)与丹毒丝菌科(Erysipelotrichaceae)在96 h 和120 h 时下降显著(p<0.05);感染组梭菌(Clostridiaceae_1)细菌在24 h和48 h 时下降,而在72 h、96 h 和120 h 时上升,但差异均不显著(p>0.05)。
2.3.5 DEV 感染鸭肠道菌群在属水平上物种分布感染组和对照组不同时间段鸭肠道菌群均可注释到252 个属细菌上,其中优势菌属为梭杆菌属(Fusobacterium)、拟杆菌属(Bacteroides)、大肠杆菌志贺菌亚属(Escherichia-Shigella)、另枝菌属(Alistipes)、巨 单 胞 菌 属(Megamonas)、Prevotellaceae_NK3B31.groupg 属、 Turicibacter 属、 Candidatus_Arthromitus属、梭菌属(Clostridium)和粪杆菌属(Faecalibacterium)。与对照组比较,感染组鸭肠道梭杆菌属(Fusobacterium)、拟 杆 菌 属(Bacteroides)和另枝菌属(Alistipes)均呈升高趋势,其中梭杆菌属(Fusobacterium)在96 h 和120 h 时、拟杆菌属(Bacteroides)在48 h和72 h 时和另枝菌属(Alistipes)在72 h 时升高显著(p<0.05);大肠杆菌志贺菌亚属(Escherichia-Shigella)和Turicibacter 属细菌均呈下降趋势,其中大肠杆菌志贺菌亚属(Escherichia-Shigella)在各个时段和Turicibacter 属在96 h 和120 h 时差异显著(p<0.05);巨单胞菌属(Megamonas)、Prevotellaceae_NK3B31.groupg属、Candidatus_Arthromitus 属和粪杆菌属(Faecalibacterium)细菌均呈先升高(24 h、48 h 和72 h)后下降(96 h 和120 h),但差异均不显著(p>0.05);梭菌属(Clostridium)细菌则先下降(24 h、48 h 和72 h,p>0.05)后升高(96 h 和120 h,p<0.05)。
2.3.6 DEV 感染鸭肠道菌群在种水平上物种分布在种水平上,除未归类外,感染组和对照组不同时间段鸭肠道菌群可注释到113 个种细菌上。将其中几个种细菌与对照组比较,感染组鸭肠道Bacteroides_plebeius_DSM_17135、 Gut_metagenom、 Bacteroides_coprocola_DSM_17136 、bacteriumic1379 和 坏 死 梭杆菌(Fusobacterium mortiferum)均呈升高趋势,其中Gut_metagenome 和 Bacteroides_coprocola_DSM_17136在72 h 时、bacteriumic1379 在24 h 时和坏死梭杆菌(Fusobacterium mortiferum)在96 h 和120 h 时升高显著(p<0.05);产气荚膜梭菌(Clostridium perfringens)呈先下降(24 h、48 h 和72 h,p>0.05)和后升高(96 h 和120 h,p<0.05)态势。
2.4 DEV 感染鸭肠道菌群物种差异的LEFse 分析通过LEFse 分析组间菌群差异,结果显示,感染组在24 h 时鸭肠道菌群结构与对照组差异不显著(p>0.05),而在48 h、72 h、96 h 和120 h 时差异显著(p<0.05),48 h 时,感染组鸭肠道乳杆菌目、芽孢杆菌纲、肠杆菌科和肠杆菌目细菌相对丰度减少,而毛螺菌科、产碱杆菌科(Alcaligenaceae)、克里斯滕森菌科(Christensenellaceae)Christensenellaceae_R_7_group 属细菌含量增多;72 h 时,感染组鸭肠道Chloroplast 纲及Chloroplast 纲Phaseolus_acutifolius目、 Phaseolus_acutifolius 科、 Phaseolus_ acutifolius属和Phaseolus_acutifolius 属含量减少,而拟杆菌门、拟杆菌纲、拟杆菌目、瘤胃菌科、Bacteroides_coprocola_DSM_17136 等细菌含量增多;96 h 时,感染组鸭肠道厚壁菌门、变形菌门丙型变形菌纲肠杆菌科肠杆菌目大肠杆菌志贺菌亚属、链球菌科等细菌含量减少,而梭杆菌门梭杆菌纲梭杆菌科梭杆菌目梭杆菌属乳酸发酵类梭菌(Lactatifermentans)等含量增多;120 h 时,感染组鸭肠道变形菌门丙型变形菌纲肠杆菌目肠杆菌科大肠杆菌志贺菌亚属及消化链球菌科和芽孢杆菌纲等细菌含量减少,而Epsilonproteobacteria 纲、弯曲菌目(Campylobacterales)、弯 曲 菌 科(Campylo bacteraceae)、弓形杆菌属(Arcobacter)、Clostridium_perfringens、Ruminococcaceae_UCG_008、lactatifermentans 等 含 量增多(图4)。

图4 对照组和感染组鸭肠道样本菌群物种差异LEFse 分析图Fig.4 LEFse diagram of horizontal species distribution
3 讨 论
研究肠道菌群结构的变化对维持宿主健康具有重要的意义。肠道菌群的组成与宿主的营养、代谢和免疫等密切相关,肠道菌群能降解和发酵宿主不需要的一些碳水化合物以提高能量利用率;同时还能促进产生免疫原,激活免疫系统,有助于抵抗病原体攻击,增强动物机体免疫抵抗力。在正常情况下,肠道菌群之间、菌群与宿主之间处于动态平衡, 从而维持着肠道正常生理功能[4]。但当动物机体受到病原微生物侵袭时,肠道菌群动态平衡受到破坏,导致肠道有益菌数量减少而有害菌数量增多,同时引起宿主免疫功能下降,从而造成疫病的发生和病情的加重[5-6]。
本研究采用高通量测序技术分析DEV 感染后24 h、48 h、72 h、96 h 和120 h 时鸭肠道菌群多样性变化,结果发现:鸭肠道菌群结构多样性和丰度,随着DEV 感染时间的延长呈先上升后下降趋势,且菌群结构差异逐渐加大。推测可能是DEV 感染引起鸭机体免疫功能下降,导致肠道菌群动态平衡遭到破坏,一些外籍菌乘虚而入并大量繁殖,同时肠道原籍菌为维持肠道菌群稳态亦大量繁殖,从而造成此时菌群多样性和丰度较高、结构差异距离较小;但随着病程发展,鸭肠道粘膜出血坏死和绒毛脱落,使附着在肠黏膜上的细菌随之脱离肠壁而排出体外,再加上肠道受损,缺乏良好的细菌生长条件感染,导致肠道细菌大量死亡,因此感染后期肠道菌群多样性和丰度降低、结构差异距离越大。
本研究发现DEV 感染后鸭肠道菌群物种在门水平上主要为厚壁菌门、变形菌门、拟杆菌门和梭杆菌门,在纲水平主要为梭菌纲、丙型变形菌纲、拟杆菌纲和梭杆菌纲;在目水平上主要为梭菌目、肠杆菌目、拟杆菌目和梭杆菌目;在科水平上主要为肠杆菌科、消化链球菌科、拟杆菌科和梭杆菌科;在属水平上主要为大肠杆菌志贺菌亚属、拟杆菌属、梭菌属和Turicibacter 属。DEV 感染后,这些细菌含量有的呈升高趋势,有的呈下降趋势,有的呈先升高后下降,有的呈先下降后升高,这与李东亮等研究结果相类似[7],说明鸭肠道菌群优势菌呈现动态变化,这可能与肠道微生物保持平衡以缓解损伤有关;当动物机体遭受病原微生物感染时,会做出特定的微生态反应维持肠道菌群结构和数量的动态稳定,以促进动物机体对抗病原侵害。
本研究还发现DEV 感染后鸭肠道菌群可注释归类到种只有113 个种,但值得注意的是,DEV 感染后肠道中产气荚膜梭菌和坏死梭杆菌均呈先下降后升高趋势。产气荚膜梭菌是一种具有荚膜、能产生多种侵袭性酶和外毒素的温和厌氧菌,能感染猪、牛、羊、鸡、鸭、鹅等多种动物,引起肠毒血症、坏死性肠炎等[8];坏死梭杆菌是一种广泛分布于动物肠道内的多形态、革兰氏阴性的严格厌氧菌,能产生多种致病因子如内毒素、白细胞毒素、溶血素和蛋白水解酶类等,可引起多种动物坏死性病变[9]。DEV 感染鸭的主要病变为血管损伤和消化道黏膜出血坏死,推测与产气荚膜梭菌和坏死梭杆菌含量升高存在一定的关联,这有待进一步验证。
