酿酒酵母ZGJ-1在猕猴桃果酒发酵中的研究及应用
2020-11-04孙美玲吴杰雄李新瑞商飞飞
孙美玲,吴杰雄,李新瑞,商飞飞
(1.湖北大学知行学院 粮食与食品工程学院,湖北 武汉 430011;2.贺州学院 食品与生物工程学院,广西 贺州 542899)
以猕猴桃果实为原料,通过酵母菌发酵酿制而成的果酒兼具营养和保健双重功能,既含有猕猴桃维生素C、维生素B族、碳水化合物、蛋白质、脂肪、钙、铁、磷、硒等营养物质;又有发酵型果酒促进血液循环和机体的新陈代谢,控制体内胆固醇水平,改善心脑血管等保健功效[2-3]。王东伟等[4]以黄心猕猴桃为原料发酵果酒,在发酵温度22.07 ℃,初始糖度为22.58°Bx,酵母接种量0.13%条件下,酒精度可达8.94%vol;在果酒陈酿期间,随着陈酿时间的延长,黄心猕猴桃果酒的抗氧化能力和酚类物质含量均有所降低。相同陈酿时间下,4 ℃陈酿的黄心猕猴桃果酒的体外抗氧化能力高于18 ℃陈酿的猕猴桃果酒。孙洪浩等[5]研究了野生猕猴桃发酵最佳工艺参数:果胶酶用量80 mg/L,SO2添加量为72 mg/L,发酵基质初始pH 3.5,活性干酵母接种量300 mg/L,发酵温度25 ℃,该工艺酿造的野生猕猴桃干酒口感丰满、香气协调、维生素C含量高。
酿酒酵母ZGJ-1(专利号:ZL201210561882.X)是项目组人员从自然界野生资源中分离纯化并已改良的高产酒发酵专用菌株,该菌株具备发酵性能强、产香好、产酒品质稳定等特点,并通过了中国典型专利培养物保藏中心鉴定(保藏号为CCTCC NO:2012472)。本研究以项目组分离纯化的纯天然果酒专用菌种ZGJ-1为发酵菌株,采用游离与固定化两种方式发酵猕猴桃汁,制备适合大众口味的猕猴桃果酒,利用单因素及正交试验对其发酵工艺条件进行优化,并考察其抗氧化活性,既实现了菌株ZGJ-1的应用开发,又为猕猴桃的深加工提供了新途径。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
酿酒酵母(Saccharomyces cerevisiae)ZGJ-1:中国典型培养物保藏中心。
1.1.2 化学试剂
蛋白胨、酵母膏、葡萄糖、苯酚、酒石酸钾钠、蔗糖,磷酸二氢钾、偏重亚硫酸钾、海藻酸钠、无水氯化钙、七水硫酸镁:国药集团化学试剂有限公司;果胶酶(20 000 U/g):北京美的生物技术有限公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH):北京Solarbio公司。试验所用试剂均为分析纯或生化试剂。
1.1.3 培养基
斜面培养基:麦芽汁1 000 mL,琼脂20 g,121 ℃高温灭菌20 min。
酵母增殖培养液[6-7]:葡萄糖10.0 g、蛋白胨10.0 g、酵母膏10.0g、七水硫酸镁0.2g、磷酸二氢钾0.2 g,蒸馏水1000 mL,pH 5.0,115 ℃高温灭菌20 min。
1.2 仪器与设备
SYQ-DSX-280D高压蒸汽灭菌锅:上海申安医疗器械厂;THZ-C恒温振荡器:江苏太仓市实验设备厂;SW-CJ-2D净化工作台:苏州净化设备有限公司;WFJ7200可见分光光度计:上海尤尼柯仪器有限公司;PYX-190S-A恒温培养箱:广东韶关科力实验仪器公司;PHS-C酸度计:上海宇隆仪器有限公司;1049酒精计:余姚仪表二厂有限责任公司;TG16-WS高速离心机:长沙平凡仪器仪表有限公司。
1.3 试验方法
1.3.1 游离酵母ZGJ-1制备猕猴桃果酒的工艺流程

1.3.2 固定化酵母ZGJ-1制备猕猴桃果酒工艺流程
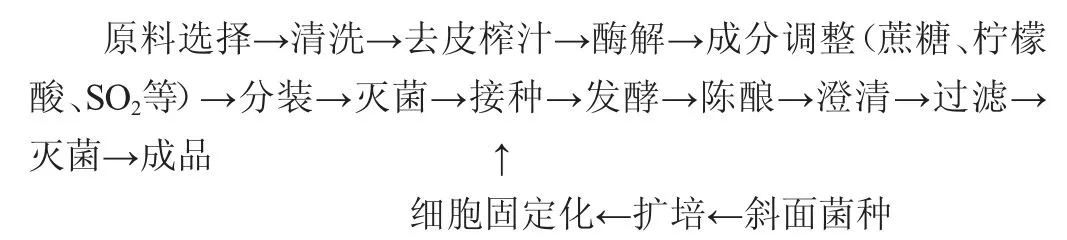
1.3.3 操作要点
猕猴桃果汁原液的制备:挑选成熟度较好的猕猴桃,清洗果皮,去皮后按10%的比例加水榨汁,采用果胶酶澄清过滤,果胶酶使用前按果胶酶∶水=1∶10的比例,采用35 ℃水活化30 min,然后按0.25%比例添加于果浆中混合均匀,静置酶解12 h。加蔗糖、柠檬酸等[8](符合GB 2760—2011《食品添加剂使用标准规定》),调整果汁pH(3.0~4.0)、起始糖度200 g/L,将制备的果汁原液分装到500 mL发酵瓶中(装液量70%),发酵瓶标注游离与固定化,置于95 ℃灭菌15 min,再冷却至常温,待用。
酵母菌ZGJ-1的活化:取28 ℃培养48 h的斜面菌,用无菌水将菌苔洗下,倒入装有玻璃珠的无菌三角瓶中,充分振荡制成菌悬液,使菌悬液的细胞浓度达到(1.8~2.6)×108个/mL。取5%菌悬液加入灭菌增殖培养液中,28 ℃、200 r/min振荡培养32~36 h,得到酵母菌ZGJ-1的活化液。
海藻酸钠溶液2%(包埋剂)[9]:称取1.0 g海藻酸钠,用少量去离子水调成糊状,再加水至40 mL,适当加热溶化,分装到小烧杯10 mL,0.1 MPa灭菌15 min后,冷却至45 ℃备用。
CaCl2溶液(诱导剂)[10-11]:称取无水氯化钙1.5g,用100mL去离子水溶解,并分装于2个250 mL锥形瓶中,0.1 MPa灭菌15 min,冷却备用。
酵母细胞的固定化[12]:无菌状态下,取菌液加入包埋剂中,混匀,凝胶内包埋菌量为(3.8~4.6)×107个/mL;用无菌滴管缓慢而稳定的速度滴入50 mL的氯化钙溶液中,边滴边摇晃锥形瓶,制得直径约为3 mm的凝胶珠;在诱导剂中钙化30 min,用无菌漏勺滤出,用无菌水冲洗3次,即可倒入装有发酵液的对应发酵瓶中,用保鲜膜封口。
接种、前酵:按200 g/L的比例添加蔗糖将果汁总糖进行调节,将游离与固定化酵母菌种ZGJ-1分别接入已灭过菌的果汁液中,接种比例控制在1%~10%,发酵瓶盖密封口,维持起始温度25 ℃静置培养、前酵时间约4~6 d,以糖度的下降量监测发酵的进程,72 h后将温度提高至28 ℃,随着发酵时间的延长,记录对发酵能力的影响程度。
后发酵:当酒精度达到8%vol时,终止前发酵,调整发酵温度为16 ℃进入后发酵阶段,直至总糖含量降至40 g/L终止发酵。
陈酿:将发酵液进行倒罐,于5 ℃条件下陈酿3个月。
澄清、过滤:将陈酿的酒分离得到酒脚,加入适量皂土进行澄清过滤。
灭菌:于75 ℃条件下灭菌15 min,得到猕猴桃果酒成品。
1.3.4 猕猴桃果酒发酵工艺优化正交试验
采用游离酵母及固定化酵母分别制备猕猴桃果酒,在单因素试验基础上,以酒精度及残糖含量为评价指标,用正交试验考察SO2添加量(A)、酵母接种量(B)、起始糖度(C)对猕猴桃果酒品质的影响,优化果酒发酵工艺,正交试验因素与水平见表1。

表1 猕猴桃果酒发酵工艺优化正交试验因素与水平Table 1 Factors and levels of orthogonal experiments for kiwifruit wine fermentation technology optimization
1.3.5 质量检测
猕猴桃果酒感官指标、理化指标测定按照国标GB/T 15038—2006《葡萄酒、果酒通用分析方法》;微生物指标测定按照国标GB 4789—2016《食品安全国家标准食品微生物学检验菌落总数测定》;其他指标测定参照猕猴桃果酒的行业标准QB/T 2027—1994《猕猴桃酒》。
1.3.6 抗氧化能力的测定
(1)羟自由基(·OH)清除率的测定
按照文献[13-14]进行测定,羟基自由基清除率计算公式如下:

式中:A0为未加酒样的测定值;A1为加酒样的测定值;A2为果酒本底测定值。
(2)超氧阴离子自由基(O2-·)清除率的测定
按照文献[15-16]进行测定,超氧阴离子自由基清除率计算公式如下:

式中:A0为空白样吸光度值;AS为待测样品吸光度值。
(3)DPPH自由基(DPPH·)清除率的测定
按照文献[17-18]进行测定,DPPH自由基清除率计算公式如下:
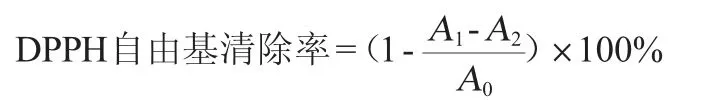
式中:A0为对照的吸光度值;A1为样品反应体系的吸光度值;A2为果酒本底吸光度值。
2 结果与分析
2.1 酵母菌ZGJ-1产酒能力测定
酵母菌种的发酵性能直接影响果酒品质,用发酵能力和繁殖能力较高、抗SO2能力较强的酵母启动发酵,可提高酒精发酵速率,而且酿造的果酒品质好[3]。如图1所示,当采用5%的接种量将游离与固定化酵母分别接种于灭过菌的果汁液中,维持25 ℃恒温发酵时,固定化酵母菌较游离酵母迟缓期的时间要短,72 h后将温度提高至28 ℃,此时固定化酵母进入主酵速度更快,产能代谢物更多。结果表明,固定化酵母发酵所产酒精含量高,产率大,菌种的发酵特性好。

图1 游离与固定化菌种对猕猴桃果酒酒精度的影响Fig.1 Effects of free and immobilized strains on alcohol content of kiwifruit wine
2.2 酵母ZGJ-1发酵全汁猕猴桃果酒工艺参数确立的试验结果
2.2.1 游离酵母ZGJ-1发酵猕猴桃汁最佳发酵工艺参数

表2 游离酵母ZGJ-1发酵猕猴桃汁工艺优化正交试验结果与分析Table 2 Results and analysis of orthogonal experiments for fermentation technology optimization of kiwifruit juice with free yeast ZGJ-1
由表2可知,SO2添加量、酵母接种量和起始糖度均对猕猴桃果酒的酒精度、残糖含量等指标产生了较为显著的影响,影响顺序为B>A>C,即酵母接种量>SO2添加量>起始糖度。以酒精度及残糖含量为评价指标,最佳发酵工艺组合为A2B2C1,即SO2添加量100 mg/L、酵母接种量5%和起始糖度200 g/L。在此最佳发酵工艺条件下,猕猴桃果酒酒精度8.3%vol,残糖35.64 g/L,且酒体色泽均匀、品尝适口。
2.2.2 固定化酵母ZGJ-1发酵猕猴桃汁最佳发酵工艺参数

表3 固定化酵母ZGJ-1发酵猕猴桃汁工艺优化正交试验结果与分析Table 3 Results and analysis of orthogonal experiments for fermentation technology optimization of kiwifruit juice with immobilized yeast ZGJ-1
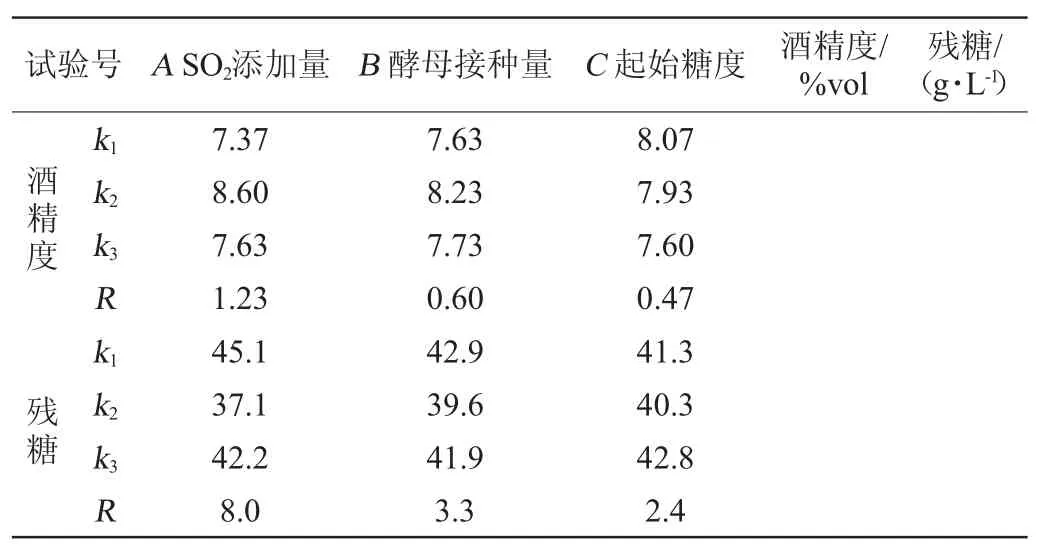
续表
由表3可知,各因素对酒精度及残糖含量的影响顺序为A>B>C,以酒精度及残糖含量为评价指标,正交试验得到的最优发酵工艺组合为A2B2C1,即SO2添加量100 mg/L、酵母接种量5%和起始糖度200 g/L。在此工艺参数下,酿造所得猕猴桃果酒酒精度为9.6%vol,残糖为32.28 g/L,且具有猕猴桃清新的果香和醇厚、清雅、谐调的酒香,口感清爽。
2.3 固定化酵母ZGJ-1发酵猕猴果酒产品的质量检测
由以上试验结果显示,固定化酵母ZGJ-1发酵猕猴桃汁比游离酵母ZGJ-1发酵猕猴桃汁的酒精度、口感、色泽均更好。在发酵工艺条件为SO2添加量100 mg/L、起始糖度200 g/L,灭菌后按5%接种酵母进入前酵。起酵温度25 ℃,主酵温度28 ℃,当酒精度达到8%vol时,终止前发酵,调整发酵温度为16 ℃进入后酵阶段,直至总糖含量降至40 g/L终止发酵。进一步将发酵液进行倒罐,于5 ℃条件下陈酿3个月,分离得到酒脚,加入适量皂土进行澄清过滤,于75 ℃条件下灭菌15 min,得到猕猴桃果酒成品,取样进行检测,猕猴桃果酒质量检测结果见表4~6。

表4 猕猴桃果酒感官评价结果Table 4 Sensory evaluation results of kiwifruit wine
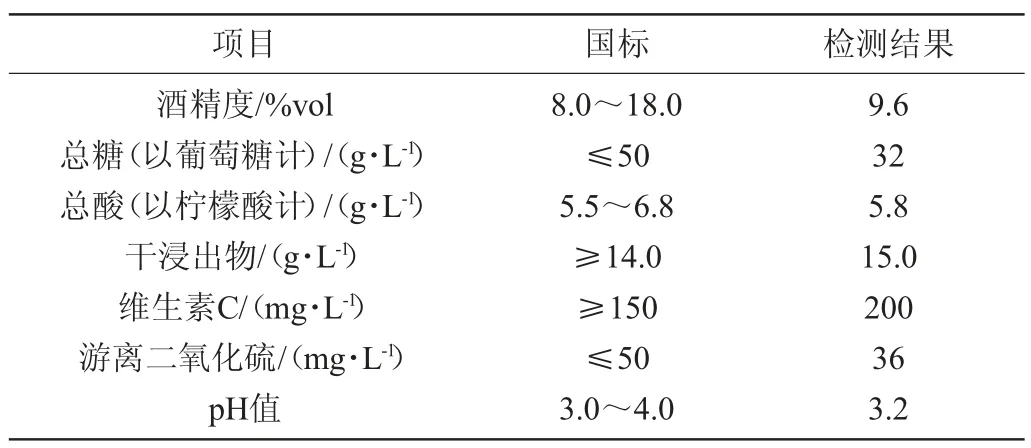
表5 猕猴桃果酒理化指标检测结果Table 5 Determination results of physicochemical indicators of kiwifruit wine

表6 猕猴桃果酒微生物指标检测结果Table 6 Determination results of microorganism indictors of kiwifruit wine
由表4~6可知,猕猴桃果酒感官指标、理化指标、微生物指标均满足相关国标要求。
2.4 固定化酵母发酵的果酒成品抗氧化能力测定结果
DPPH能形成稳定的醇溶性自由基,自由基清除剂存在时可与DPPH自由基单电子配对,使其在波长517 nm处的吸收逐渐消失,与乙醇溶液形成的深紫色变浅,其褪色程度与其接受的电子数成线性关系,从而评价出样品的抗氧化能力[19-20]。由图2可知,采用的3种抗氧化评价方法,其显示的评价结果有一定差异。综合来看,猕猴桃果酒的抗氧化能力是最高的,对·OH、DPPH·及O2-·清除率分别为42%、96%、80%。
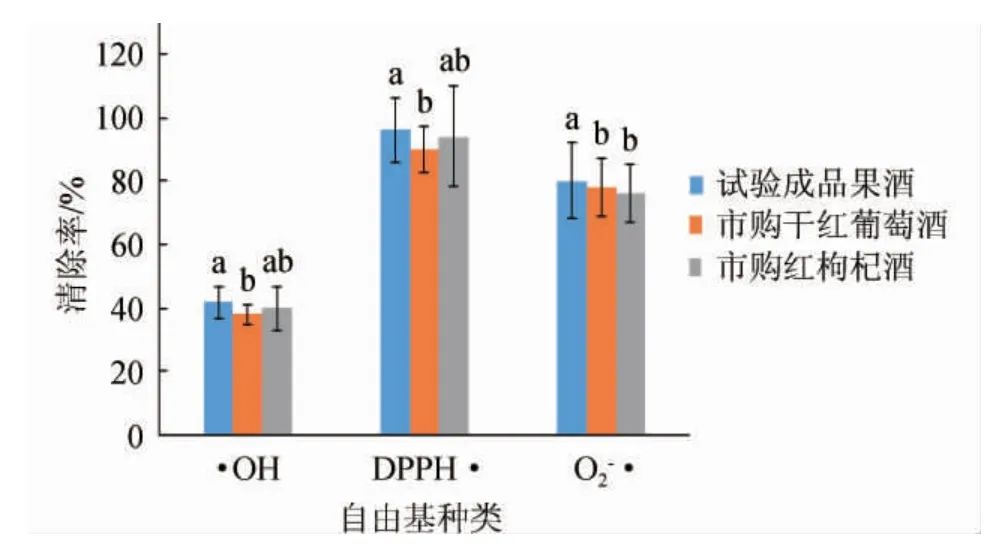
图2 猕猴桃果酒的抗氧化能力检测结果Fig.2 Determination results of antioxidant capacity of kiwifruit wine
3 结论
当固定化与游离酵母菌ZGJ-1对猕猴桃全汁进行发酵,其固定化酵母菌进行发酵的果酒品质明显优于游离酵母菌发酵,且最优参数为SO2添加量100 mg/L、起始糖度200 g/L,后按照200 g/L的比例添加蔗糖将果汁总糖进行补充调节并灭菌,固定化酵母接种量5%时所获得的猕猴桃果酒酒精度≥8%vol,具有典型清爽的猕猴桃果香和浓郁的酒香,口味纯正柔和,风格独特,具有较好的抗氧化能力。
随着对酿酒酵母ZGJ-1在果酒领域的市场开发,将有效解决市场上专用发酵菌种缺乏、产品风味不稳定、产品质量不稳定,比如酒体颜色加重、氧化感增加、果香变淡,失光、沉淀等现象,也将为果农增收、社会生态等产生效益。
