双氢青蒿素通过调控PI3K/AKT通路增强肝癌H22细胞荷瘤小鼠放疗效果*
2020-11-04徐靖达杨公利杜井峰周燕红
徐靖达, 杨公利, 杜井峰, 徐 龙, 周燕红△
(1湖北科技学院五官医学院,湖北咸宁437100;2深圳大学总医院消化内科,深圳大学临床科学研究院肿瘤中心,广东深圳518055)
肝细胞癌(hepatocellular carcinoma,HCC)是临床上常见的恶性肿瘤之一,其发病率居全身恶性肿瘤的第6 位,死亡率位居第3 位,随着人们饮食习惯的改变和环境污染程度加深,全世界HCC 发病率快速攀升,每年因肝癌死亡的患者高达80 万人[1-2]。我国作为HCC 高发地区,每年因HCC 死亡患者约占全世界总数的35%,近几年仍呈不断上升的趋势,严重危害人们的生命健康安全,以往临床上治疗HCC 主要采取手术切除为主,放疗和化疗为辅的手段[3-4]。随着放疗在临床上的应用,精确放疗逐渐成为治疗HCC 的重要手段,但放疗会使机体产生耐受性,导致疗效降低[5-6]。因此,寻找毒副作用小、增敏效果强的增敏药物对提高放疗效果意义重大。
磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)/蛋白激酶B(protein kinase B,AKT)信号通路在肿瘤的发生发展及肿瘤细胞的增殖和凋亡进程中发挥作用,研究显示,通过阻断PI3K/AKT 通路的活化,可以增加食管癌细胞的放疗敏感性[7],提示PI3K/AKT 通路与肿瘤放疗增敏有关。双氢青蒿素(dihydroartemisinin,DHA)是青蒿素体内代谢的主要产物,可通过干扰线粒体-表膜功能,发挥抗炎、免疫调节和抗肿瘤作用[8]。研究显示,DHA 可通过PI3K/AKT 信号通路诱导肿瘤细胞凋亡,起抗肿瘤的作用[9]。然而,DHA 能否通过调控 PI3K/AKT 信号通路以增强肝癌H22 细胞荷瘤小鼠放疗效果尚未可知,因此本研究构建肝癌H22 细胞荷瘤小鼠模型,观察不同剂量DHA 联合放疗对荷瘤小鼠放疗增效和肿瘤生长抑制的影响,并探讨相关因子和PI3K/AKT信号通路蛋白的变化。
材料和方法
1 材料
1.1 试剂和仪器 DHA(货号:81496-82-4)购自上海瀚鸿科技股份有限公司;特级胎牛血清(货号:S9000)、RMPI-1640 培养液(货号:31800)、白细胞介素 2(interleukin-2,IL-2)ELISA 试剂盒(货号:SEKM-0008)和 IL-4 ELISA 试剂盒(货号:SEKM-0005)均购自北京索莱宝科技有限公司;兔抗人AKT抗体(货号:K10080-ZRF)和兔抗人p-AKT 抗体(货号:K10770-IZK)均购自北京百奥莱博科技有限公司;羊抗兔II 抗(货号:FNSA-0015)购自武汉菲恩生物科技有限公司;PrimeScript RT 试剂盒(货号:RR037A)购自 TaKaRa。iBright FL1500 智能成像系统购自Thermo Fisher Scientific。
1.2 细胞株和动物 H22 腹水型HCC 细胞株购自中科院上海细胞库,常规培养,培养液为含10%胎牛血清、1×105U/L 青霉素和 100 mg/L 链霉素的 RMPI-1640 培养液,培养条件为饱和湿度、5% CO2、37℃恒温培养箱,隔天换液,胰酶消化传代,取对数生长期的H22 细胞用于实验。SPF 级昆明小鼠购自四川大学实验动物中心,许可证号为SCXK(川)2018-0002,体重18~22 g,6~8 周龄,雌雄各半,均常规适应性培养一周后用于后续实验。
2 方法
2.1 建造肝癌H22 细胞荷瘤小鼠模型 用预冷的生理盐水调整H22 细胞密度为1.0×1010/L,用75%乙醇消毒待注射部位皮肤,用无菌注射器将细胞悬液以每只0.2 mL 的体积接种于小鼠右肢皮下。待小鼠瘤直径约7 mm 时,剥离皮下肿瘤,继续按照上述步骤在小鼠体内传代,以第3 代荷瘤小鼠作为模型进行后续实验。
2.2 实验动物分组及给药方法 荷瘤小鼠模型构建成功1 周后,根据小鼠肿瘤大小均匀分组,每组8只,分别为:(1)模型(model)组;(2)单放疗(single radiotherapy)组;(3)5-氟尿嘧啶(5-fluorouracil,5-FU;25 mg/kg[10])组;(4)DHA 低剂量(25 mg/kg)组;(5)DHA 中剂量(50 mg/kg)组;(6)DHA 高剂量(100 mg/kg)组[11]。DHA在超声条件下用DMSO配制成母液,随后用RMPI-1640 培养液稀释至所需浓度(DMSO终体积<0.1%)。阳性药5-FU和DHA均在放疗前30 min 腹腔注射,给药体积为每只200 μL。模型组腹腔注射含有等体积分数DMSO 的生理盐水。每天1 次,治疗21 d。放疗方法:在各组小鼠清醒状态下,以137Cs 作为照射源,照射剂量5 Gy,照射剂量率0.50 Gy/min。暴露小鼠肿瘤部位,其余部位均用铅板遮挡。
2.3 观察指标 隔天测量各组荷瘤小鼠体重和瘤体积。观察小鼠一般活动状态和精神面貌。给药结束后,取血并立刻脱颈处死各组荷瘤小鼠,剥离肿瘤,称重并记录,测定淋巴细胞转化程度[脂多糖(lipopolysaccharide,LPS)和伴刀豆球蛋白A(concanavalin A,ConA)刺激指数(stimulating index,SI)]和自然杀伤(natural killer,NK)细胞活性(采用MTT法测定)。根据公式计算增敏系数(enhancement factor,EF)、肿瘤生长抑制率和肿瘤生长延缓时间。肿瘤生长抑制率(%)=(1-治疗组平均瘤重/模型组平均瘤重)×100%;肿瘤生长延缓时间(tumor growth delay,TGD)=治疗组TGT3-空白组TGT3(TGT3指肿瘤体积生长至放射治疗前3 倍所需时间);EF=给药组TGD/单放疗组TGD。当EF>1,说明药物具有放疗增效作用。
2.4 ELISA 法检测各组小鼠血清因子 治疗结束后,鼠尾抽取各组小鼠外周血,静置30 min,离心取上清,按照ELISA试剂盒说明书测定IL-2和IL-4水平。
2.5 RT-qPCR 测定各组小鼠肿瘤组织中PI3K 和AKT mRNA 表达水平 从液氮中取出各组荷瘤小鼠肿瘤组织,提取组织总RNA,用PrimeScript RT 试剂盒合成cDNA,以其为模板,进行PCR 扩增。反应条件:预变性95℃ 3 min;变性95℃ 5 s,退火60℃ 30 s,48 个循环。PI3K 的上游引物序列为5'-CTCCACGACCATCATCAG-3',下游引物序列为 5'-TTCTTCACGGTTGCCTAC-3';AKT 的上游引物序列为 5'-GTATGCTGGCAGAGTAGGAGAAC-3',下游引物序列为5'-CAGGTAACATCAGAGACAGACACA-3';GAPDH 的上游引物序列为5'-GATACAGTTCCCGTGTTGTTGAC-3',下游引物序列为5'-CATAAAGACACATAACACCACACTC-3'。以 GAPDH 为内参照,采用2-ΔΔCt法计算PI3K和AKT的相对表达量。
2.6 Western blot 法测定各组小鼠肿瘤组织中PI3K、AKT 和p-AKT 的蛋白表达水平 从液氮中取出各组荷瘤小鼠肿瘤组织,置于含有蛋白酶抑制剂的研钵中,研磨均匀,根据BCA试剂盒说明书测定总蛋白含量,与20 μL 5×缓冲液混合,100℃预处理10 min,凝胶电泳分离目标蛋白,低压80 V、30 min,高压120 V、90 min,湿法转膜,5%脱脂奶粉封闭后加入I 抗(1∶1 000 稀释),4℃下孵育过夜,再加入II 抗(1∶1 000稀释),室温杂交1 h,显色,测定条带灰度值。蛋白相对含量=目标蛋白灰度值/内参照蛋白灰度值。
3 统计学处理
使用SPSS 22.0 软件对数据进行统计分析。数据以均数±标准差(mean±SD)表示。多组间均数比较采用单因素方差分析,两两比较采用SNK-q检验。以P<0.05为差异有统计学意义。
结 果
1 不同剂量的DHA 对H22 细胞荷瘤小鼠的放疗增效作用
与模型组相比,单放疗组TGT3显著升高(P<0.05),与单放疗组相比,低、中、高剂量DHA 组TGT3进一步升高(P<0.05),随着DHA 剂量的升高而升高(P<0.05),高剂量组TGT3与5-FU组相比差异无统计学意义(P>0.05);各剂量DHA 组EF 随着DHA 剂量的升高而升高(P<0.05),高剂量组与5-FU 组相比差异无统计学意义(P>0.05),见表1。

表1 DHA联合放疗对荷瘤小鼠肿瘤生长的影响Table 1.Effect of DHA combined with radiotherapy on tumor growth in tumor-bearing mice(Mean±SD. n=8)
2 不同剂量的DHA 联合放疗对H22 细胞荷瘤小鼠肿瘤生长的抑制作用
与模型组相比,单放疗组肿瘤体积和重量均显著降低(P<0.05),与单放疗组相比,低、中、高剂量DHA 组肿瘤体积和重量进一步降低(P<0.05),且随着DHA 剂量的升高而降低(P<0.05),高剂量组与5-FU 组相比差异无统计学意义(P>0.05);与单放疗组相比,各剂量DHA 组抑瘤率均显著升高(P<0.05),且随着DHA 剂量的升高而升高(P<0.05),高剂量组与5-FU 组相比差异无统计学意义(P>0.05),见图1、2和表2。

Figure 1.Representative images showing the size of the tumors from tumor-bearing mice in each group.A:model group; B: single radiotherapy group; C: 5-FU group;D:low-dose DHA group;E:middle-dose DHA group;F:high-dose DHA group.图1 各组荷瘤小鼠肿瘤大小的代表性图片
3 各组荷瘤小鼠淋巴细胞转化程度和NK细胞活性
与模型组相比,单放疗组荷瘤小鼠淋巴细胞转化程度和NK细胞活性均显著降低(P<0.05);与单放疗组相比,低、中、高剂量DHA 组淋巴细胞转化程度和NK 细胞活性均显著升高(P<0.05),且随着DHA剂量的升高而升高(P<0.05);5-FU 组淋巴细胞转化程度和NK细胞活性均低于DHA组,见表3。
4 各组小鼠血清IL-2和IL-4水平
与模型组相比,单放疗组荷瘤小鼠血清IL-2 和IL-4 水平显著降低(P<0.05);与单放疗组相比,各剂量DHA 组荷瘤小鼠血清IL-2 和IL-4 水平显著升高(P<0.05),且随着 DHA 剂量的升高而升高(P<0.05);5-FU 组小鼠血清 IL-2和IL-4 水平均低于DHA组,见表4。

Figure 2.Changes of tumor volume in tumor-bearing mice of each group.Mean±SD. n=8.*P<0.01 vs model group;#P<0.05 vs single radiotherapy group;△P<0.05 vs low-dose DHA group;▲P<0.05 vs middledose DHA group.图2 各组荷瘤小鼠肿瘤体积的变化

表2 不同剂量的DHA 联合放疗对H22 细胞荷瘤小鼠肿瘤生长的抑制作用Table 2.Inhibitory effect of different doses of DHA combined with radiotherapy on tumor growth in H22 cell tumorbearing mice(Mean±SD. n=8)
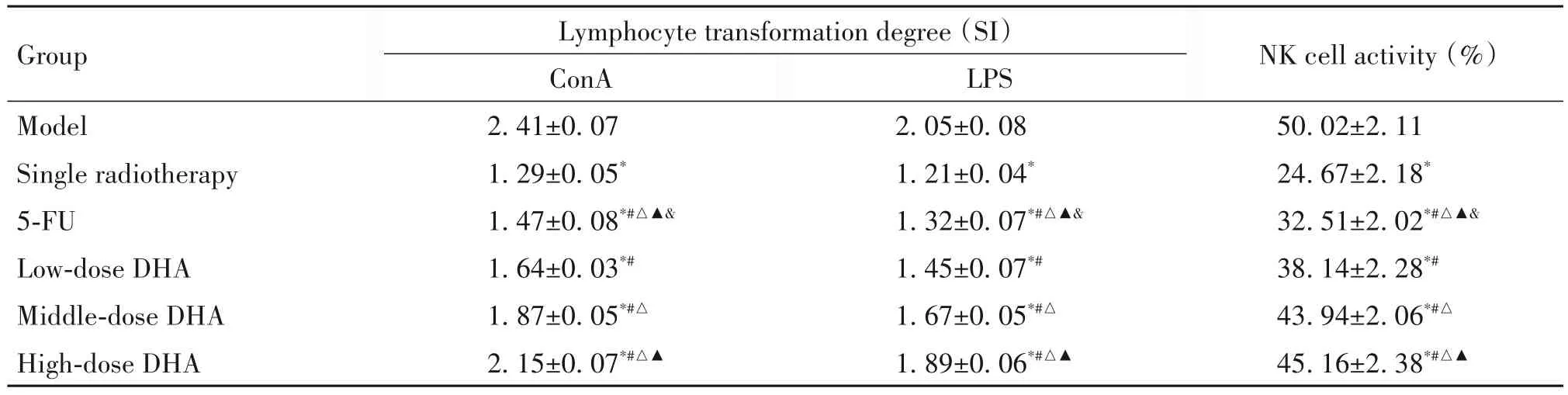
表3 各组荷瘤小鼠淋巴细胞转化程度和NK细胞活性Table 3.lymphocyte transformation degree and NK cell activity of tumor bearing mice in each group(Mean±SD.n=8)
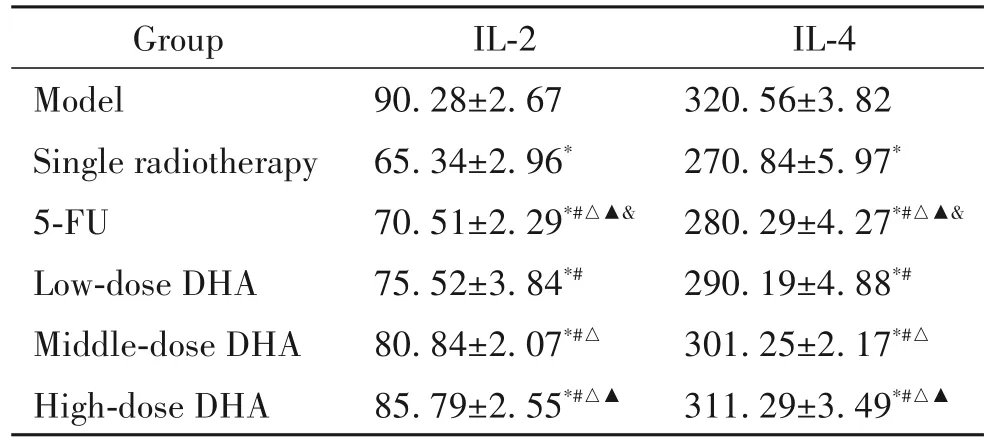
表4 各组小鼠血清因子IL-2和IL-4水平Table 4.The levels of serum factors IL-2 and IL-4 in each group(ng/L.Mean±SD. n=8)
5 DHA 联合放疗对H22 细胞荷瘤小鼠PI3K 和AKT mRNA表达的影响
与模型组相比,单放疗组PI3K 和AKT 的mRNA表达水平显著降低(P<0.05);与单放疗组相比,低、中、高剂量DHA组PI3K和AKT的mRNA表达水平进一步降低(P<0.05),且随着DHA 剂量的升高而降低(P<0.05),见图3。
6 DHA 联合放疗对H22 细胞荷瘤小鼠PI3K/AKT通路蛋白表达的影响
与模型组相比,单放疗组AKT 表达水平无显著变化(P>0.05),PI3K 表达水平和AKT 磷酸化水平显著降低(P<0.05);与单放疗组相比,低、中、高剂量DHA 组PI3K 表达水平和AKT 磷酸化水平显著升高(P<0.05);随着DHA 剂量的升高,PI3K 表达水平和AKT磷酸化水平随之降低(P<0.05),见图4和表5。
讨 论
青蒿素是一种抗肿瘤药物,研究显示,青蒿素是结直肠癌细胞株的辐射敏感剂,可以显著增加放射线对结直肠癌Lovo 细胞的抑制作用,强化放射线诱导细胞凋亡的发生[12]。DHA 是青蒿素的衍生物,能够抑制或杀伤机体大部分肿瘤细胞,有效提高治疗肺癌的疗效[13],研究显示,DHA能明显抑制肺癌细胞增殖,增加其放疗敏感性[14]。本研究显示,相比于模型组,单放疗组和低、中、高剂量 DHA 组 TGT3、EF 和抑瘤率显著升高,DHA 治疗组较单放疗组瘤重显著降低,且呈浓度依赖性,提示DHA 具有放疗增效的作用,放疗联合DHA 能够更好地提高肝癌H22 细胞荷瘤小鼠对放疗的敏感性,抑制肿瘤生长。但是,DHA通过哪种途径以增强放疗敏感性还有待进一步研究。

Figure 3.The mRNA expression levels of PI3K and AKT in tumor tissues from H22 cell tumor-bearing mice in different groups.Mean±SD. n=8.*P<0.01 vs model group;#P<0.05 vs single radiotherapy group;△P<0.05 vs low-dose DHA group;▲P<0.05 vs middledose DHA group.图3 不同组H22 细胞荷瘤小鼠肿瘤中PI3K 和AKT 的mRNA表达水平

Figure 4.The protein levels of PI3K,AKT and p-AKT in tumor tissues from H22 cell tumor-bearing mice in different groups.A:model group;B:single radiotherapy group;C:5-FU group;D:low-dose DHA group;E:middle-dose DHA group;F:high-dose DHA group.图4 不同组H22 细胞荷瘤小鼠肿瘤中PI3K、AKT 和p-AKT的蛋白水平

表5 不同组H22细胞荷瘤小鼠肿瘤中PI3K、AKT和p-AKT的蛋白水平Table 5.The protein levels of PI3K,AKT and p-AKT in tumor tissues from H22 cell tumor-bearing mice in different groups(Mean±SD. n=8)
随着病程的发展和恶化,肝癌患者常伴有免疫功能下降或障碍,特别在接受化疗和放疗的患者表现更严重,影响放疗疗效,使患者生存质量下降[15]。淋巴细胞增殖程度可反映机体免疫功能,可由淋巴细胞转化程度体现,IL-2 作为T 细胞亚群生长因子可由 CD4+和 CD8+细胞分泌,可活化 B 细胞增殖[16-17]。IL-4水平是衡量疫苗免疫的重要指标,可诱导Th0细胞分化为 Th2 细胞[18]。此外,NK 细胞高活性可释放颗粒酶B、IFN-γ、穿孔素等细胞因子,以杀伤肿瘤细胞[19]。本研究显示,与模型组相比,单放疗组荷瘤小鼠淋巴细胞转化程度、NK 细胞活性及IL-2 和IL-4 水平显著降低,说明放疗降低机体免疫功能;DHA 治疗组较单放疗组荷瘤小鼠淋巴细胞转化程度、NK 细胞活性及IL-2 水平和IL-4 水平显著升高,而5-FU 组均低于DHA 组,说明放疗联合DHA 能够提高荷瘤小鼠免疫能力,以增强放疗效果。
PI3K/AKT 信号通路不仅参与调控肿瘤增殖和凋亡的过程,也与肿瘤细胞放化治疗的敏感性密切相关。张明等[20]研究显示,通过抑制PI3K/Akt 信号通路激活,可以抑制结肠癌细胞增殖,促进细胞凋亡,从而提高结肠癌细胞的放射敏感性。本研究显示,与模型组相比,单独放疗组中PI3K 和AKT 的mRNA 及PI3K 和p-AKT 的蛋白表达水平显著降低,说明PI3K/AKT 信号通路与放疗治疗有关。张雷等[21]研究显示,DHA 可能通过激活线粒体凋亡途径并抑制PI3K/AKT 信号通路活性,以增强Rajj 细胞对放射的敏感性。本研究显示,DHA 治疗组较单放疗组 PI3K和AKT 的 mRNA 及 PI3K和p-AKT 的蛋白表达水平显著降低,呈剂量依赖性,高剂量组与5-FU组相当,说明随着DHA 剂量升高,PI3K/AKT 信号通路活性抑制程度越高,提示DHA 可能通过抑制PI3K/AKT信号通路活性,以增强放疗疗效。
综上所述,DHA 可能通过抑制PI3K/AKT 信号通路活性,提高荷瘤小鼠免疫能力,从而增强放疗效果。
