表没食子儿茶素没食子酸酯对2型糖尿病大鼠GLUT2/G6PD/GS表达和血糖调节的研究*
2020-11-04买文丽佘光鹏吕寅春
买文丽 , 郭 洋 , 佘光鹏 , 吕寅春 , 郑 倩 , 刘 华 △
(川北医学院 1生理教研室,2机能中心,3形态研究所,4临床医学系,四川南充67000)
2017 年全球糖尿病患者已达到4.25 亿,我国糖尿病患者高达1.14 亿,为全球之首,其中,2 型糖尿病占糖尿病发病率的90%[1-2]。高血糖导致多器官损害,因此控制血糖是糖尿病治疗的首要任务。目前2型糖尿病治疗的口服药物虽然众多,但是均有较大的副作用,能否选用治疗效果好副作用小的植物类降糖药是目前研究的热点。
作为物质代谢的中心,肝脏在维持糖代谢稳态中具有不可替代的作用[3]。葡萄糖转运蛋白2(glucose transporter 2,GLUT2)是肝细胞主要的葡萄糖转运体,其转位水平或含量降低会导致摄取葡萄糖能力下降,使血糖升高[4]。葡萄糖-6-磷酸脱氢酶(glucose-6-phosphate dehydrogenase,G6PD)是葡萄糖代谢通路中重要的酶,能调控葡萄糖-6-磷酸(glucose-6-phosphate,G-6-P)的含量[5],而糖原合酶(glycogen synthase,GS)能将G-6-P 变为糖原,储存于肝细胞。因此GLUT2-G6PD-GS 途径是糖原储存的重要途径,在调节血糖方面的研究也备受关注。
表没食子儿茶素没食子酸酯(epigallocatechin gallate,EGCG)是绿茶中儿茶素的主要成分,占儿茶素总量的10%~15%。Ueda-Wakagi 等[6]证实,EGCG通过刺激骨骼肌中GLUT4 转位来增加葡萄糖摄取,从而改善糖尿病啮齿动物的血糖水平。肝脏发生胰岛素抵抗后,肝糖异生和糖原分解能力提高,导致肝脏葡萄糖输出增加,血糖升高[7]。EGCG 具有激活细胞特异信号通路,改善靶组织对胰岛素敏感度的作用[8]。但 EGCG 通过 GLUT2-G6PD-GS 信号通路调节血糖的研究目前尚未见报道。本项工作探讨EGCG对2 型糖尿病大鼠的降糖作用,并了解其是否通过GLUT2-G6PD-GS信号通路来实现对血糖的调控。
材料和方法
1 动物
清洁级4 周龄雄性健康SD 大鼠60 只,由川北医学院实验动物中心提供,体重(120±20)g。动物实验遵守国际实验动物伦理学要求。动物合格证号SYXK(川)2018-076。
2 药品
EGCG(批号为1220C022)和链脲佐菌素(streptozotocin,STZ;批号为615F031)均购自Solarbio;高脂饲料(D12492)购自Research Diets。
3 主要试剂
血糖试纸(批号为3825NS)购自三诺有限公司;糖化血红蛋白试剂盒(批号为20180306)和胰岛素试剂盒(批号为20180317)均购自南京建成生物研究所;抗GLUT2 抗体(批号为00051063)购自Protentech;BCA 蛋白测定盒(批号为14G08A46)购自博士德公司;高碘酸-希夫(periodic acid-Schiff,PAS)糖原染色试剂盒(批号为20190704)购自Solarbio;RNA 逆转录试剂盒(批号为AJ60874A)和定量PCR试剂盒(批号为AJ12469A)均购自TaKaRa。
4 主要方法
4.1 动物分组和模型的建立 2型糖尿病大鼠模型的建立参照既往方法[9]。动物适应性饲养1 周后高脂饲料喂养 4 周,空腹12 h 后给予 STZ(25 mg/kg),腹腔注射,注射前用pH 4.5 枸橼酸缓冲液配成1%浓度,正常组大鼠用等量枸橼酸缓冲液处理,继续高脂饲料喂养4 周后采尾静脉血测定空腹血糖(fasting blood glucose,FBG)和空腹血清胰岛素(fasting serum insulin,FINS),并计算胰岛素敏感指数(insulin sensitivity index,ISI),以FBG≥11.1 mmol/L 作为 2 型糖尿病模型判断标准[10-12]。实验动物设立5 组,每组10 只:正常(control,Con)组、糖尿病模型(model,M)组、二甲双胍(metformin,Met;200 mg/kg)组、低剂量(50 mg/kg)EGCG(EL)组和高剂量(100 mg/kg)EGCG(EH)组[13]。Met和EGCG 持续灌胃给药 8 周,其余2 组均灌服生理盐水(0.1 mL/kg)。动物饲养于川北医学院动物实验中心,自由饮水,治疗期间,全部大鼠常规饲料饲养。饲养期间定期检测动物FBG和FINS 水平。8 周后,M 组大鼠死亡一只。实验动物于治疗8周末空腹12 h,从心脏采血制备血浆和血清标本,-80℃保存待测;断髓处死动物,每组动物摘取部分肝脏迅速冻存于液氮中待测,再取部分肝脏4%多聚甲醛固定做石蜡切片。
4.2 血糖和胰岛素检测 取大鼠尾静脉血测定血糖,用血糖仪及配套的试纸定期检测,方法参照说明书。胰岛素测定具体操作步骤严格按试剂盒说明书进行。
4.3 糖化血红蛋白检测 实验动物于治疗8 周末空腹12 h,然后从心脏采血2 mL,肝素抗凝,1 500×g离心 30 min,取上清,加入 96 孔板,按 ELISA 试剂盒说明步骤进行操作,酶标仪测量结果。
4.4 PAS 染色 将石蜡包埋的肝组织切片,厚度设定为5 μm,每个组织切3 片,根据PAS 染色试剂盒使用说明书步骤进行,高倍镜镜检、拍照、保存图片。
4.5 real-time PCR 检测 G6PD mRNA 的表达 液氮冷冻加入Trizol快速研磨肝脏组织提取总RNA,然后RNA 逆转录成cDNA,使用特异性引物对cDNA 进行定量PCR 扩增。G6PD 的正向引物序列为5'-ACCGCATCGACCACTACCT-3',反向引物序列为5'-TGGGGCCGAAGATCCTGTT-3'。PCR 条件为:95℃预变性10 min;95℃变性15 s,60℃退火30 s,60℃延伸30 s,循环40次;之后进行熔解曲线分析。以βactin 为内参照,用 2-ΔΔCt法测定 G6PD mRNA 的相对表达量[14]。
4.6 Western blot 法检测大鼠肝脏中GS 和GLUT2的表达 在冰上研磨肝组织,离心30 min,取上清液,BCA 法测蛋白浓度,加上样缓冲液后进行蛋白变性备用。12% SDS-PAGE 分离蛋白,半干转转至PVDF 膜后,5% BSA 封闭 2 h,分别加入兔抗 GS 和GLUT2 多克隆抗体(1∶1 000),4℃摇床孵育过夜,TBST 洗涤 6 次,每次 5 min,然后加入 HRP 标记的山羊抗兔Ⅱ抗(1∶2 000),摇床上孵育1 h,TBST 洗涤6次,每次5 min,化学发光试剂发光显影,在凝胶成像系统Fusion Fx5 Spectra 进行曝光和拍照,用ImageJ软件进行灰度分析[15-16]。
4.7 免疫组织化学染色检测GLUT2 将固定在4%多聚甲醛的肝脏组织经梯度乙醇脱水、二甲苯透明,石蜡包埋,随后进行连续切片厚度5 μm,切片于37℃过夜,经二甲苯脱蜡,梯度乙醇复水,于37℃用过氧化氢孵育10 min 以去除内源性过氧化物酶的影响,随后用柠檬酸缓冲液100℃,15 min,之后加入Ⅰ抗(抗GLUT2 抗体,1∶150),4℃孵育过夜,PBS 清洗3 次之后滴加Ⅱ抗,免疫组化反应通过使用SABC 扩增,用3'-3-二氨基联苯胺显色,并用苏木精复染。使用ImageJ图像分析软件分析[14]。
5 统计学处理
采用SPSS 20.0 软件进行统计学分析。数据以均数±标准差(mean±SD)表示。多组间比较采用单因素方差分析。以P<0.05为差异有统计学意义。
结 果
1 EGCG干预前各组大鼠FBG、FINS和ISI的变化
与 Con 组比较,M、Met、EL和EH 组大鼠 FBG、FINS 和体重均显著升高(P<0.05),ISI显著降低(P<0.01);M、Met、EL 和EH 组大鼠FBG、FINS、体重和ISI的组间比较均无显著差异(P>0.05),见表1。

表1 EGCG干预前各组大鼠FBG、FINS和ISI的变化Table 1.The levels of FBG,FINS and ISI in rats of different groups before EGCG intervention(Mean±SD. n=10)
2 EGCG干预后各组大鼠FBG、FINS和ISI的变化
与 Con 组比较,M 组大鼠 FBG 与 FINS 均显著升高(P<0.05),体重显著降低(P<0.05),ISI 显著降低(P<0.01);与 M 组比较,Met、EL和EH 组 FBG 与FINS 均显著降低(P<0.05),ISI 显著升高(P<0.01),Met 和EH 组体重显著升高(P<0.05);Met、EL 和EH组大鼠FBG、FINS 与ISI 的组间比较均无显著差异(P>0.05),见表2。
3 EGCG对糖化血红蛋白的影响
与Con 组比较,M 组大鼠糖化血红蛋白显著升高(P<0.05);与M组比较,给药组大鼠糖化血红蛋白均显著降低(P<0.05);给药组之间糖化血红蛋白无显著差异(P>0.05),见图1。
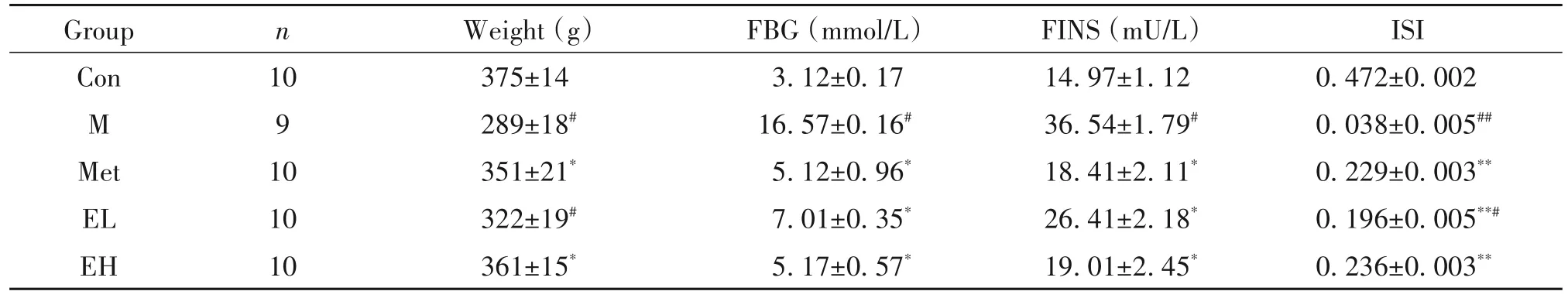
表2 EGCG干预后各组大鼠FBG、FINS和ISI的变化Table 2.The levels of FBG,FINS and ISI in rats of different groups after EGCG intervention(Mean±SD)

Figure 1.The levels of glycosylated hemoglobin in different groups.Mean±SD. n=9.#P<0.05 vs Con group;*P<0.05 vs M group.图1 各组大鼠糖化血红蛋白的变化
4 肝组织糖原PAS染色
Con 组、Met 组和EH 组肝细胞胞质内见大量特征性玫瑰红糖原颗粒,而M 组胞质内几乎见不到玫瑰红糖原颗粒,EL 组胞质中可见少量糖原颗粒,淀粉酶消化后,上述阳性颗粒消失,见图2。
5 EGCG对肝组织G6PD mRNA的影响
与 con 组比较,m 组大鼠肝脏 G6PD mRNA 显著降低(P<0.05);与m 组比较met 组和EH 组大鼠肝脏G6PD mRNA 显著增高(P<0.05);Met和EH 给药组之间大鼠肝脏G6PD mRNA 无显著差异(P>0.05),见图3。
6 EGCG对肝组织GLUT2和GS蛋白表达的影响
Western blot 结果表明,与 con 组大鼠比较 m 组大鼠肝脏GS 的蛋白表达水平显著降低(P<0.05);与m 组比较met 组和EH 组大鼠肝脏GS 的蛋白表达水平显著增加(P<0.05)。与con 组比较m 组肝细胞GLUT2 蛋白表达水平显著降低(P<0.05),与m 组比较met 组和EH 组大鼠肝细胞GLUT2 的蛋白表达水平显著增加(P<0.05),见图4、5。
7 EGCG对肝组织GLUT2蛋白表达的影响
免疫组织化学结果显示,未受刺激时GLUT2 大量分布在胞质;与Con 组比较,M 组肝细胞胞质内棕色GLUT2颗粒明显减少;与M组比较,给药组肝细胞胞质内棕色GLUT2 颗粒明显增加,EH 组肝细胞胞质中棕色GLUT2颗粒较EL组明显增加,见图6。

Figure 2.Glycogen in hepatic tissues of different groups was detected by PAS staining(shown by arrows).Scale bar=20 μm.A:Con group;B:M group;C:Met group;D:EL group;E:EH group.图2 各组大鼠肝组织糖原合成情况

Figure 3.Relative mRNA expression levels of G6PD in hepatic tissues of each group.Mean±SD. n=9.#P<0.05 vs Con group;*P<0.05 vs M group.图3 各组大鼠肝组织G6PD mRNA的表达
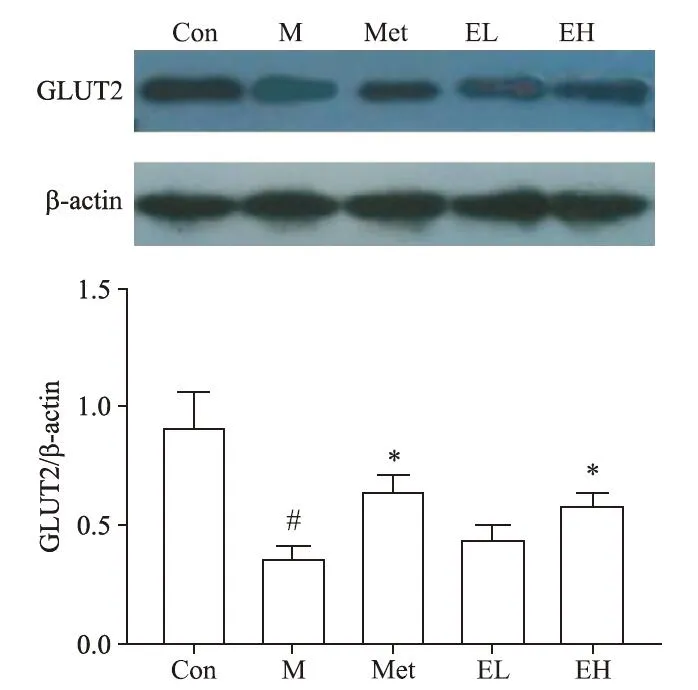
Figure 4.The protein expression levels of GLUT2 in hepatic tissues of different groups detected by Western blot.Mean±SD. n=6.#P<0.05 vs Con group;*P<0.05 vs M group.图4 各组大鼠肝组织GLUT2蛋白水平表达
讨 论
Hu等[17]的研究显示过去30年来,中国糖尿病患病率急剧增加,已成为全球糖尿病患者人数最多的国家,对糖尿病动物模型的研究有利于人类对糖尿病发病机制和治疗的探索。高脂饲养+小剂量STZ腹腔注射,是目前复制2 型糖尿病大鼠普遍选用的方法[18]。本研究模型组大鼠多次空腹血糖≥11.1 mmol/L,EGCG 干预前大鼠 FBG和FINS 水平均显著升高,ISI 显著降低,表明模型大鼠病理特点与2 型糖尿病病理相符,说明造模成功[10-12]。经二甲双胍和EGCG 治疗后FBG 在正常范围,FINS 水平和糖化血红蛋白显著降低,ISI 显著升高,但EL 组治疗效果弱于EH组,证明EGCG 确实可以减低血糖,改善2型糖尿病症状,与前期研究结果相符[6]。

Figure 5.The protein expression levels of GS in hepatic tissues of different groups detected by Western blot.Mean±SD. n=6.#P<0.05 vs Con group;*P<0.05 vs M group.图5 各组大鼠肝组织GS蛋白水平表达
生理状态下,肝脏的糖原合成、分解以及糖异生处于动态平衡,从而维持血糖浓度的稳定[19]。餐后糖原储存能力可以反应肝脏的胰岛素敏感性[7],本研究中正常组大鼠肝糖原储备丰富,而模型组大鼠肝细胞内仅见散在少许糖原颗粒,说明模型组大鼠肝细胞发生胰岛素抵抗,导致糖原储存障碍。而给药组大鼠肝细胞内可见丰富糖原颗粒,说明EGCG确实有改善胰岛素抵抗的作用,与之前报道一致[20]。
餐后葡萄糖进入肝脏最主要的路径就是经GLUT 途径进行的转运,肝细胞内主要是 GLUT2[21]。本研究中模型组大鼠肝脏GLUT2 水平显著降低,考虑与STZ 的毒性破环,使肝细胞产生胰岛素抵抗,导致 GLUT2 蛋白表达减少[22-23]有关。本研究中 Met 和EH 组大鼠肝脏GLUT2 蛋白表达显著增高,表明EGCG 可通过改善肝细胞的胰岛素抵抗,促进GLUT2蛋白合成,并且表现出剂量依赖性。
肝糖原的GLUT2-G6PD-GS 合成路径中,GLUT2是葡萄糖转运的门户,GS 是糖原合成中的限速酶[24],G-6-P 是 GS 的变构激活剂[25],能激活 GS。因此,GS 的变构状态和G6PD 含量影响糖原合成。本实验中模型组大鼠G6PD mRNA 含量下降,而Met 和EH 组 G6PD mRNA 显著高于模型组,表明 EGCG 可以通过转录水平影响G6PD mRNA 表达,增加G6PD合成,有利于调节G-6-P 含量,降低血糖。模型组总GS蛋白水平显著下降,而给药组GS蛋白水平显著增高,可能是模型组GS 过度磷酸化,而EGCG 能减轻GS 磷酸化程度,更好的促进糖原合成。此外,实验结果可见高剂量EGCG 对给药组大鼠GLUT2/G6PD/GS 改善作用优于低剂量,表现出EGCG 治疗的剂量依赖性。但本研究中GS 磷酸化水平的检测未涉及,这也是研究的不足之处,在后续的研究中,还需要进一步实验证实。

Figure 6.Expression of GLUT2 in hepatic tissues of different groups was detected by immunohistochemical staining(shown by arrows).Scale bar=20 μm.A:Con group;B:M group;C:Met group;D:EL group;E:EH group.图6 各组大鼠肝组织GLUT2的分布
综上所述,本实验中给予EGCG 后糖尿病大鼠空腹血糖、空腹胰岛素水平和糖化血红蛋白均降低,同时肝糖原含量增加,说明EGCG 通过增加肝糖原储存来降低血糖。进一步研究显示给予EGCG 后大鼠肝细胞膜上GLUT2 和G6PD mRNA 表达增加,GS蛋白水平增加,证明EGCG 确实可以通过影响GLUT2-G6PD-GS 路径,增加肝糖原合成和储存,最终实现降低血糖改善糖尿病的作用。
