肺纤维化合并肺气肿综合征并发肺动脉高压患者的临床特征分析
2020-11-04
慢性阻塞性肺疾病、间质性肺疾病和肺纤维化合并肺气肿综合征(combined pulmonary fibrosis and emphysema,CPFE)是引起肺部疾病或低氧性疾病相关性肺动脉高压的三大常见肺部疾病[1]。慢性阻塞性肺疾病与间质性肺疾病临床上常见,根据病史、肺功能及典型影像学表现,不易误诊和漏诊;但CPFE 相对少见,临床医生认识不足,一旦并发肺动脉高压,容易误诊为特发性肺动脉高压。肺纤维化与肺气肿的病理及影像学特征不同,属于两种不同类型的肺部疾病。但近年研究发现两者可并存,即CPFE。虽然CPFE 目前缺乏统一的诊断标准,但CPFE 具有独特的临床、影像学及肺功能特征,如CPFE 好发于多年吸烟的老年男性,胸部高分辨CT 可见上肺肺气肿及下肺纤维化改变,肺功能多合并严重弥散功能减低,肺功能变化与肺部影像学改变不匹配等。相对于慢性阻塞性肺疾病与间质性肺疾病,CPFE 更易并发肺动脉高压[2]。一旦并发肺动脉高压,病程进展迅速,预后差,5 年生存率仅25%~55%,至今尚无有效药物治疗[3-7]。目前国内外CPFE 并发肺动脉高压的相关报道较少,且少有进行过右心导管检查确诊,本研究通过收集2017~2019 年我院肺血管病中心经右心导管检查诊断为CPFE 并发肺动脉高压患者的临床资料,分析CPFE 合并肺动脉高压的临床特征,以期提高对CPFE 的认识,减少误诊和漏诊。
1 资料与方法
研究对象和方法:本研究为回顾性观察研究,选取2017~2019 年我院肺血管病中心收治的12 例临床诊断为CPFE 并发肺动脉高压患者为研究对象。所有患者入院后均进行了详细的肺动脉高压病因筛查,包括常规生化检验、动脉血气分析、风湿免疫抗体筛查、X 线胸片、胸部高分辨CT、肺功能、超声心动图、6 分钟步行试验、心肺运动试验、肺动脉CT 增强扫描、核素肺灌注显像和右心导管术等检查。胸部高分辨CT 肺纤维化或(和)肺气肿的诊断标准[3]:(1)肺纤维化:以下肺野和肺外周为主的蜂窝状和网格状改变,肺组织结构破坏,牵张性支气管扩张,可有局部实变或(和)磨玻璃影。(2)肺气肿:边界清楚的低密度区,无壁或薄壁(<1 mm),或肺大疱(>1 cm)。CPFE 并发肺动脉高压的诊断主要依据患者的人口学特点、病史、胸部高分辨CT 影像、肺功能和右心导管检查结果,并排除引起肺动脉高压的其他病因。
统计学方法:采用SPSS 23.0 统计软件统计数据,计数资料以率(%)表示,计量资料以均值±标准差表示。
2 结果
2.1 12 例CPFE 并发肺动脉高压患者的临床及肺功能特征(表1)
本组12 例患者中,83.3%为老年男性,起病年龄在50~73 岁,平均年龄(61.25±8.13)岁。83.3%患者目前或既往有吸烟史,平均19 支/d,平均吸烟(36.70±9.89)年,从症状出现到就诊我院的平均时程为(1.58±1.72)年。12 例患者均以“活动后胸闷、气短”为主诉,其他症状包括晕厥或黑矇(2 例)、乏力(3 例)、咳嗽咳痰(1 例)等。3 例患者来院时口唇紫绀,11 例患者查体可闻及P2 亢进。多数患者同时合并其他疾患,如冠心病(3 例)、高脂血症(3 例)、高血压(2 例)、肌间静脉血栓(2 例)、高尿酸血症(2 例)、肿瘤史(1 例贲门癌、1 例前列腺癌)、糖尿病或糖耐量异常(2 例)、丙型肝炎(1 例)、胃十二指肠溃疡(1 例)等。
实验室检查显示,平均血沉(9.36±7.66) mm/h,平均C 反应蛋白(4.68±3.69)mg/L,补体C3、补体C4 均在正常范围;所有患者免疫疾病相关抗体均未见异常。
表1 12 例CPFE 并发肺动脉高压患者的临床及肺功能特征()
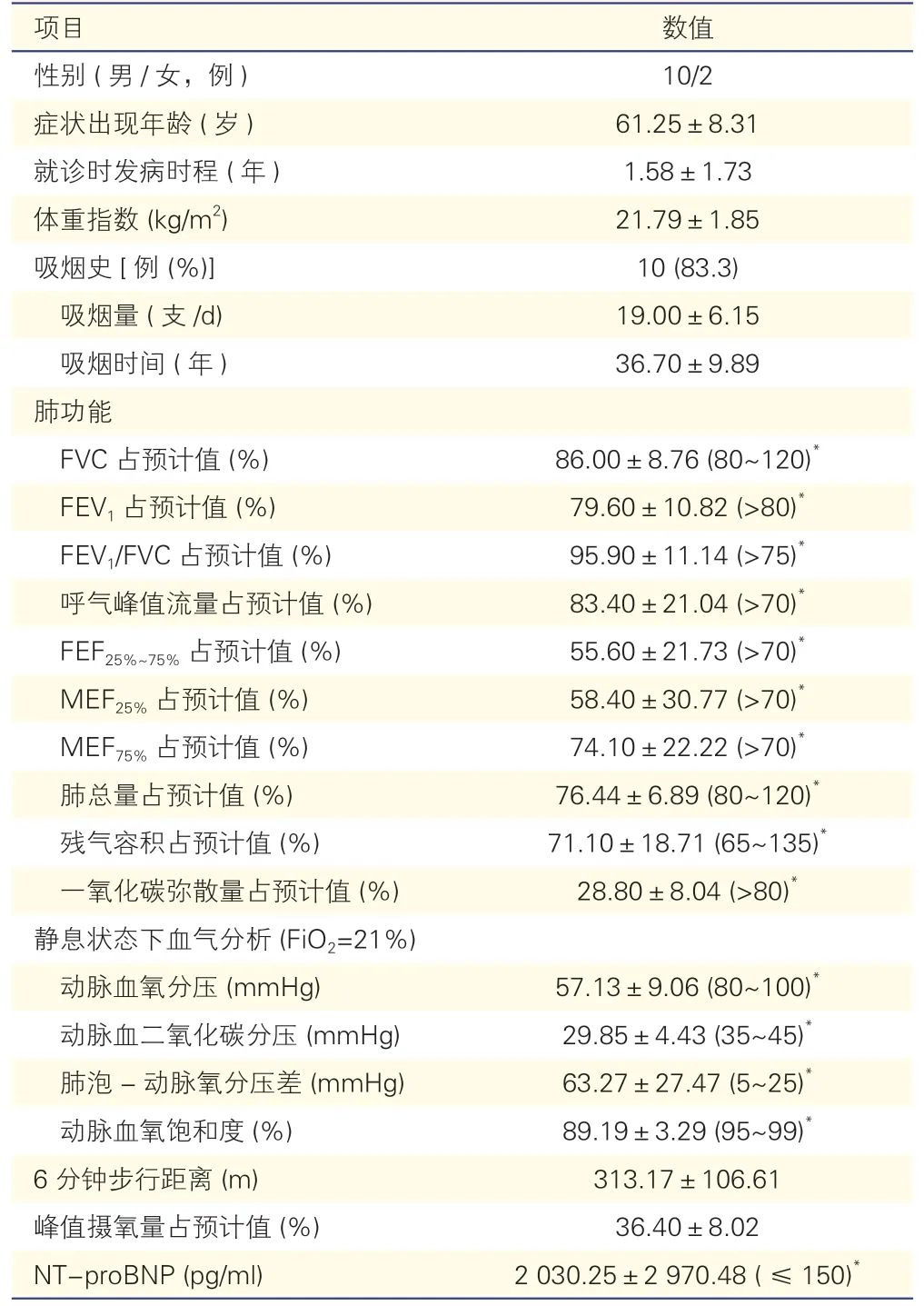
表1 12 例CPFE 并发肺动脉高压患者的临床及肺功能特征()
注:CPFE:肺纤维化合并肺气肿综合征;FVC:用力肺活量;FEV1:第一秒用力呼气容积;FEV1/FVC:第一秒用力呼气容积与用力肺活量比值;FEF25%~75%:用力呼出25%~75%肺活量时瞬间呼气流量;MEF25%:用力呼出25%肺活量时的最大呼气流量;MEF75%:用力呼出75%肺活量时的最大呼气流量;FiO2:吸入氧浓度;NT-proBNP:N 末端B 型脑钠肽原;*:对应参数正常范围。1 mmHg=0.133 kPa
患者肺功能检查主要表现为:弥散功能严重受损,一氧化碳弥散量(DLCO)占预计值(28.80±8.04)%;通气功能基本正常或轻度下降,第一秒用力呼气容积(FEV1)占预计值(79.60±10.82)%,第一秒用力呼气容积与用力肺活量比值(FEV1/FVC)占预计值(95.90±11.14)%;同时小气道阻力中度增加,用力呼出25%~75%肺活量时瞬间呼气流量(FEF25%~75%)占预计值(55.6±21.73)%,用力呼出25%肺活量时的最大呼气流量(MEF25%)占预计值(58.4±30.77)%;肺总量不低,残余气体量也无明显升高。未吸氧状态下血气分析提示,平均动脉氧分压为(57.13±9.06)mmHg(1 mmHg=0.133 kPa),动脉血氧饱和度为(89.19±3.29)%,肺泡-动脉氧分压差显著升高,为(63.27±27.47)mmHg。患者的运动耐量下降,6 分钟步行距离为(313.17±106.61)m;心肺运动试验显示平均峰值摄氧量降低,占预计值(36.40±8.02)%。
入院时超声心动图检查提示,CPFE 并发肺动脉高压患者的右心室内径增大为(32.09±5.79)mm,三尖瓣瓣环位移距离缩短为(16.36±3.50)mm,7例(58.3%)患者深吸气时下腔静脉塌陷率<50%,而左心结构及功能均无明显异常。
2.2 12 例CPFE 并发肺动脉高压患者的血流动力学数据(表2)
12 例患者均行右心导管检查,血流动力学检查显示,CPFE 并发肺动脉高压患者的肺动脉平均压为(43.45±11.05)mmHg,肺小动脉楔压正常,提示为毛细血管前性肺动脉高压;患者的肺血管阻力显著升高为(10.25±5.12)Wood 单位,心指数下降为(2.81±0.69)L/(min·m2)。
表2 12 例CPFE 并发肺动脉高压患者的血流动力学数据()

表2 12 例CPFE 并发肺动脉高压患者的血流动力学数据()
注:CPFE:肺纤维化合并肺气肿综合征。1 mmHg=0.133 kPa
2.3 CPFE 并发肺动脉高压患者的胸部高分辨CT 表现(表3、图1)
本研究中CPFE 患者胸部高分辨CT 有不同程度肺纤维化及肺气肿,部分患者可见纵隔淋巴结增大及小叶间隔增厚等。患者肺纤维化以双肺下叶分布多见(41.7%),其次双肺上叶及纵隔旁分布。肺气肿者11 例(91.7%),可局限于双上肺,也可呈双肺弥漫分布。

表3 12 例CPFE 并发肺动脉高压患者的胸部高分辨CT 表现[例(%)]

图1 肺纤维化合并肺气肿综合征患者胸部高分辨CT 表现
3 讨论
CPFE 是近20 年来被逐渐认识的肺部疾病,越来越受到呼吸科医生的关注[8-9]。多数学者认为,CPFE 是独立于肺纤维化及肺气肿的另一类呼吸系统疾病,有其独特的临床表现、肺功能特征、影像学、组织病理学改变以及临床转归[10-11]。本研究从人口学特点、影像学及血流动力学检查等各方面对CPFE 并发肺动脉高压患者的临床特点进行分析。
CPFE 多见于长期大量吸烟的老年男性[12],文献报道人群发病年龄在65~70 岁之间[13],本研究中的患者也多为60 岁以上的老年男性。吸烟可以引起支气管炎症,进而导致管腔狭窄、肺泡壁破坏,最终出现肺纤维化、肺气肿,目前被认为是CPFE 的主要病因。值得注意的是,本研究中有2 例为女性患者,既往均无吸烟史,临床上分别合并有糖耐量异常及丙型肝炎。文献中也曾报道,反流性食道炎是CPFE 的高危因素[14],可引起反复的微量胃酸吸入,对肺组织产生反复刺激,增加肺组织纤维化的风险。其他如自身免疫性疾病、矿物粉尘接触等均与CPFE 的发生有关[15-16],提示各种慢性炎性刺激或可触发CPFE 的发生、发展,然而具体发病机制及病理生理过程仍有待更进一步研究证实。
CPFE 患者的肺功能特点与特发性肺纤维化、单纯的肺气肿或慢性阻塞性肺病患者的肺功能有很大区别。如前文所述,CPFE 患者的通气功能指标,包括FVC、FEV1、FEV1/FVC 等均基本正常或仅轻度下降;患者的肺总量、残气量等也未见明显增加,但患者小气道阻力增加,弥散功能显著下降。这是由于肺气肿过度膨胀的肺容积与肺纤维化导致的限制性肺容积缩小相互抵消,但肺容积膨胀和肺容积缩小都会增加肺气道阻力,协同恶化肺部弥散功能。且CPFE 患者弥散功能下降程度,往往与预后相关[17]。所以,临床上患者肺通气功能基本正常,但弥散功能显著降低,与气道阻塞程度和肺容量不成比例,同时中小气道阻力明显增高者,需要警惕CPFE 可能。少数情况下,CPFE 甚至可以表现为单纯弥散功能障碍[18-19],故单纯弥散功能障碍的鉴别诊断需要包括CPFE[9],胸部高分辨CT 检查有助于明确诊断。
本研究中,胸部高分辨CT 提示,CPFE 并发肺动脉高压患者较为特异性的影像学表现为双肺上叶肺气肿及双肺下叶肺纤维化,部分患者肺气肿及肺纤维化呈局限性分布。若患者的影像学改变不典型或在疾病的初期,往往与特发性肺纤维化、肺气肿难以区分。有文献指出,腺泡远端型肺气肿(即胸膜下或纵隔旁肺气肿)与吸烟密切相关[20],并且被认为是CPFE 患者的特征性影像学表现[3];同时也有文献指出,厚壁囊样改变是CPFE 的独有的影像学及病理学改变[10]。值得注意的是,本研究中1 例患者的胸部高分辨CT 并未表现典型肺气肿改变,肺实质病变很轻,甚至在胸部高分辨CT 不容易辨识。既往文献也曾报道,部分CPFE 患者可无上述特征性胸部影像学表现或仅表现轻微肺实质损害[19],因此综合患者的肺功能检查、病史等,对提高CPFE诊断准确率有重要帮助。另外,部分CPFE 患者在胸部高分辨CT 也可见纵隔淋巴结肿大及小叶间隔增厚,且CPFE 患者肺功能常常合并严重弥散功能受损,需与肺静脉闭塞病相鉴别[21]。肺静脉闭塞病的特征性影像学表现为弥漫分布的肺磨玻璃影,罕见肺纤维化及肺气肿等肺实质改变;且患者发病年龄较小,一般无大量吸烟史,均可作为两者鉴别要点。
CPFE 患者并发肺动脉高压的比例高于其他肺部疾病患者,文献报道可达47%~90%[3],从发现到进展为动脉性肺动脉高压约16 个月[6]。本研究中患者的肺动脉平均压及肺血管阻力明显升高,心指数下降,与文献报道一致[6]。一旦出现右心功能下降,往往提示预后不良[22]。CPFE 病理上既可见弥漫肺泡损伤,同时也可见广泛的肺血管病变,包括肺小动脉及小静脉内膜纤维性增厚及中膜细胞增生;而且无论在肺纤维化或是肺气肿病变区域,还是在相对正常区域,均可见上述肺血管病变[11],提示CPFE 患者的肺实质病变与肺血管病变并存,且呈弥漫性分布。因为CPFE 患者肺血管病变是弥漫性的,患者肺血管阻力显著升高,继而出现严重肺动脉高压及进行性右心功能下降;同时由于肺血管床管壁呈广泛增厚改变,肺泡内氧气弥散距离增加,肺弥散功能下降。
CPFE 常并发严重肺动脉高压,往往加速病情发展,治疗棘手,预后极差。目前缺乏CPFE 的针对性治疗手段,戒烟是基本措施;低氧患者需要接受长期家庭氧疗。常规呼吸科用药,如糖皮质激素、免疫抑制剂及支气管扩张剂等,治疗CPFE 的效果均不佳,且目前也缺乏大样本量循证证据支持[9,23];对于并发肺动脉高压者是否需要给予肺动脉高压的靶向药物同样缺乏循证医学证据[7],仅见零星个案报道[24]。因为CPFE 缺乏有效的治疗措施,一般建议患者尽早进行肺移植评估[12]。
综上所述,临床上进行肺动脉高压病因筛查时,如发现患者为长期吸烟的老年男性,病情进展快,胸部CT 表现为肺气肿和肺纤维化并存,肺功能主要表现为弥散功能明显降低时,需要警惕CPFE。
利益冲突:所有作者均声明不存在利益冲突
