miR-593-5p调控肝癌细胞增殖、迁移及侵袭的机制
2020-11-04钟腾猛黄俊玲李广志陆炳站
钟腾猛 黄俊玲 李广志 陆炳站
肝癌是全球常见的恶性肿瘤之一,发病率逐年上升[1]。据统计,2014年中国肝癌新增病例约36.48万例(男26.89万例,女9.59万例),死亡病例约31.88万例(男23.35万例,女8.53万例)[2]。肝癌预后差,患者5年内生存率不足15%,已成为全球第二大常见的癌症死亡原因[3]。因此,迫切需要对肝癌发病和转移的机制进行全面阐明。微小RNAs(MicroRNAs,miRNAs/miRs)是一种保守的非编码小RNAs,通过靶向多个分子参与调控基因表达[4],miRNAs失调是包括癌症在内的多种病理状态的生物标志物。研究表明,miRNAs的异常表达参与多种人类癌症的侵袭和转移过程[5,6]。微小RNA-593-5p(MicroRNA-593-5p,miR-593-5p)在胃癌组织中表达下调,其低表达量与胃癌患者临床病理特征密切相关,miR-593-5p过表达可明显抑制胃癌细胞增殖[7]。miR-593通过调控PLK1基因表达抑制结肠癌细胞增殖,并发挥抑癌基因作用[8]。在人胃癌MGC-803细胞中上调miR-593-5p表达会抑制裸鼠移植瘤模型胃癌细胞生长,侵袭、转移[9]。本研究以肝癌细胞为对象,利用qPCR、MTT及Transwell小室法等技术检测miR-593-5p在肝癌细胞中的表达及其对肝癌细胞增殖、迁移和侵袭的影响,并进一步探索其可能的分子机制,为肝癌的临床诊治提供潜在的生物标志物和治疗靶点。
1 材料与方法
1.1 主要材料与仪器 人肝癌细胞系Hep3B、HepG2、SMMC-7721、Huh7和正常人肝细胞HL7702购自美国ATCC细胞库,DMEM培养基、胎牛血清购自美国GIBCO公司,胰酶、MTT、二甲基亚砜(Dimethyl sulphoxide,DMSO)购自美国Sigma公司,TRIzol、Lipofectamine 2000购自Invitrogen公司,miR-593-5p、anti-miR-593-5p、pcDNA-PHF10购自广州锐博生物有限公司,RIPA裂解液、十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(Sodium dodecyl sulfate-polyacrylamide gelelectrophoresis,SDS-PAGE)凝胶配制试剂盒购自碧云天生物技术研究所,甘油醛-3-磷酸脱氢酶(Glyceraldehyde-3-phosphate dehydrogenase,GAPDH)、细胞周期蛋白D1(CyclinD1)、p21、E-钙黏蛋白(E-cadherin)、波形蛋白(Vimentin)、磷脂酰肌醇-3激酶(Phospoinositide 3-kinase,PI3K)、磷酸化磷脂酰肌醇-3激酶(p-PI3K)、蛋白激酶B(Protein kinase B,Akt)和磷酸化蛋白激酶B(p-Akt)抗体购自美国Cellular Signaling Technology公司,辣根过氧化物酶标记二抗购自博士德生物公司,Transwell小室购自美国Corning公司,Matrigel基质胶购自美国BD公司,其他生化试剂为国产分析纯。ABI 7500荧光定量PCR仪购自美国ABI公司,凝胶成像系统购自Bio-Rad公司。
1.2 细胞培养与转染 Hep3B、HepG2、SMMC-7721、Huh7和HL7702细胞复苏后,在含10%胎牛血清的DMEM培养基,5% CO2、37℃培养箱中培养,待细胞融合至70%~80%,加入胰酶消化传代。细胞转染前24 h,收集生长状态良好的SMMC-7721细胞,以1×105个/ml的密度接种于6孔板。待细胞融合至70%~80%时,根据不同的实验目的,严格按照Lipofectamine 2000试剂说明书步骤,将miR-593-5p、anti-miR-593-5p及各自阴性对照转染入SMMC-7721细胞。转染48 h后,收集细胞备用。
1.3 qPCR检测miR-593-5p和PHF10 mRNA表达 细胞加入TRIzol试剂充分提取总RNA,逆转录成cDNA,以制备的cDNA为模板,利用qPCR检测miR-593-5p和PHF10 mRNA水平。miR-593-5p上游引物序列为5’-CACCAGCCAGGCATTGCTC-3’下游引物序列为5’-CTCAACTGGTGTCGTGGA-3’; PHF10上游引物序列为5’-TCCAGATTTAGAGCGACGAGA-3’,下游引物序列为5’-TGCGCAATGCTGTTAAGCCT-3’;U6上游引物序列为5’-GCTTCGGCAGCACATATACTAAAAT-3’,下游引物序列为5’-CGCTTCAGAATTTGCGTGTCAT-3’。采用2-ΔΔCt法计算miR-593-5p和PHF10 mRNA表达量。
1.4 MTT检测SMMC-7721细胞增殖 SMMC-7721细胞使用胰酶消化后,调整细胞密度为5×104个/ml,接种于96孔细胞板。分别培养24 h、48 h和72 h,每孔加入100 μl 5 mg/ml MTT溶液,37℃反应4 h,弃上清液,每孔加入200 μl DMSO,37℃摇床反应10 min,于酶标仪读取每孔细胞在490 nm波长处的吸光度值(OD490nm值),细胞OD490nm值越大,细胞活性越强。
1.5 蛋白质印迹法(Western blot)检测目的蛋白表达 细胞中加入磷酸盐缓冲液(Phosphate-buffered saline,PBS)充分洗涤,使用RIPA裂解液,冰浴条件下裂解30 min,提取总蛋白。加入缓冲液,沸水处理10 min,使蛋白变性,吸取等量蛋白经SDS-PAGE分离蛋白,并转移到聚偏二氟乙烯(Polyvinylidene fluoride,PVDF)膜,使用5%脱脂奶粉室温条件下封闭1 h,用1∶1 000稀释的一抗4℃封闭过夜,用1∶5 000稀释的二抗室温反应2 h,ELC发光液曝光显色,以GAPDH为参照,分析蛋白条带灰度值。
1.6 Transwell小室法检测SMMC-7721细胞迁移和侵袭 在SMMC-7721细胞迁移实验中,用无血清培养基重悬细胞,制成5×105个/ml的细胞悬液,吸取100 μl接种于Transwell上室,下室加入500 μl含10%胎牛血清的培养基。37℃孵育24 h,之后用棉签擦除多余细胞,甲醛固定15 min,结晶紫染色15 min,统计迁移细胞数。在SMMC-7721细胞侵袭实验中,将100 μl Matrigel胶与500 μl无血清培养基充分混合,吸取50 μl 于Transwell上室,37℃静置3~4 h。其余步骤同迁移实验。
1.7 双荧光素酶报告基因 通过starBase(http://starbase.sysu.edu.cn/)网站预测出PHF10的3’非编码区域(3’untranslated region,3’UTR)中含有与miR-593-5p互补的核苷酸序列。分别构建野生型PHF10(PHF10-WT)、突变型PHF10(PHF10-MUT)3’UTR双荧光素酶报告质粒,并与miR-593-5p共转染,培养48 h 后,测定细胞双荧光素酶活性。

2 结果
2.1 肝癌细胞系中miR-593-5p的表达量 qPCR检测结果显示,与正常肝细胞HL7702相比,人肝癌细胞系Hep3B、HepG2、SMMC-7721、Huh7中miR-593-5p表达量显著减少(P<0.05),PHF10 mRNA表达量显著增加(P<0.05)。其中,SMMC-7721细胞中miR-593-5p表达量差异最显著,因此后续研究选择SMMC-7721细胞为实验对象。见表1。
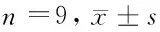
表1 肝癌细胞系中miR-593-5p的表达量
2.2 miR-593-5p过表达对肝癌SMMC-7721细胞增殖的影响 在SMMC-7721细胞中转染miR-593-5p,MTT法检测细胞增殖,结果发现,miR-593-5p过表达较miR-NC组显著降低24 h、48 h和72 h的细胞活性(P<0.05)。Western blot检测SMMC-7721细胞增殖相关蛋白表达,结果发现,miR-593-5p过表达较miR-NC组显著减少CyclinD1蛋白表达量,增加p21蛋白表达量,二者均差异有统计学意义(P<0.05)。见表2,图1。
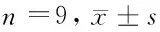
表2 miR-593-5p过表达对肝癌SMMC-7721细胞增殖的影响
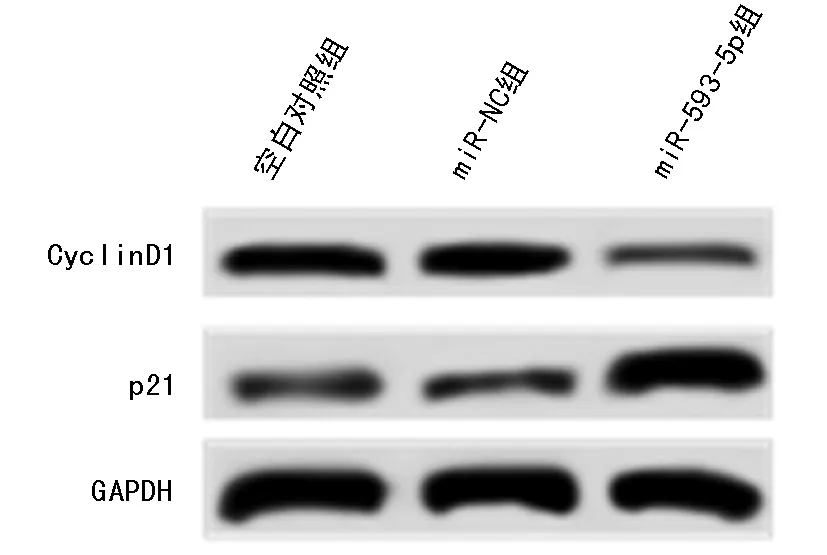
图1 miR-593-5p过表达对肝癌SMMC-7721细胞增殖相关蛋白表达的影响
2.3 miR-593-5p过表达对肝癌SMMC-7721细胞迁移及侵袭的影响 Transwell小室法检测SMMC-7721细胞迁移和侵袭能力,结果显示,miR-593-5p过表达较miR-NC组大幅减少迁移细胞数和侵袭细胞数(P<0.05)。Western blot检测结果显示,miR-593-5p过表达较miR-NC组增加E-cadherin蛋白表达量,降低Vimentin蛋白表达量,差异有统计学意义(P<0.05)。见表3,图2。
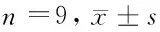
表3 miR-593-5p过表达对肝癌SMMC-7721细胞迁移及侵袭的影响
2.4 miR-593-5p靶向调控PHF10表达 starBase网站预测miR-593-5p下游靶基因,结果发现,PHF10的3’UTR中部分碱基可与miR-593-5p互补配对。双荧光素酶报告实验进行验证,结果显示,miR-593-5p显著降低野生型PHF10(PHF10-WT)荧光素酶相对活性(P<0.05),而不影响突变型PHF10(PHF10-MUT)荧光素酶相对活性。Western blot检测结果发现,anti-miR-593-5p组PHF10蛋白表达量显著高于anti-miR-NC组,miR-593-5p组PHF10蛋白表达量显著低于miR-NC组(P<0.05)。见表4、5,图3、4。
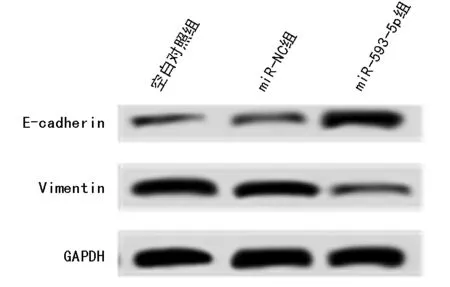
图2 miR-593-5p过表达对肝癌SMMC-7721细胞迁移及侵袭相关蛋白表达的影响
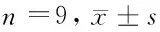
表4 双荧光素酶报告实验
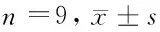
表5 miR-593-5p负向调控PHF10表达
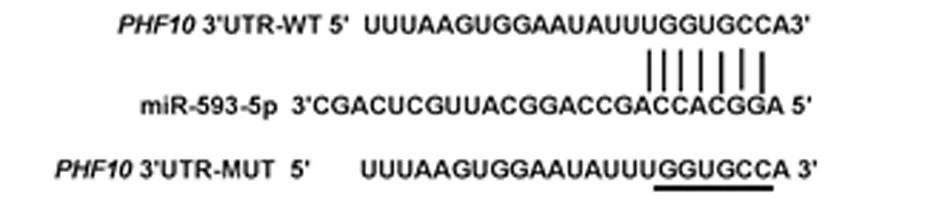
图3 PHF10的3’UTR中含有与miR-593-5p互补的核苷酸序列
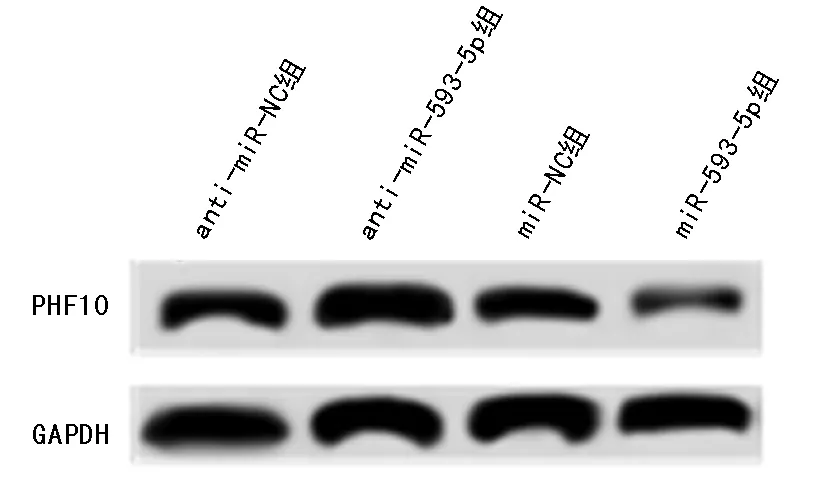
图4 miR-593-5p负向调控PHF10的表达
2.5 PHF10过表达逆转miR-593-5p过表达对肝癌SMMC-7721细胞增殖、迁移及侵袭的抑制作用 与miR-NC组相比,miR-593-5p过表达显著影响SMMC-7721细胞活性、迁移细胞数、侵袭细胞数和CyclinD1、E-cadherin、Vimentin蛋白表达,结果同2.2和2.3。与miR-593-5p+pcDNA组相比,miR-593-5p和pcDNA-PHF10共转染入SMMC-7721细胞明显提高24 h、48 h和72 h的细胞活性、迁移细胞数、侵袭细胞数、CyclinD1和Vimentin蛋白表达量,降低E-cadherin蛋白表达量,上述差异均有统计学意义(P<0.05)。见表6,图5。
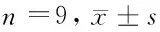
表6 PHF10过表达逆转miR-593-5p过表达对肝癌SMMC-7721细胞增殖、迁移及侵袭的抑制作用

图5 Western blot法检测各组细胞增殖、迁移及侵袭相关蛋白表达
2.6 PHF10过表达逆转miR-593-5p过表达对肝癌SMMC-7721细胞PI3K/Akt 信号通路相关蛋白表达的影响 与miR-NC组相比,miR-593-5p过表达对SMMC-7721细胞中PI3K和Akt蛋白表达量无显著影响,而明显降低p-PI3K和p-Akt水平(P<0.05)。与miR-593-5p+pcDNA组相比,miR-593-5p和pcDNA-PHF10共转染对SMMC-7721细胞中PI3K和Akt蛋白水平无明显影响,显著增加p-PI3K和p-Akt蛋白表达量(P<0.05)。见表7,图6。
3 讨论
miRNAs是一类长度为21~25个核苷酸的内源性小型非编码RNA,在进化过程中高度保守,miRNAs碱基在其靶信使RNA(mRNA)的3,UTR具有特定结合位点,转录后调控基因表达[10]。miRNAs参与细胞增殖、分化、凋亡、存活、侵袭和迁移等多种生物学过程[11-13]。既往研究表明,miR-593-5p与肿瘤细胞的发生发展密切相关,如胶质瘤[14],舌鳞状细胞癌[15],口腔鳞状细胞癌[16]等。miR-593-5p在原发胃肿瘤淋巴转移阳性的患者中表达下调[17]。miR-593-5p在胃癌患者和胃癌细胞系中表达下调,miR-593-5p与胃癌患者肿瘤大小及远处转移显著相关;在体外,miR-593-5p抑制SGC-7901和MGC-803细胞的增殖、迁移和侵袭,并在G0/G1期抑制细胞周期;在体内,miR-593-5p也抑制肿瘤生长和转移[18]。miR-593在食管癌细胞系中的表达量低于正常食管上皮细胞,miR-593模拟物显著抑制食管癌细胞增殖,可能发挥肿瘤抑制功能[19]。本研究中,miR-593-5p在肝癌细胞系Hep3B、HepG2、SMMC-7721、Huh7中表达显著下调,与在胃癌、食管癌[18,19]等的表达情况一致。miR-593-5p过表达显著降低24 h、48 h和72 h的细胞活性、迁移细胞数和侵袭细胞数,显著减少CyclinD1、Vimentin蛋白表达量,增加p21、E-cadherin蛋白表达量。表明miR-593-5p过表达抑制肝癌细胞增殖、侵袭和迁移能力,miR-593-5p在肝癌中发挥抑癌作用。
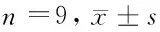
表7 PHF10过表达逆转miR-593-5p过表达对肝癌SMMC-7721细胞PI3K/Akt 信号通路相关蛋白表达的影响

图6 PHF10过表达逆转miR-593-5p过表达对肝癌SMMC-7721细胞PI3K/Akt 信号通路相关蛋白表达的影响
PHF10是PBAF的一个重要亚基,对神经分化、增殖和凋亡的控制至关重要[20]。根据报道,PHF10在多种恶性肿瘤中发挥癌基因作用,并可促进肿瘤细胞增殖[21]。PHF10高表达与肿瘤患者不良预后有关[22],但目前关于PHF10在肿瘤中的作用机制仍知之甚少。本实验中,qPCR检测结果显示,人肝癌细胞系Hep3B、HepG2、SMMC-7721、Huh7中PHF10 mRNA表达明显上调,提示PHF10可能参与肝癌进程。资料显示,PI3K/Akt信号通路在肝癌进程中扮演着重要角色[23]。阻断PI3K/Akt信号通路可明显抑制肝癌细胞增殖并促进细胞凋亡[24]。促进PI3K/Akt信号通路中Akt表达可增强肝癌细胞迁移及侵袭能力[25]。然而,miR-593-5p是否可通过调控PI3K/Akt信号通路而调控肝癌细胞增殖、迁移及侵袭尚未可知。本研究发现,miR-593-5p过表达明显降低p-PI3K和p-Akt蛋白水平,推测miR-593-5p影响肝癌细胞增殖、迁移及侵袭可能与介导PI3K/Akt信号通路有关。
为探讨PHF10与PI3K/Akt信号通路是否是miR-593-5p调控肝癌细胞增殖、迁移和侵袭的作用机制,本实验采用生物学信息预测与双荧光素酶报告实验证实PHF10是miR-593-5p的靶基因,上调或下调miR-593-5p表达明显调控PHF10蛋白水平,进一步证明miR-593-5p直接靶向调控PHF10表达。PHF10过表达逆转了miR-593-5p过表达抑制肝癌SMMC-7721细胞增殖、迁移及侵袭的作用,以及逆转了miR-593-5p过表达抑制肝癌SMMC-7721细胞中p-PI3K、p-Akt蛋白表达的作用。据此得出,miR-593-5p过表达直接靶向PHF10并抑制PI3K/Akt信号通路激活,从而发挥对肝癌细胞增殖、迁移和侵袭的抑制作用。
综上所述,miR-593-5p在肝癌细胞中表达下调,miR-593-5p通过靶向PHF10调控PI3K/Akt信号通路来影响肝癌细胞增殖、迁移和侵袭过程。
