下调垂体瘤转化基因1对胶质瘤细胞SHG44血管生成拟态及细胞周期的影响
2020-11-04崔立山张健莉冯三平吴德龙刘金凤
崔立山 林 婷 张健莉 冯三平 曹 洋 曹 颖 吴德龙 苏 砍 刘金凤
1.厦门市第五医院神经外科,福建厦门 361101;2.厦门大学医学院基础医学部,福建厦门 361102;3.厦门市第五医院神经内科,福建厦门 361101;4.厦门市中医院药剂科,福建厦门 361101
神经胶质细胞瘤约占原发性脑肿瘤的70%,且恶性肿瘤居多[1-3]。垂体瘤转化基因1(pituitary tumor-transforming gene,PTTG1)是一种常见致癌基因在多种肿瘤细胞中高表达,如结肠癌SW480,肝癌HepG2、Huh7,乳腺癌MCF-7以及卵巢癌SKOV3等[4-9],然而其对胶质瘤以及胶质瘤细胞血管生成拟态和细胞周期的影响未见报道。
本研究使用PTTG1 siRNA转染SHG44细胞沉默PTTG1基因,研究PTTG1表达降低对恶性胶质瘤细胞血管生成拟态和细胞周期的影响,同时探究PTTG1调控细胞周期的可能机制,从而为胶质瘤的临床治疗提供新的思路。
1 材料及方法
1.1 一般材料
SHG44细胞株(厦门大学眼科所馈赠);胰蛋白酶、胎牛血清、DMEM高(美国赛默飞世尔公司);PTTG1 siRNA、阴性对照siRNA及转染试剂(中国锐博生物科技有限公司);逆转录试剂盒(瑞士罗氏公司);Trizol(美国赛默飞世尔公司);SYBR Premix Ex TaqII(宝日医生物技术有限公司);BCA蛋白定量试剂盒(美国赛默飞世尔公司);PVDF膜(美国赛默飞世尔公司);羊抗鼠二抗、羊抗兔二抗(杭州联科生物技术股份有限公司);过硫酸铵(AP)、30%聚丙烯酰胺凝胶、牛血清清蛋白(BSA,中国索莱宝公司);蛋白抗体(美国赛默飞世尔公司);ECL化学发光法检测试剂盒(中国索莱宝公司);基质胶基底膜基质(美国康宁公司);PI细胞周期检测试剂盒(美国西格玛公司)。
1.2 仪器
T-Gradient梯 度 PCR 仪(德 国 Biometra公司);7300型荧光实时定量PCR仪(美国ABI公司);PowerPac Bio-rad电 泳 系 统(美 国 伯 乐 公司);IS4000R全自动图像工作站(美国柯达公司);Multiskan FC多功能酶标仪(美国赛默飞世尔公司);Beckman Gallios流式细胞仪(美国贝克曼库尔特有限公司);Olympus IX51倒置显微镜(日本奥林巴斯公司)。
1.3 实时定量PCR
将细胞沉默处理24h后,加入1mL Trizol裂解细胞,并依次加入氯仿、异丙醇、乙醇,进行一系列操作后提取到总RNA。配置成为20μL混合物后进行逆转录,此体系中包含了1 μg总RNA。扩增所用到的引物序列可以在表1中查找。按照荧光定量PCR检测试剂盒的说明进行实验。GAPDH作为内参,用2-ΔΔCT[ΔΔCt = (Ct目的基因-Ct管家基因)实验组- (Ct目的基因-Ct管家基因)对照组]计算目的基因 mRNA 的相对浓度。
1.4 蛋白质印迹
得到总蛋白后,使用BCA蛋白定量的方法检测细胞中蛋白含量。选择1%聚丙烯酰胺凝胶,随后利用PVDF膜进行湿转。BSA室温封闭1h。一抗在4℃冰箱内进行孵育过夜。隔日洗膜,室温孵育二抗,ECL试剂盒显影。使用 Image Station 4000R软件分析蛋白质条带灰度值[10]。
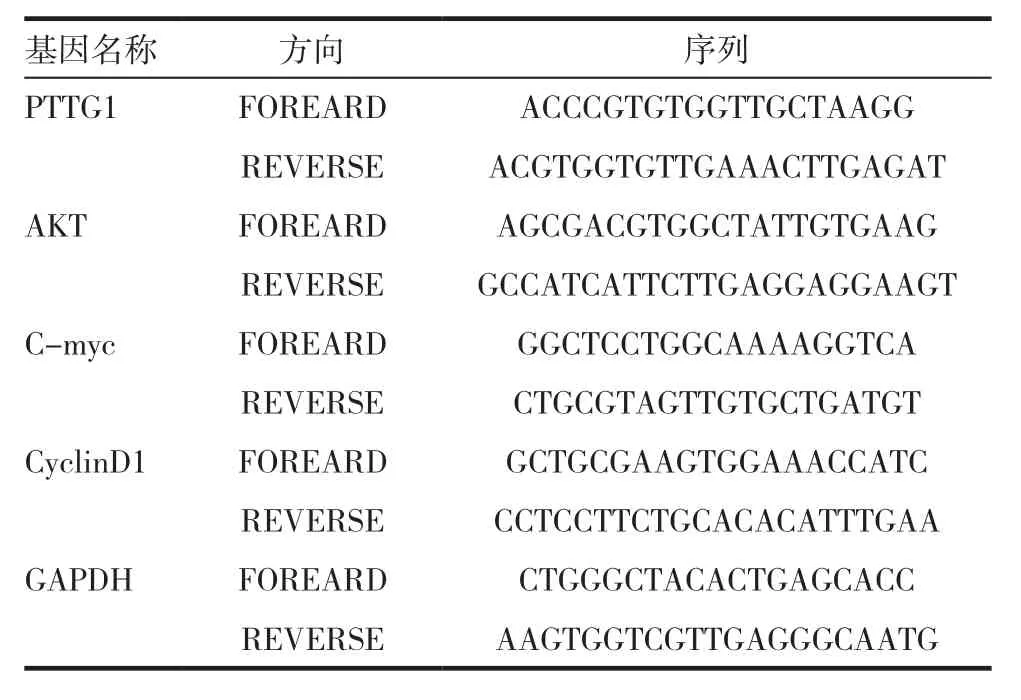
表1 qPCR引物序列
1.5 血管生成拟态形成实验
解冻基质胶,使用冷却移液管,将基质胶混合均匀。加入150μL基质胶作为细胞的生长表面,将板置于37℃下30min,形成基质膜即可。分别用PTTG1 siRNA或阴性对照siRNA转染SHG44细胞。siRNA 转染操作步骤如下:将 1X riboFECTTMCP Buffer和 riboFECTTMCP Reagent轻 轻 吹 打 混 匀,加 入20μM siRNA 储存液,颠倒混匀,室温孵育 15min。将转染液加入无双抗完全培养基,颠倒混匀。将培养板置于 37℃的CO2培养箱中培养 24h后换液。之后将 Matrigel Matrix 胶和 10% FBS DMEM 培养基1∶1混合均匀后加入24孔细胞培养板。凝固后每孔铺入105个细胞,24h后细胞附着于膜,利用倒置显微镜在明厂条件下观察细胞并拍照(物镜 10×)[11]。
1.6 流式细胞仪检测细胞周期
取对数期生长良好的SHG44细胞,PTTG1 siRNA或阴性对照siRNA以50nmol/L的浓度转染细胞。24h后胰酶消化细胞,离心后弃上清。PBS洗涤后加入70%的乙醇,4℃冰箱固定过夜。PBS洗涤后分别加入0.5mL染色缓冲液、25μL PI染液和 10μL RNase A。室温避光孵育 30min。使用美国Beckman Gallio流式细胞仪进行样品检测,并用Flowjo V10软件进行相应的统计分析。
1.7 统计学方法
2 结果
2.1 siRNA对PTTG1 mRNA和蛋白表达的影响
首先将 PTTG1 siRNA(50nmol/L)或阴性对照siRNA(NC siRNA)转染SHG44细胞,24h后通过 PCR 和 Western blot检测 PTTG1 mRNA 和蛋白质的表达。Control组与NC siRNA组mRNA和蛋白水平比较均差异无统计学意义(图1AB);与NC siRNA组相比,PTTG1 siRNA能够明显抑制PTTG1 mRNA(见图1A)和蛋白表达(图1B),P<0.001。
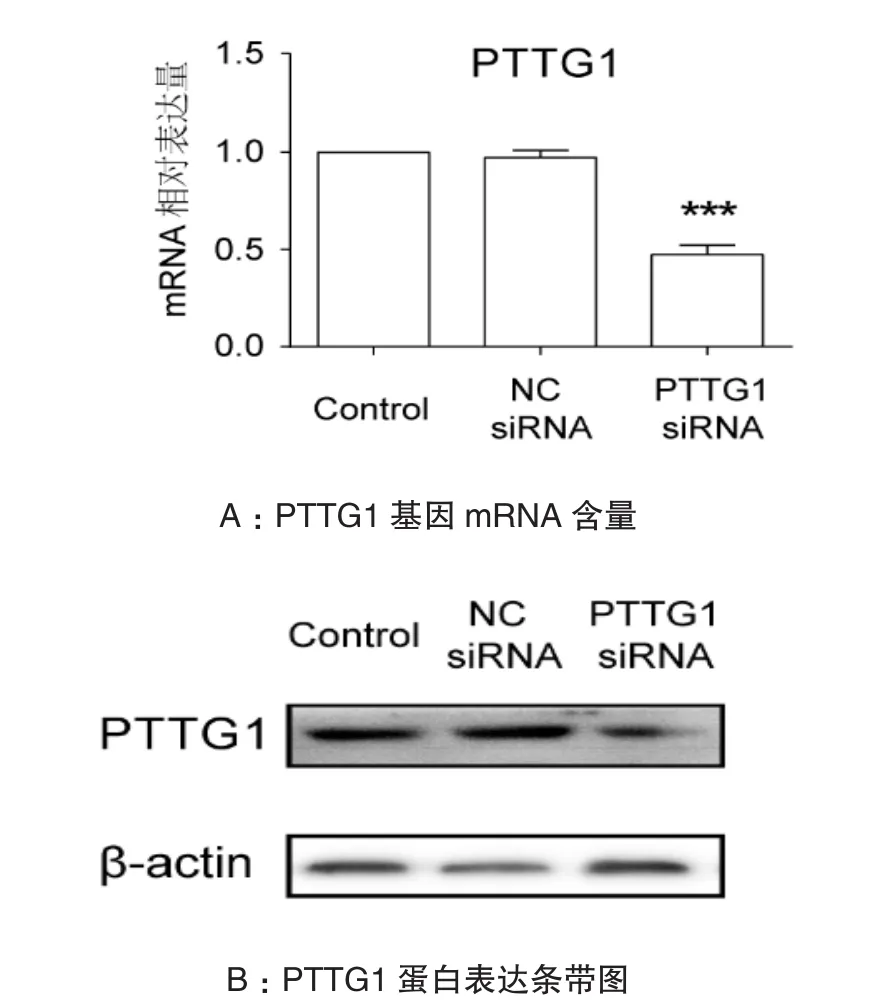
图1 PTTG1基因mRNA和蛋白的表达注:Control组PTTG1蛋白灰度值设为1,将其他组蛋白灰度比Control组灰度,得到相对灰度值,NC siRNA组为1.046,PTTG1 siRNA 组为 0.4819,与 NC siRNA 组比较, ***P < 0.001
2.2 降低PTTG1对SHG44细胞血管生成拟态的形成的影响
为了观察PTTG1的表达对SHG44细胞的血管生成拟态形成能力的影响,进行了血管拟态生成实验。结果发现:阴性对照siRNA(NC siRNA)组SHG44细胞成网格状,细胞紧密交联(图2Aa);而PTTG1 siRNA组细胞接近单个分布,并不形成网格状(图2Ab),即血管生成拟态形成能力受到抑制。NC siRNA组平均每视野细胞数量为(90.67±7.10)个,PTTG1 siRNA 组平均为(20.33±2.40)个,两组比较差异有统计学意义(P<0.001),见图2B。
2.3 抑制PTTG1的表达对SHG44细胞周期的影响
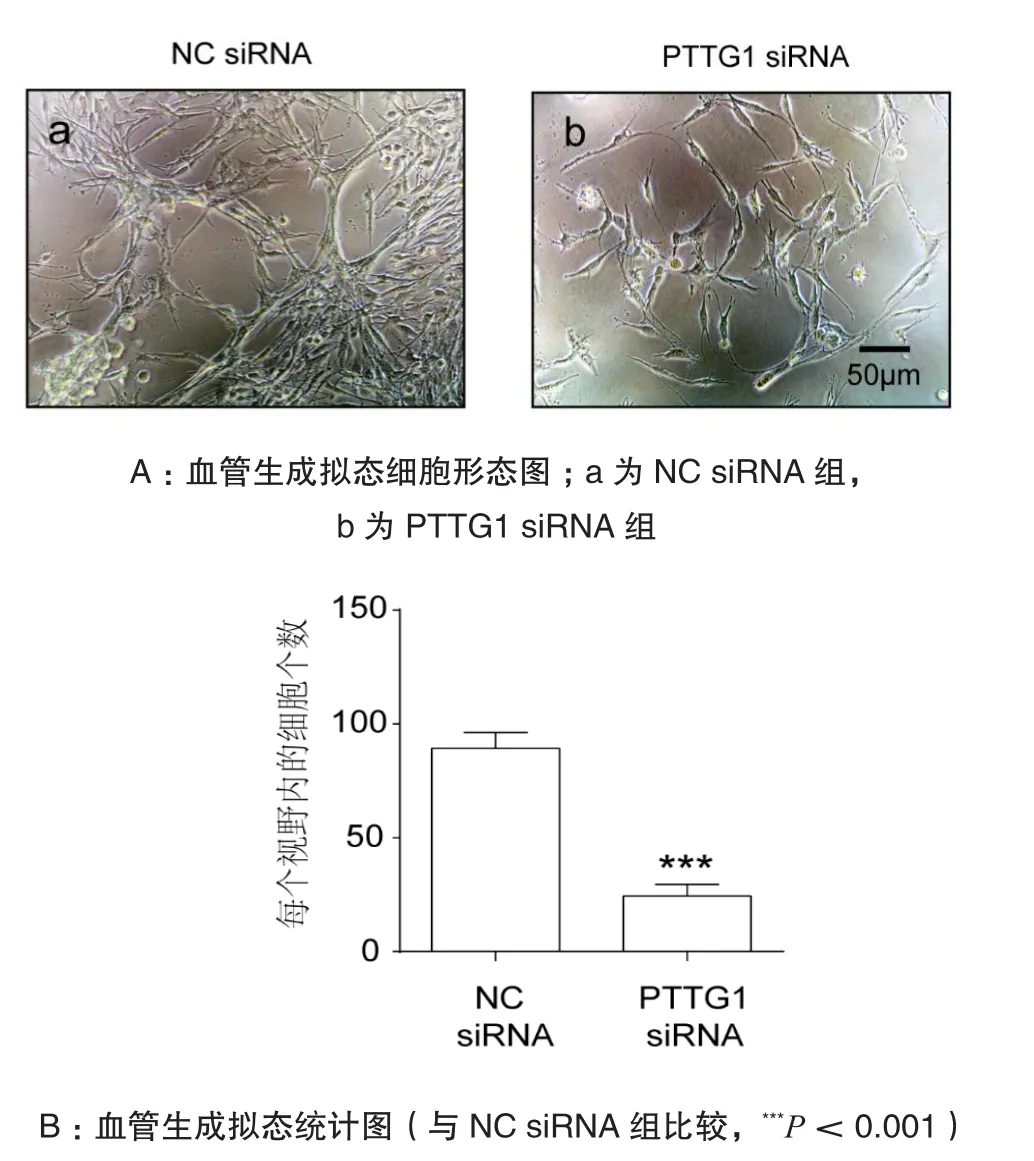
图2 血管生成拟态形态和统计图(10×)
通过流式细胞术对细胞中DNA含量进行测定(图3Aa-b)。结果发现:阴性对照NC siRNA组和PTTG1 siRNA组G1期细胞百分比分别为(45.53±2.221)%、(44.07±2.122)% (图3Ba);S期细胞百分比分别为(28.67±2.313)%、(20.67±0.8686)% (图3Bb);G2期细胞百分比分别为(20.57±1.033)%、(15.4±0.9609)% (图3Bc)。经t检验,两组间S期和G2期细胞百分比比较差异有统计学意义(P<0.05)。即在胶质瘤中,与NC siRNA组相比,PTTG1 siRNA组细胞增殖阻滞于G2/M期,细胞增殖受到明显抑制。
2.4 PTTG1调控SHG44细胞周期的作用机制
C-myc以及CyclinD1参与细胞增殖调控,还能够调节Wnt通路,是重要的原癌基因。且AKT信号通路的激活是调节C-myc蛋白表达的主要机制之一。本研究运用实时荧光定量PCR(图4A)和Western blot(图4B)进行了相关信号通路的探究,细胞周期相关蛋白的灰度值见表2。实验结果表明,与阴性对照siRNA组比较,PTTG1 siRNA组细胞中C-myc和CyclinD1 mRNA表达水平明显降低;p-AKT、C-myc和CyclinD1 蛋白表达水平明显降低。表明PTTG1可能通过AKT/C-myc/CyclinD1信号通路发挥相应的生物学作用。
3 讨论
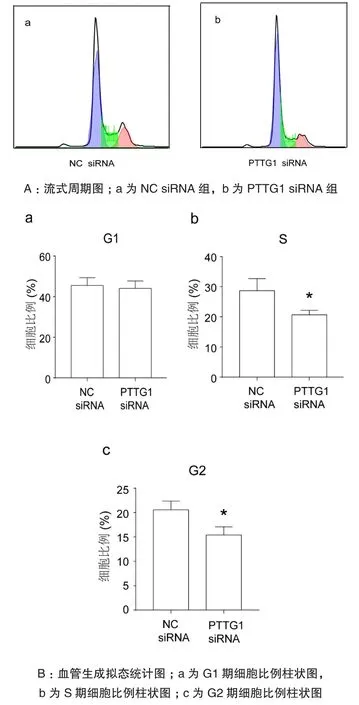
图3 SHG44细胞周期(与NC siRNA组比较,*P<0.05)

图4A

图4 细胞周期相关蛋白的表达
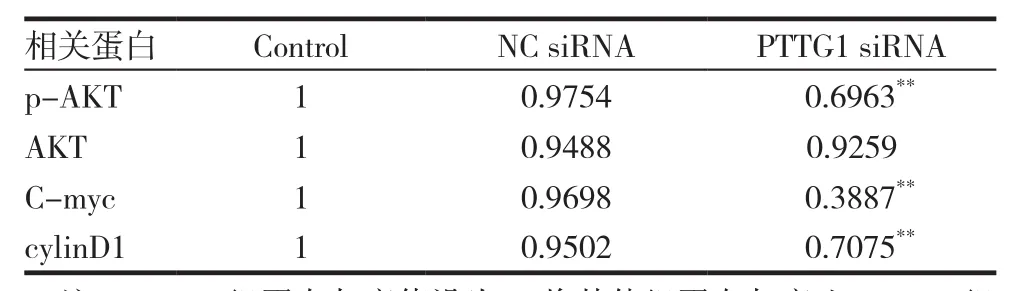
表2 细胞周期相关蛋白的灰度值
脑胶质瘤是临床上常见的恶性肿瘤,目前手术切除是主要的治疗方式,但对于恶性程度较高的患者手术切除的方式治疗效果不佳,所以寻找更好的治疗方法成为一种必然趋势[10-11]。PTTG1作为一种癌基因,其已被发现在细胞转化、增殖和肿瘤形成中具有重要作用。已有临床数据显示,PTTG1与恶性肿瘤患者的预后及中位生存率密切相关[12-17]。本课题组之前的研究发现,PTTG1在胶质瘤细胞SHG44中的表达水平可影响肿瘤迁移、侵袭等多种生物学特性,在此次研究中,本研究将进一步探究PTTG1作为肿瘤的一种重要调控基因,其对肿瘤血管生成拟态形成及细胞周期的影响[17-19]。
“血管生成拟态”成为新的衡量指标,在正常组织和肿瘤组织的区分中被提及。在这项研究中,本研究用Matrigel Matrix胶进行细胞血管生成拟态形成能力的检测,结果表明PTTG1 siRNA转染细胞24h后,神经胶质瘤细胞SHG44呈现单个分布,即细胞彼此之间不形成相互连接成网状的网络通道,表明PTTG1低表达抑制了SHG44细胞的血管生成拟态生成[20-22]。
脑胶质瘤难以攻克的原因之一是肿瘤细胞的恶性增殖能力,为了探究PTTG1对恶性胶质瘤细胞增殖周期的影响,本研究采用流式细胞术检测了SHG44细胞周期情况。结果显示,PTTG1 siRNA组细胞周期较NC siRNA组比较,细胞周期发生明显阻滞,即细胞增殖受到抑制。本研究运用PCR和Western blot进行了相关信号通路的探究。调节C-myc含量的机制之一是激活AKT。CyclinD1以及C-myc的共同点是参与到增殖过程中,还是调节Wnt通路的关键原癌基因。C-myc作为一种癌基因,影响了肿瘤周期等多种生物学特性,其对肿瘤发展进程的推动不可忽视。研究发现,PTTG1 siRNA组细胞中C-myc和CyclinD1 mRNA表达水平明显降低,p-AKT、C-myc和CyclinD1 蛋白表达水平明显降低,表明PTTG1可能通过AKT/C-myc/CyclinD1信号通路发挥相应的生物学作用。以上结果均提示PTTG1可能作为有效靶点参与了胶质瘤细胞血管生成拟态形成和细胞周期调节[22-23]。
综上所述,抑制PTTG1的表达可以抑制胶质瘤细胞的增殖分化,并降低其恶性程度,是胶质瘤临床治疗研究中的新思路。
